Legumain与大鼠动脉粥样硬化斑块的关系研究
2018-11-08方红城陈少源洪阿体方叶青张志军段成城李志芳
方红城,陈少源,洪阿体,方叶青,张志军,段成城,李志芳
动脉粥样硬化(AS)是临床心脑血管病的高发原因。基础研究表明,在动脉粥样硬化过程中巨噬细胞迁移、平滑肌细胞和纤维结缔组织增生、细胞内外脂质堆积是其主要特征[1]。炎症反应是AS发生发展的重要机制,炎症细胞中单核-巨噬细胞和淋巴细胞激活及其释放的炎症因子或细胞因子参与了AS病程的启动和发展[2,3]。Legumain又称天冬酰胺内肽酶,属于半胱氨酸蛋白酶家族,由Kembhavi首先在植物中分离所得,随后发现寄生虫和哺乳动物也有表达。Legumain参与了植物的超敏反应、细胞凋亡及种子贮存蛋白的沉积、哺乳动物机体的免疫、溶骨、肿瘤等多个病理生理过程[4,5]。在正常情况Legumain在哺乳类动物不表达或低水平表达,在酸性条件(PH 3-6)下被活化。新近研究发现,Legumain可能通过激活Cat-L等组织蛋白酶,参与动脉粥样硬化的过程。Legumain参与抗原呈递的过程,具有诱导单核巨噬细胞成熟和迁移的能力。而单核巨噬细胞功能异常可能与TLR4、MAPK、Smad3等信号传导系统有关,进而影响动脉粥样硬化斑块的稳定性[6,7]。本实验试图通过大鼠胸主动脉粥样硬化模型,探讨Legumain与动脉粥样硬化斑块的关系。
1 材料与方法
1.1 实验动物及试剂购买8~10周龄雄性Wistar大鼠,由中山大学动物实验中心提供。体重180~220 g,为无特定病原体(SPF)级动物。饲养于中山大学实验动物中心清洁级动物房(合格证号:第0056526号) 。
维生素D3注射液(VD3,上海通用药业股份有限公司);胆固醇、猪油、白糖、胆酸钠、丙基硫氧嘧啶及基础饲料均为实验动物中心提供(SPF级)。
1.2 方法
1.2.1 动物模型建立实验动物经适应性喂养1周后,鼠尾取血4 ml行血清学检查,作为基线资料。随机分为2组:对照组(CG)10只和实验组(EP)20只。实验组在饲养开始时腹腔注射维生素D3 2 ml/kg,分3次,连续3 d完成;饲喂高脂饲料(4%胆固醇、10%猪油、5%白糖、0.5%胆酸钠、0.2%丙基硫氧嘧啶及80.3%基础饲料)[8-10]。对照组给予基础饲料,使用相同的方法、剂量腹腔注射生理盐水。共喂养12周,每4周记录一次体重。大鼠喂养12周后,水合氯醛麻醉,鼠尾取血4 ml,分离取胸主动脉留检。
1.2.2 血清学检查2000 r/min离心20 min血液标本,获得血清。通过全自动血液化学分析仪分析,检测血清中总胆固醇(TC)、低密度脂蛋白(LDL-C)、高密度脂蛋白(HDL-C)、三酰甘油(TG)的浓度。动脉粥样硬化指数(AI)利用公式:AI=(TC-HDL)/HDL计算。酶联免疫吸附试验 (ELISA)测定血清Legumain(试剂来自Santa公司)。
1.2.3 切片HE染色超薄切片机对石蜡包埋组织块进行切片、固定于载玻片上。在室温下过夜干燥,然后进行染色。
1.2.4 免疫组化及免疫荧光分析福尔马林固定的胸主动脉,使用过氧化物酶标记的链霉卵白素生物素法。针对Legumain免疫染色,使用抗大鼠Legumain的多克隆抗体进行;苏木素复染,梯度酒精脱水、树脂封片,显微镜观察并选取典型视野拍照存片。所有的抗体来自Santa公司。
1.2.5 Western blot分析少量血管组织剪碎,取适量RIPA裂解液匀浆组织,取上清留检;测蛋白浓度后各样品取100 μg的总蛋白;配制聚丙烯酰胺凝胶、电转到硝酸纤维素膜,洗涤加入封闭液,室温温育2 h;将滤膜转到一抗鼠(1:200)的封闭液中,4℃振荡过夜。用TBST将滤膜洗3次,加入到对应的二抗鼠(1:2000)的封闭液中,室温避光温育1 h;用TBST将滤膜洗3次,最后用TBS洗膜1次;电泳。发光显影、分析;使用红外激光成像系统检测。抗体来自Santa公司。
1.2.6 RT-PCR测定Legumain的表达将30 mg组织样品加入TRK裂解液匀浆,加入氯仿混匀静置5 min后12 000 rpm离心,移液加入异丙醇静置10 min后离心,沉淀物用预冷的70%无水乙醇洗3次,空气干燥10 min,溶于20 μl DEPC水中,分光光度计测定RNA浓度。各样品取同量的RNA做逆转录成cDNA。cDNA做10倍稀释。GAPDH引物设计:F: 5'-TGGCTCTAACAGTCCGCCTAG-3';R:5'-AGTGCGACGTGGACATCCG-3'。Legumain引物设计: F:5'-GAGAAGTCGGTGAGCAAGGT GGT-3'; R:5'-GTTTGATCCTGTCCAGTGGGTAC-3'。Realtime PCR:50℃(2 min)→95℃(10 min),随后95℃(30 s)→60℃(30 s)重复40个循环,在4℃环境下保存。2%琼脂糖电泳溴化乙锭染色、点样、电泳后使用红外激光成像系统拍照并进行分析,用积分光密度比值表示mRNA相对表达量。定量PCR在ABI PRISM 7900测序系统进行。抗体来自Santa公司。
1.3 统计学分析计量数据以(±s)表示,两组间均数的比较采用t检验;计数资料采用例数(构成比)表示,组间比较采用χ2检验。所有数据使用SAS统计软件进行数据分析,P<0.05为差异有统计学意义。
2 结果
2.1 两组大鼠体重的变化实验组和对照组基线体重无明显差别;造模第4周开始,实验组体重增长缓慢,而对照组体重增长总体呈上升趋势;造模结束实验组体重显著低于对照组,差异有统计学意义(P<0.05)(表1)。
2.2 两组大鼠血脂和动脉粥样硬化指数实验组和对照组的血脂和动脉硬化指数起始无差别;造模12周后实验组TC、LDL和AI明显高于对照组,差别有统计学意义(P<0.05)(表2)。
表1 两组大鼠体重(g)变化的比较(±s)

表1 两组大鼠体重(g)变化的比较(±s)
注:与对照组相比,aP<0.05
时间 对照组(n=10) 实验组(n=20) P值基线 198.08±8.35 196.68±8.83 0.891 4周 293.83±6.06 237.11±11.28a <0.001 8周 372.67±5.91 257.76±14.37a <0.001 12周 413.42±7.70 260.75±21.72a <0.001
表2 两组大鼠血脂、动脉粥样硬化指数的比较(±s)
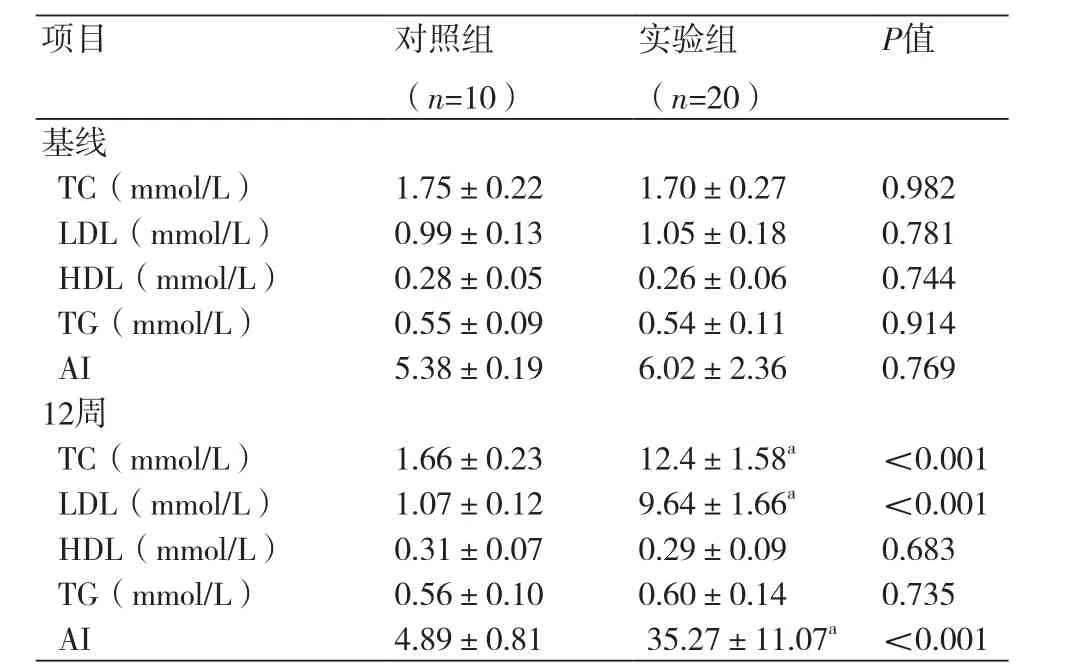
表2 两组大鼠血脂、动脉粥样硬化指数的比较(±s)
注:TC:总胆固醇;LDL:低密度脂蛋白;HDL:高密度脂蛋白;TG:三酰甘油;AI:动脉粥样硬化指数;与对照组相比,aP<0.05
项目 对照组(n=10)实验组(n=20)P值基线TC(mmol/L) 1.75±0.22 1.70±0.27 0.982 LDL(mmol/L) 0.99±0.13 1.05±0.18 0.781 HDL(mmol/L) 0.28±0.05 0.26±0.06 0.744 TG(mmol/L) 0.55±0.09 0.54±0.11 0.914 AI 5.38±0.19 6.02±2.36 0.769 12周TC(mmol/L) 1.66±0.23 12.4±1.58a <0.001 LDL(mmol/L) 1.07±0.12 9.64±1.66a <0.001 HDL(mmol/L) 0.31±0.07 0.29±0.09 0.683 TG(mmol/L) 0.56±0.10 0.60±0.14 0.735 AI 4.89±0.81 35.27±11.07a <0.001
2.3 两组大鼠血清Legumain水平两组基线Legumain无统计学差别;造模结束实验组Legumain显著高于对照组,差异有统计学意义(P<0.05)(表3)。
2.4 两组大鼠胸主动脉HE染色对照组在低倍镜下可见主动脉管腔规则;高倍镜下可见内膜完整光滑,内弹力板连续,中膜平滑肌细胞呈梭形、排列规整。实验组在低倍镜下可见主动脉有典型的AS形成,动脉管壁明显增厚,管腔狭窄不规则;高倍镜下可见内膜面内皮细胞缺失,内弹力板增厚,内膜下有不同程度的泡沫细胞积聚(图1)。
2.5 两组大鼠胸主动脉免疫组化正常对照组的血管壁内可见少量Legumain,Legumain主要分布在成纤维细胞和血管内皮细胞(EC)的细胞核内,少数胞浆中也有少量表达。实验组动脉粥样硬化斑块中Legumain表达显著增强,以单核-巨噬细胞核及胞浆内表达为主,细胞外间质中也有一定表达(图2)。
2.6 两组大鼠胸主动脉Legumain蛋白表达Western Blot显示实验组Legumain蛋白较对照组明显高表达,差异有统计学意义(P<0.05)(图3)。
表3 两组大鼠血清Legumain(ng/ml)的比较(±s)
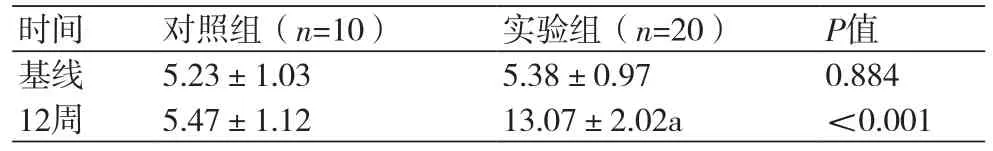
表3 两组大鼠血清Legumain(ng/ml)的比较(±s)
注:与对照组相比,aP<0.05
时间 对照组(n=10) 实验组(n=20) P值基线 5.23±1.03 5.38±0.97 0.884 12周 5.47±1.12 13.07±2.02a <0.001
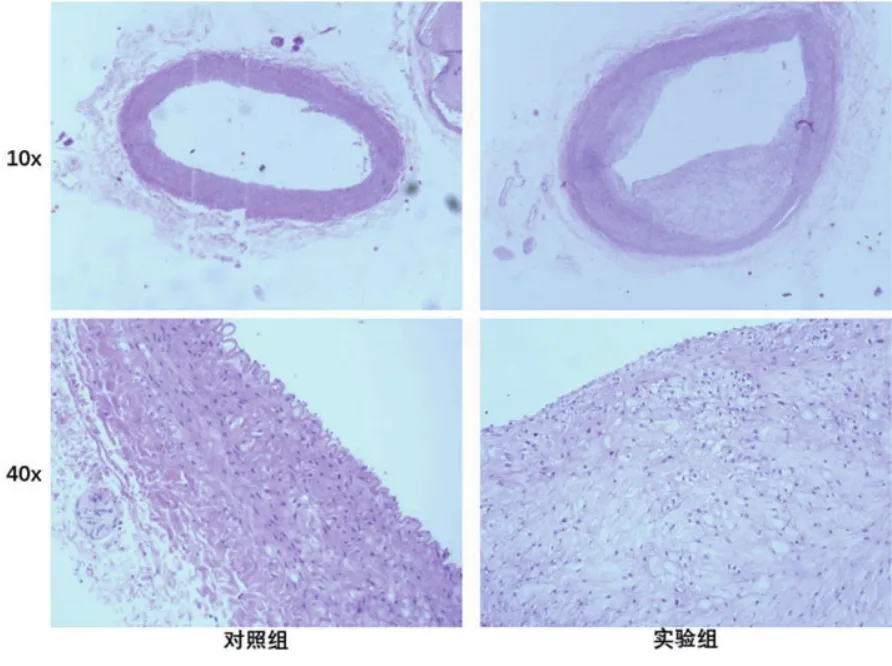
图1 两组大鼠胸主动脉HE染色
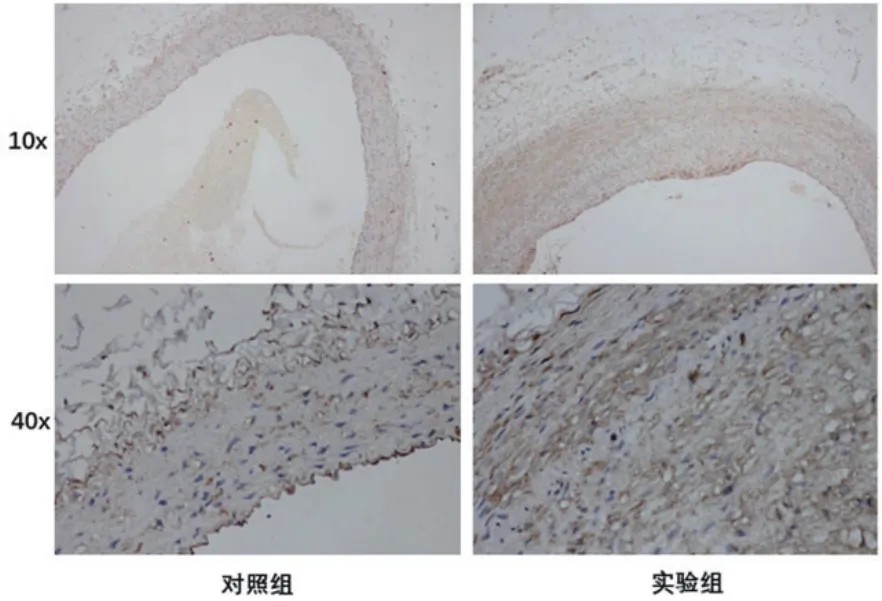
图2 两组大鼠胸主动脉免疫组化的比较
2.7 两组大鼠胸主动脉Legumain mRNA水平RTPCR产物电泳条带符合引物设计扩增片段长度要求。实验组Legumain mRNA水平表达明显高于对照组,差异有统计学意义(P<0.05)(图4)。

图3 两组大鼠胸主动脉Legunmain蛋白表达
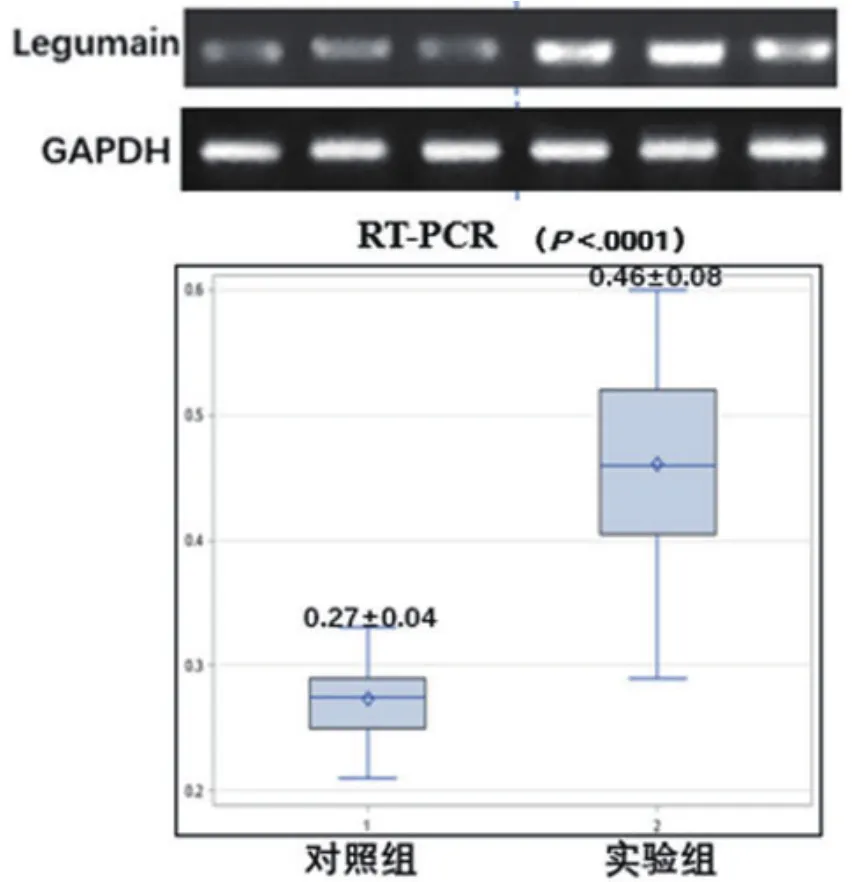
图4 两组大鼠胸主动脉Legumain mRNA水平的比较
3 讨论
Legumain是具有高度特异性的天冬酰胺内肽酶,最初是在豆类植物种子中发现的。在正常情况,Legumain在哺乳类动物不表达或低水平表达,在酸性条件(PH 3~6)下被活化[11,12]。Legumain参与哺乳动物的免疫、溶骨、肿瘤等多个病理生理病理过程[6]。研究发现,Legumain可活化组织蛋白酶-L,而组织蛋白酶-L的表达与动脉粥样硬化(AS)的发生、发展有密切关系[4,13]。
本研究中,造模12周后实验组大鼠动脉粥样硬化指数明显升高,胸主动脉HE染色显示有明显的动脉粥样硬化斑块形成,证实造模成功。造模成功后,实验组血清Legumain较基线水平及对照组均明显升高,提示Legumain可能参与了动脉粥样硬化过程中。随后进行免疫组化,结果显示Legumain在大鼠胸主动脉粥样斑块内高表达,而在对照组大鼠主动脉血管壁Legumain仅少量表达;我们观察到,在实验组胸主动脉动脉粥样硬化斑块中Legumain以单核-巨噬细胞胞核、胞浆和间质内表达为主,而在对照组中其仅在成纤维细胞和血管内皮细胞中有少量表达。有研究表明,legumain的高分泌表达可能通过单核-巨噬细胞与炎症和动脉粥样硬化存在相关性[7,14],我们的结果支持这一结论,但尚有待进一步研究证实。
通过Western Blot法进一步量化胸主动脉Legumain的蛋白表达。结果表明,实验组大鼠胸主动脉斑块中Legumain的蛋白含量较对照组升高约2.5倍。Lunde等[15]发现随动脉粥样硬化的进展Legumain的mRNA表达也相应增加,这与我们的实验结果相一致,应用RT-PCR法检测实验组Legumain的mRNA水平明显高于对照组,其差异有统计学意义,进一步提示Legumain与动脉粥样硬化密切相关。
综上,Legumain可能诱导单核巨噬细胞成熟和迁移,从而与炎症和动脉粥样硬化存在相关性,其功能异常可能与TLR4、MAPK、Smad3、Akt等信号传导系统有关[16,17]。Legumain具体通过哪些信号通路影响动脉粥样硬化,另有研究表明,他汀类药物可能对ACS患者血清中Legumain有影响[18],能否用相关药物干预此途径,以上问题尚待进一步研究明确。
