泛素特异性蛋白酶39在非小细胞肺癌中的表达及其对细胞增殖的影响
2018-11-07吉晓剑杨秀林周厚荣王文琴许新梅
吉晓剑,杨秀林,周厚荣,王文琴,许新梅
(贵州省人民医院 急诊内科,贵州 贵阳 550002)
肺癌在全球范围的发病率高居所有肿瘤的第3位[1],而其中75%~80%属非小细胞肺癌,患者就诊时已处于晚期[2]。近年来,一系列靶向药物和免疫药物已在临床上逐步应用,显示出良好的治疗效果,但非小细胞肺癌的预后仍处于较低水平,5年总体生存率仅11%[3]。因此,寻找与非小细胞肺癌进展的相关分子及潜在机制具有重要意义。
泛素特异性蛋白酶39(ubiqutin-specific protease,USP39)属于泛素特异性蛋白酶家族成员[4],其结构由一个锌指泛素结合域和一个泛素化C端水解酶域组成[5]。研究表明,USP39在mRNA前体剪接中发挥着至关重要的作用。细胞中USP39的缺失将导致有丝分裂纺锤体检查点完整性的缺陷,因此USP在细胞周期和增殖过程的调控中发挥至关重要的作用[6]。多项研究结果显示,沉默肿瘤细胞中USP39的表达可在体内和体外水平抑制肿瘤细胞的增殖[7-8]。然而USP39在非小细胞肺癌组织和细胞中的表达及功能,尚无研究报道。本研究拟通过免疫组织化学(简称免疫组化)及实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction, qRT-PCR)技术检测非小细胞肺癌、癌旁组织及细胞系中USP39的表达情况,并分析其临床相关性及其对细胞增殖的影响。
1 资料与方法
1.1 研究对象
选取2014年6月-2016年12月于贵州省人民医院接受全胸腔镜非小细胞肺癌根治术的患者肿瘤组织及癌旁组织,期间共收集患者肿瘤组织及癌旁组织85例。本研究入组患者详细临床病理资料见表1。所有入选本研究的非小细胞肺癌患者术前未进行包括放疗、化疗及靶向治疗,术中所取肿瘤组织及相应的癌旁组织,经石蜡包埋长期储存。本研究经贵州省人民医院伦理委员会审核并批准,所有入组患者均亲自签署知情同意书,授权课题组使用其组织标本进行本项科学研究。
1.2 试剂与仪器
免疫组化试剂盒购于福州迈新科技发展有限公司,LipoTM2000转染试剂购于美国Invitrogen公司,USP39 NC及siRNA由美国Sigma公司合成,CCK-8试剂购于日本同仁公司,SYBR premix Ex TaqⅡ和5x Prime Script RT master购于日本TaKaRa公司,细胞凋亡检测Annexin-V和PI试剂盒购于美国BD公司。4℃低温离心机购于德国Eppendorf公司,BD FACS Calibur流式细胞仪购于美国BD公司。
1.3 免疫组化检测USP39蛋白在肺非小细胞肺癌及矮胖组织中表达
二甲苯脱蜡2次,100%~70%梯度酒精脱腊。柠檬酸盐缓冲液高压修复90 s。30 ml/L过氧化氢孵育20 min,磷酸盐缓冲液清洗5 min×5次。兔抗人USP39单克隆抗体(ab131244,英国Abcam公司)(1∶100)4℃孵育过夜,磷酸盐缓冲液清洗5 min×5次。加入聚合物增强剂(美国Sigma公司),37℃孵育20 min,磷酸盐缓冲液清洗5 min×5次。加入酶标抗兔聚合物放大剂(美国Sigma公司),37℃孵育15 min,磷酸盐缓冲液清洗5 min×5次。二氨基联苯胺(3,3’-diaminobenzidine, DAB)(美国 Sigma公司)显色,苏木素(美国Sigma公司)复染,1 ml/L盐酸酒精分化,磷酸盐缓冲液返蓝,脱水,透明,封片。染色结果判定流程为:已染色的石蜡组织片子随机选取10个视野,每个视野计数100个细胞,。将呈现棕色或黄色的细胞定义为阳性细胞,统计阳性细胞的百分率,染色结果根据阳性细胞百分率及着色程度综合判断。将阳性细胞百分率>25%、及不着色或较淡着色者判定为USP39阴性,将阳性细胞百分率<35%、及染色呈现适中着色或深着色者为阳性。免疫组化染色结果由两位病理科医师以双盲的方式完成,两者不一致的结果请上级病理医师与两人经多镜头显微镜下讨论得出一致结果。
1.4 RNA提取及反转录
RNA提取采用Trizol法,Trizol购自美国Sigma公司,非小细胞肺癌细胞经胰酶消化5 min,加含血清的培养基终止反应,离心后弃去废液,加入1 ml Trizol室温裂解5 min。12 000 r/min 4℃离心5 min,上清转移至一新离心管中。加入裂解液1/5体积的氯仿,用力振荡至充分乳化。12 000 r/min 4℃离心15 min(德国Eppendorf公司)。吸取上清液至一新的离心管中,加入等体积异丙醇,上下颠倒15次,静置10 min。12 000 r/min 4℃离心15 min。弃去上清,加入75%的乙醇1 ml,12 000 r/min 4℃离心5 min。所得沉淀加入20 μl去离子水,即为所需RNA。逆转录采用10 μl体系,RNA定量后,取1 μl RNA,加入5× Prime Script RT master(日本 TaKaRa 公司)2 μl,7 μl去离子水。轻柔混匀后,进行逆转录反应。反应条件为:37℃ 15 min使RNA逆转录为cDNA,85℃延伸5 s,置入4℃储存。
1.5 实时荧光定量聚合酶链反应检测USP39 mRNA的表达水平
采用日本TaKaRa公司SYBR premix Ex TaqⅡ试 剂 盒 进 行 qRT-PCR。PCR反 应 采 用 25 μl体系,配置PCR反应液,组分如下:SYBR premix Ex TaqⅡ 12.5 μl,USP39或 β-actin正 向 引 物1 μl,USP39或 β-actin反向引物 1 μl,实时荧光 定 量 产 物 2 μl, 去 离 子 水 8.5 μl。PCR 反 应条件为:95℃预变性 30 s;95℃扩增 15 s,60℃延伸30 s,共40个循环。反应结束后样品保存于4℃。USP39引物序列如下:正向5'-GGCA GTAAAACTTGAGGGTGT-3',反向5'-TTGAAGTCTCA CGCCTACATTC-3';β-actin引物序列如下:正向5'-C GTCTTCCCCTCCATCGT-3',反向 5'-GAAGGTGTGGTG CCAGATTT-3'。 计 算 公 式 为:USP39相 对表达量:
1.6 细胞转染USP39 siRNA 及NC
USP39正常对照(normal control, NC)及小干扰RNA(small interfering RNA, siRNA)由美国Sigma公司合成,按说明书剂量使用DEPC水溶解USP39 NC及siRNA后,各取5 μl加入250 μl无血清培养基中,另取5 μl LipoTM2000转染试剂(美国Invitrogen公司)加入250 μl无血清培养基中,将两溶液混匀,室温反应20 min。逐滴加入6孔板中,分别命名为USP39 NC组和USP39 siRNA组。
1.7 细胞增殖与凋亡检测
96孔板配置100 μl转染USP39 NC或siRNA细胞悬液,37℃ 5%二氧化碳CO2条件下培养24 h,向培养板中加入10 μl CCK-8溶液(日本同仁公司),在培养箱中孵育1.5 h,在450 nm波长下测定吸光度值(optical delnsity, OD)。
将转染USP39 NC及USP39 siRNA的细胞消化后离心5 min,加入流式洗液5 ml清洗2次,1 000 r/min离心5 min,弃去废液,加入PI及FITC-Annexin V(美国BD公司),室温孵育20 min,上机检测。凋亡检测所用流式细胞仪型号为美国BD公司FACS Caliur,所得数据采用随机自带软件分析。
1.8 细胞周期检测
将转染USP39 NC及USP39 siRNA的细胞消化后离心5 min,加入流式洗液5 ml清洗2次,1000 r/min离心5 min,弃去废液,加入PI(美国BD公司)室温孵育20 min,上机检测。凋亡检测所用流式细胞仪为BD FACS Caliur(美国BD公司),所得数据采用美国Verity Software House公司Mod Fit LT软件分析。
1.9 统计学方法
数据分析采用SPSS 22.0统计软件,计量资料以均数±标准差(±s)表示。组间阳性例数差异分析采用χ2检验。相关性分析应用Spearman秩相关。计量资料3组间的比较,首先采用方差分析,用LSD-t检验进行两两比较。计量资料两组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 USP39蛋白在非小细胞肺癌及癌旁组织中的表达情况
免疫组织化学结果显示,非小细胞肺癌中USP39表达于肿瘤细胞包膜及包浆,非小细胞肺癌中USP39阳性例数为53例(62.353%),非小细胞肺癌组织中典型USP39蛋白阳性及阴性表达见图1A、B。癌旁组织中未检测到USP39的阳性表达(0.000%),癌旁组织中USP39蛋白典型阴性表达见图1C。两组间USP39阳性率差异有统计学意义(P<0.05),USP39蛋白在非小细胞肺癌组织中的表达较癌旁组织上调。见表1。
2.2 USP39的表达与非小细胞肺癌患者临床病理特征的关系
USP39的表达水平与非小细胞肺癌患者TNM分期呈正相关,而与其他病理特征无相关性。见表1。
2.3 USP39在非小细胞肺癌细胞中的表达
qRT-PCR结果显示USP39在正常支气管上皮BEAS-2B细胞中的相对表达水平为(1.000±0.156),非小细胞肺癌细胞系A549及H460分别为(3.513±0.374)和(4.174±0.516),3组间比较差异有统计学意义(F=19.412,P=0.014);A549和H460中的USP39相对表达水平高于正常支气管上皮BEAS-2B细胞(均P<0.05)。转染USP39 NC的A549中USP39的表达水平为(1.000±0.087),转染USP39 siRNA的A549中USP39的表达水平为(0.315±0.043),经t检验,差异有统计学意义(t=3.781,P=0.034)。转染USP39 NC的H460中USP39的表达水平为(1.000±0.104),转染USP39 siRNA的H460中USP39的表达水平为(0.273±0.032),经t检验,差异有统计学意义(t=3.975,P=0.031),USP39 siRNA组非小细胞肺癌中USP39表达水平较转染USP39 NC组降低。
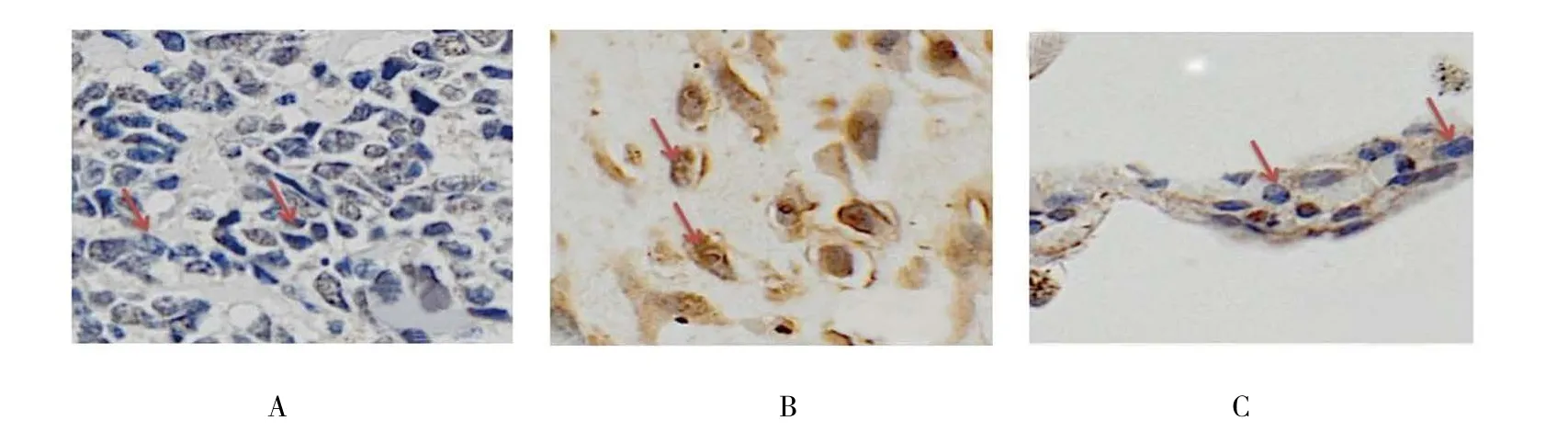
图1 USP39蛋白在非小细胞肺癌组织及癌旁组织中的表达 (×400)

表1 非小细胞肺癌患者不同临床病理特征癌组织USP39阳性表达率的比较
2.4 USP39对非小细胞肺癌细胞增殖的影响
USP39 NC组与 USP39 siRNA转染后24、48、72、96及120 h的OD值比较,采用重复测量设计的方差分析,结果:①不同时间点的OD值有差异(A549:F=37.142,P=0.016;H460:F=41.421,P=0.011);②USP NC组与USP39 siRNA组在转染后120 h时间点的OD值有差异(A549:F=21.513,P=0.031;H460:F=19.451,P=0.042)。在120 h时,USP39 siRNA组时OD值低于USP39 NC组。③USP39 NC组与USP39 siRNA组的OD值变化趋势有差异(A549:F=23.514和21.151,P=0.031和0.038)。见表2和图3。

表2 转染USP39 siRNA与NC的非小细胞肺癌增殖情况
2.5 USP39对非小细胞肺癌细胞凋亡的影响
转染USP39 siRNA组非小细胞肺癌细胞凋亡细胞百分比为(24.872±3.522)和(16.324±0.423),转染USP39 NC组非小细胞肺癌凋亡细胞百分比为(2.319±0.325)和(1.423±0.321),经t检验,差异有统计学意义(A549:t=5.982,P=0.014,H460:t=3.291,P=0.034),USP39 siRNA组凋亡细胞百分比高于USP39 NC组。见图2。
2.6 USP39对非小细胞肺癌细胞周期的影响

图2 USP39的表达对非小细胞肺癌细胞凋亡的影响
转染USP39 siRNA组非小细胞肺癌细胞G1期细胞百分比为(50.321±3.241)和(56.253±1.458),S期细胞百分比为(34.151±3.815)和(27.891±3.871);转染USP39 NC组非小细胞肺癌G1期细胞百分比为(68.182±2.357)和(72.831±1.551),S期细胞百分比为(14.721±4.124) 和(16.913±1.118)。 经t检 验,差异有统计学意义(A549:t=4.323,P=0.023,H460:t=4.851,P=0.027),USP39 siRNA 组 G1期细胞百分比高于USP39 NC组,而S细胞百分比低于USP39 NC组。见图3。
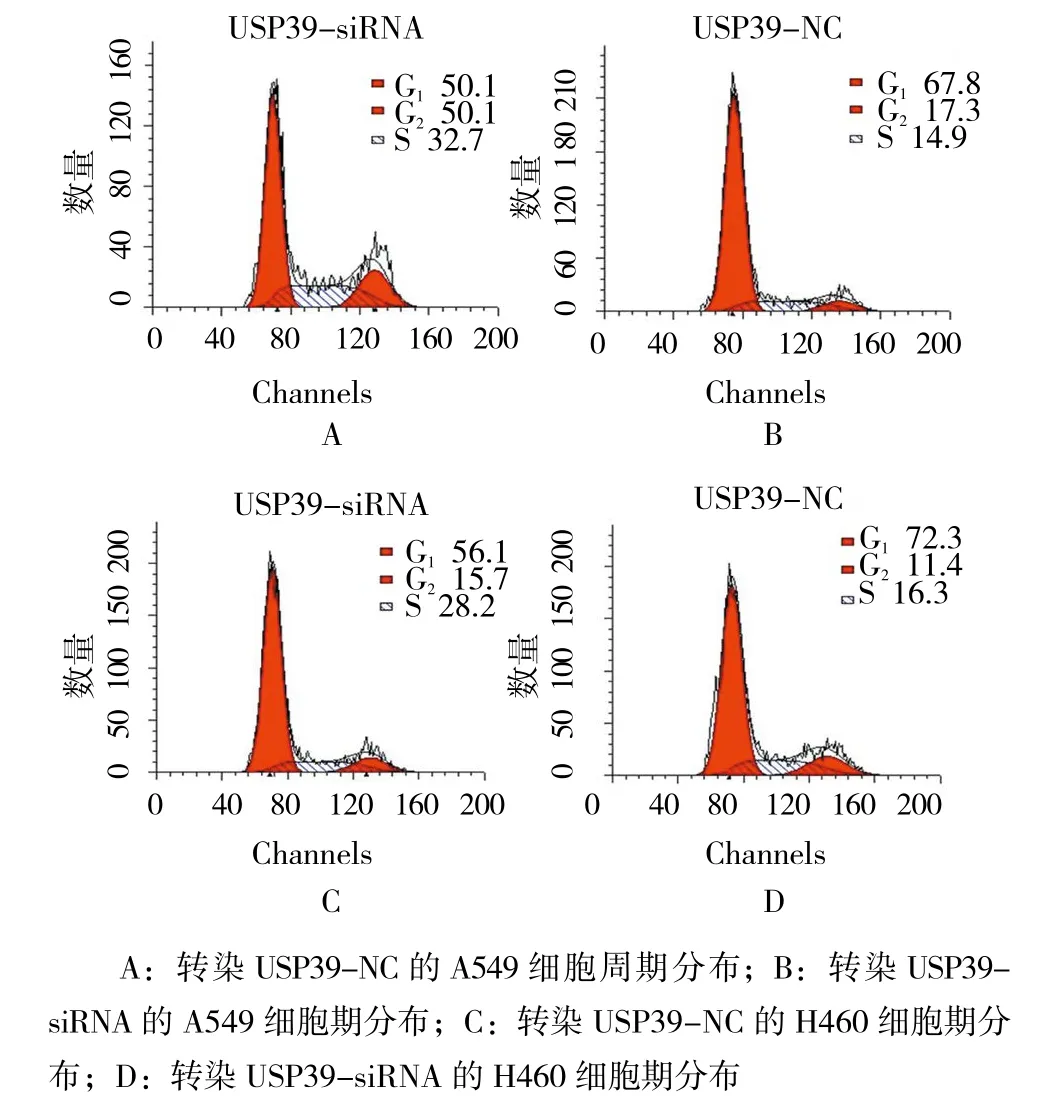
图3 USP39的表达对非小细胞肺癌细胞周期的影响
3 讨论
本研究结果显示,USP39蛋白在非小细胞肺癌组织中表达升高,其表达水平与非小细胞肺癌患者TNM分期密切相关。而USP39在非小细胞肺癌细胞中的表达水平高于正常支气管上皮细胞,沉默非小细胞肺癌细胞中USP39的表达后,非小细胞肺癌细胞增殖受到抑制,细胞凋亡比例提高,细胞周期被阻滞于G1期。
去泛素化蛋白酶(DUBs)可介导生物体内的泛素的去除和加工,在蛋白转录后的调控中起着至关重要的作用。目前已鉴定出近100种去泛素化酶,分为5个家族,泛素化C端水解酶家族,泛素特异性蛋白酶家族,卵巢肿瘤蛋白酶家族,JAMM motif蛋白酶家族,和MJD病蛋白酶家族[4]。USP39是泛素特异性蛋白酶家族成员,但USP39因缺乏3个重要活化位点的残基而无泛素化蛋白酶活性。但USP39对于U4/U6-U5三聚体snRNA的招募至关重要,而对于三聚体snRNA稳定性的维持却无作用[5]。细胞中USP39的缺失将导致有丝分裂纺锤体检查点完整性的缺陷,其可能的机制为USP39调控Aurora B和其他mRNA的表达水平[6]。近年来一系列研究显示,USP39在肿瘤的发生、发展中亦发挥着重要的作用。在结肠癌[9]、骨肉瘤[10]中,研究发现USP39在肿瘤组织中的表达高于配对癌旁组织。生物信息学数据库挖掘研究显示,USP39在肺癌组织中的表达上调[11]。值得注意的是,该研究仅基于生物信息学数据库的挖掘证实USP39在肺癌组织中表达上调,并进一步深入研究在肺癌各分型中USP39的表达情况,及USP39与肺癌临床病理特征的关系。与该研究结果相符,本研究结果显示USP39在非小细胞肺癌肿瘤组织及细胞中的表达水平高于癌旁组织和正常支气管上皮细胞。更为重要的是,笔者的研究结果显示USP39与非小细胞肺癌的TNM分期密切相关。以上研究结果提示,USP39可能参与调控非小细胞肺癌的发生及进展,是潜在致癌分子。
在斑马鱼中,USP39的变异可阻滞细胞周期与G1期,并可下调rb1的表达水平[12]。近年来,一系列研究表明USP39在肿瘤中可作用致癌性分子发挥作用,USP39在乳腺癌[13-14]、肝细胞癌[8,15]和甲状腺髓样癌[7]中的表达水平上调。沉默USP39的表达水平可阻滞细胞周期并促进细胞凋亡,其可能的机制为USP39上调p-Cdc2并下调p-Cdc25c和p-myt1的表达[8]。沉默口腔鳞状细胞癌中USP39的表达后,细胞增殖收到抑制,细胞周期被阻滞于S期和G1/M期,此外,沉默USP39还可通过活化Caspase-3和PARP而促进口腔鳞状上皮细胞凋亡[16]。更为重要的是,研究发现沉默人巨细胞肺癌细胞系95D中USP39的表达后,细胞的克隆形成能力降低,凋亡细胞比例增高[11]。与既往研究结果相符,本研究结果显示,沉默非小细胞肺癌中USP39的表达后,肿瘤细胞的增殖受到抑制,而细胞凋亡比例则提升,细胞周期被阻滞于G1期。结合既往研究和本研究结果可更充分的证明USP39在肿瘤进展中的致癌作用,其是极具潜力的肿瘤治疗分子靶点。
综上所述,USP39在非小细胞肺癌组织和细胞中的表达水平高于癌旁组织或正常支气管上皮细胞,USP39与非小细胞肺癌患者TNM分期密切相关,沉默非小细胞肺癌细胞中USP39的表达后,非小细胞肺癌细胞增殖受到抑制,细胞凋亡比例提高,细胞周期被阻滞于G1期。提示USP39可促进非小细胞肺癌细胞增殖,可做为非小细胞肺癌生物治疗研究的潜在分子靶点。
