藏猪IFN-λ3成熟肽基因克隆及原核表达、抗病毒效价测定
2018-11-06李原野陈瑛琪张继宗杨晓宇王佳煜徐志文
李原野, 殷 玥, 陈瑛琪, 张继宗,杨晓宇,王佳煜,朱 玲,2, 徐志文,2*
(1.四川农业大学动物医学院,成都 611130,2.四川农业大学动物疫病与人类健康四川省重点实验室,成都 611130)
Ⅲ型与Ⅰ型干扰素生物学功能相似,但Ⅲ型干扰素受体广泛分布于上皮组织和器官,具有更强的特异性,在造血和神经系统分布较少,临床应用副作用较小。Ⅲ型干扰素抗病毒活性研究发现,IFN-λ3抗病毒活性显著高于IFN-λ1和 IFN-λ2。根据干扰素抗猪水泡性口炎病毒(Vesicular stomatitis virus,VSV)活性测定干扰素效价[1],VSV系统对各种干扰素敏感度较高,活性测定效果较好[2]。IFN-λ属于Ⅱ类细胞因子,其与Ⅰ型干扰素具有相似抗病毒、抗肿瘤及免疫调节功能,其特异性受体IFN-λR1主要在上皮细胞组织表达,在黏膜表面表现特异性的抗病毒功能[3-4]。猪IFN-λ包括IFN-λ1和IFN-λ3,后者抗病毒活性更强[5]。Wang等在猪外周血淋巴细胞中克隆得到IFN-λ1基因[6],Shen等利用 Poly I:C诱导ST细胞克隆 IFN-λ3基因[7]。目前,关于猪IFN-λ其他成员尚未见报道。Ⅰ型干扰素已用于治疗多种临床疾病,如慢性髓性白血病、黑色素瘤、丙型肝炎等[8-9]。
本文首次以提取藏猪肺脏和肠道总RNA为模板,通过RT-PCR方法成功获取藏猪IFN-λ3基因序列。以pMD19-T-ZPoIFN-λ3质粒为模板,克隆ZPoIFN-λ3成熟肽基因(pMD19-T-mZPoIFN-λ3),构建原核表达载体pET-32a(+)-mZPoIFN-λ3,于大肠杆菌BL21(DE3)中表达,纯化重组质粒,并通过MDBK/VSV系统测定其抗病毒效价,为进一步研究藏猪IFN-λ3生物学特性和相关基因重组药物奠定基础。
1 材料与方法
1.1 肺脏、质粒与菌株
藏猪肺脏和肠采自四川省甘孜自治州规模化猪场,E.coli DH5α、E.coli BL21(DE3)、质粒pMD19-T、表达质粒pET-32a(+)均由四川农业大学动物生物技术中心保存。
1.2 酶和试剂
PrimeSTAR Max DNA Polymerase、DNA Marker DL2000、GoldViewTM染色剂、TaKaRa RNAisoTM Plus、PrimeScriptTM RT reagent Kit、DNA Ligation Kit Ver.2.1、TaKaRa MiniBEST Agarose Gel DNA Extraction Kit、TaKaRa MiniBEST Plasmid Purification Kit Ver.4.0购自宝日医生物技术(北京)有限公司,蛋白Marker、限制性内切酶QuickCut™Bam HⅠ、Quick Cut™HindⅢ、完全弗氏佐剂、不完全弗氏佐剂购自生工生物工程(上海)股份有限公司;辣根HRP标记羊抗鼠IgG(H+L)高交叉吸附二级抗体购自赛默飞世尔(中国)公司。
1.3 PCR引物
根据GenBank公布的猪IFN-λ3序列(NM_001166490),利用Primer 5.0设计扩增藏猪IFN-λ3全长序列引物。引物序列如下:P1:5'ATGGCCCT GGGTGGCT 3', P2:5'TCAGACACACAGGTCTCC AC 3'。P1和P2由生工生物工程(上海)股份有限公司合成。根据克隆到的藏猪IFN-λ3基因序列,设计扩增藏猪IFN-λ3成熟肽基因引物。分别在上游引物(P3)和下游引物(P4)5'端加Bam HⅠ和HindⅢ酶切位点。P3:5'CGCGGATCCGTGCCTGTCCCT GAAGCCC 3',(划线部分为Bam HⅠ酶切位点)P4:5'CCCAAGCTTTCAGACACACAGGTCTCCAC 3'(划线部分为HindⅢ酶切位点)P3和P4由生工生物工程(上海)股份有限公司合成。
1.4 藏猪肺和肠总RNA提取及cDNA合成
取新鲜藏猪肺脏和肠道组织,液氮反复研磨,取100 mg组织置于EP管中,参照试剂盒说明书提取肺和肠组织总RNA、纯化肺和肠组织的RNA,1%琼脂糖电泳(AGE)检查。以总RNA提取液3 μL为模板,反转录合成cDNA(反应条件:37℃,15 min;85℃,5 s)。
1.5 pMD19-T-ZPoIFN-λ3质粒构建与鉴定
以cDNA为模板,扩增IFN-λ3全基因(反应体系:cDNA 2 μL,10 pmol·μL-1P1、P2 各 1 μL,PrimeSTAR Max Premix 12.5 μL,ddH2O 8.5 μL;反应条件:95℃,5 min;95℃,30 s;54℃ ,30 s;72℃,40 s;35个循环;72℃,10 min),预期产物约600 bp。PCR产物回收纯化后与pMD19-T载体连接,再转化入E.coli DH5α,阳性单菌落经PCR测序鉴定,克隆命名为pMD19-T-ZPoIFN-λ3。
1.6 IFN-λ3成熟肽基因扩增及重组表达载体构建
以pMD19-T-ZPoIFN-λ3为模板,作藏猪IFN-λ3成熟肽基因扩增(反应体系:2 μL pMD19-TZPoIFN-λ3,上下游引物(10 pmol· μL-1)P3、P4各 1 μL, 12.5 μL PrimeSTAR Max Premix, 6 μL ddH2O,反应条件95℃,7 min;95℃,30 s;65℃,30 s;72℃,40 s;共30个循环;72℃,10 min;4℃,保存),扩增产物经1%AGE鉴定后回收纯化。将IFN-λ3成熟肽PCR产物和载体PET-32α(+)用限制性内切酶Bam HⅠ和HindⅢ在37℃条件下酶切30 min(双酶切体系为IFN-λ3/PET-32α 1 μg,10×酶切Buffer 2 μL,Bam HⅠ 1 μL,Hind Ⅲ 1 μL),将IFN-λ3酶切片段与PET-32α(+)酶切产物于16℃连接过夜,连接产物转化入E.coli.BL21(DE3)感受态细胞后,涂布于LB平板(含Amp 100 μg·mL-1),37 ℃恒温需氧培养12~24 h。挑取单个菌落接种于LB肉汤(含Amp),37℃180 r·min-1振荡培养 12~14 h,取菌液作 PCR 鉴定,取阳性转化子抽提质粒,Bam HⅠ和HindⅢ双酶切鉴定,将菌落PCR与双酶切鉴定正确的阳性克隆转化子送上海生工测序。
1.7 诱导剂IPTG浓度及诱导表达时间优化
将重组菌BL21-IFN-λ3接种于LB肉汤(含Amp)37 ℃ 220 r·min-1振荡培养12 h,按1∶100比例转种至LB肉汤(含Amp)中培养OD600=0.6时,加入IPTG使终浓度分别为0.2、0.4、0.6、0.8、1.0 mmol·L-1诱导5 h,收集菌体作全菌SDS-PAGE分析。当重组菌BL21-IFN-λ3培养至OD600=0.6时,加入IPTG溶液使终浓度达优化后水平,诱导至1、2、3、4、5 h时,分别取1 mL菌液作SDSPAGE检测分析。
1.8 表达产物定位分析及Western Blot鉴定
优化后结果作重组菌BL21-IFN-λ3培养及诱导表达,4℃12 000 r·min-1(Sigma 3k15 Inc)离心10 min,弃上清,用1/10体积PBS(pH 8.0)重悬沉淀,加入适量裂解液,冰浴下超声破碎至溶液清澈。4℃ 12 000 r·min-1离心15 min收集上清和沉淀,沉淀用PBS重悬。取少量上清液和沉淀重悬液,加入等体积5×Loading Buffer,SDS-PAGE分析。破碎后离心收集上清,加入等体积平衡缓冲液(10 mmol·L-1Tris-HCl,8 mol·L-1尿素,500 mmol·L-1NaCl,5 mmol·L-1咪唑,pH 8.0)混匀,0.45 nm滤膜过滤,滤液按照上海生工公司Ni-NTA SefinoseTM Resin Kit试剂盒使用说明操作。洗脱蛋白经10 ku超滤管浓缩。将诱导表达和未诱导产物与纯化融合蛋白作SDS-PAGE分析,转PVDF膜,后作Western Blot分析,一抗为鼠ZPoIFN-λ3多克隆抗体,二抗为HRP标记羊抗鼠IgG。
2 结果与分析
2.1 IFN-λ3全基因及成熟肽序列扩增
以抽提藏猪肺和肠组织RNA为模板,RT-PCR扩增IFN-λ3基因全长序列,扩增产物经1%AGE检测,约600 bp位置处出现与预期长度相符单一条带(见图1)。将目的片段扩增至克隆载体pMD19-T,转化大肠杆菌DH5α,对转化子作菌落PCR鉴定(见图2),阳性克隆送成都擎科梓熙生物技术公司测序,获得碱基序列为612 bp,将测序结果与NCBI网站Blast比对,使用MEGA 5.0等软件,将本研究序列与GenBank中已发表野猪(NM_0011664 90.1)、牛(NM_001281901.1)、树鼩(JX185489.1)、人(AY184374.1)、小鼠(NM_177396.1)、狮头鸡(NM_001128496.1)、人(AY184374.1)、西方爪蟾(NM_001171766.1)IFN-λ3的作同源性分析(见图3),构建进化树(见图4)结果显示,藏猪IFN-λ3与野猪、牛、树鼩、人、小鼠、狮头鸡和西方爪蟾核酸序列相似性分别为100%、84.9%、80.2%、78.9%、72.5%、51.8%、43.1%,表明克隆成功,以P3/P4为引物,pMD19-T-IFN-λ3为模板扩增IFN-λ3成熟肽序列,扩增得到1条约500 bp条带,与预期相符(见图5),未加模板阴性对照未见条带,说明成功扩增IFN-λ3成熟肽。
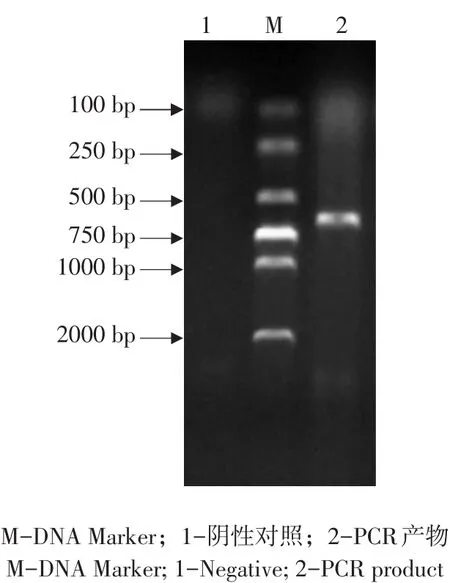
图1 藏猪IFN-λ3 PCR扩增Fig.1 PCR amplification of Tibetan pig IFN-λ3 gene
图2 pMD19-T-ZPoIFN-λ3 PCR鉴定Fig.2 PCR identification of the pMD19-T-ZPoIFN-λ3
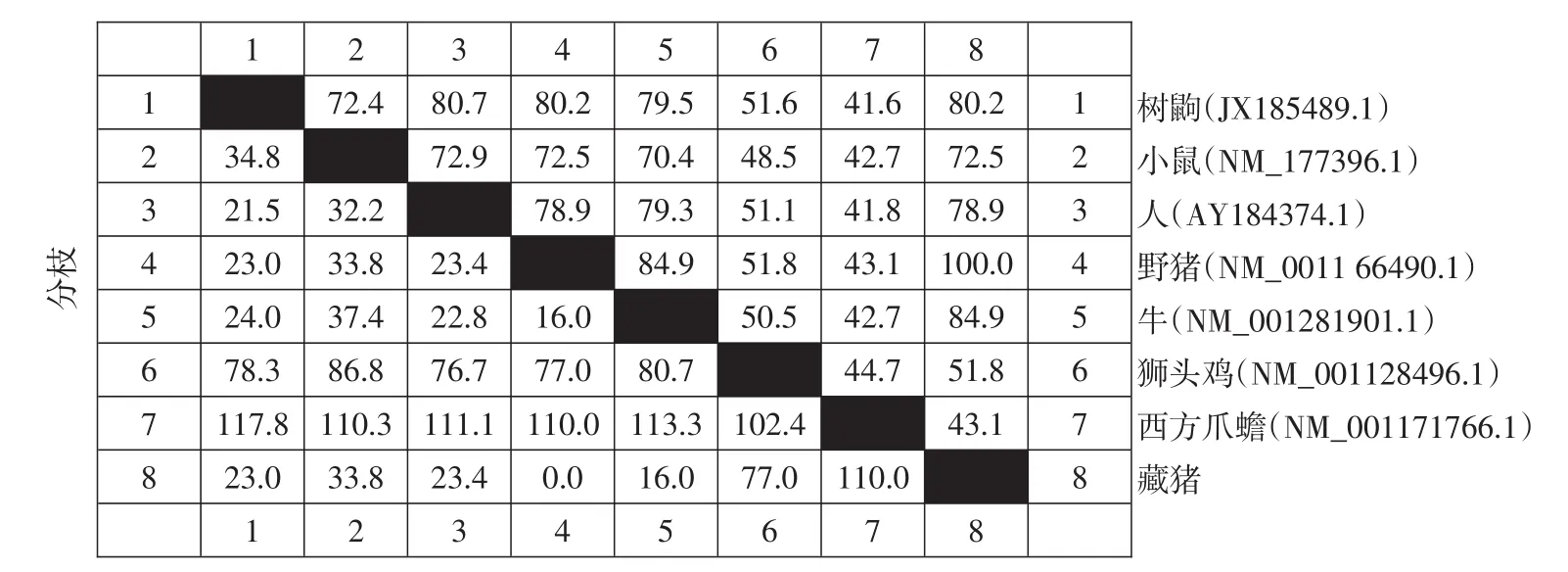
图3 目的基因同其他物种序列同源性比较Fig.3 Homologies of target genes with other species sequences
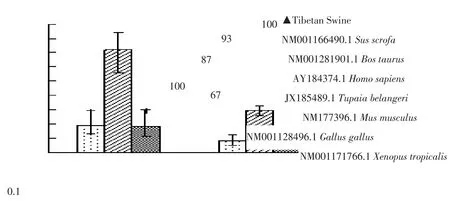
图4 ZPoIFN-λ3氨基酸序列系统发育树构建Fig.4 Phylogenetic ree based on amion acid sequence of ZPoIFN-λ3
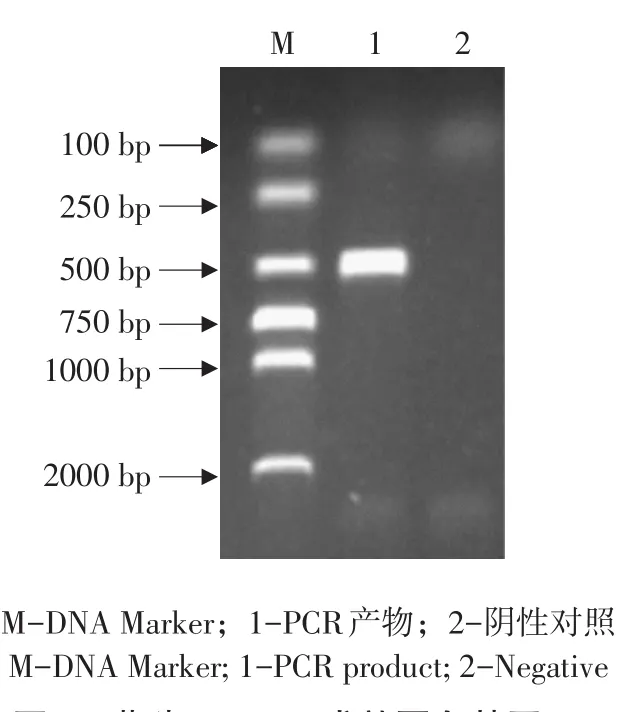
图5 藏猪IFN-λ3成熟蛋白基因PCR扩增Fig.5 PCR amplification of Tibetan pig IFN-λ3 mature peptide sequence
2.2 重组表达载体pET32α-IGF-1构建与鉴定
回收成熟肽基因片段与质粒pET-32α(+)分别双酶切后,连接酶连接,获取重组质粒,转化E.coli.BL21(DE3),阳性菌株作菌落PCR鉴定,另小量提取质粒后用Bam HⅠ、HindⅢ双酶切鉴定,均可得到约500 bp IFN-λ3序列片段,与预期产物一致(见图6、7),质粒送公司测序鉴定,正确转化子命名为BL21-IFN-λ3。
2.3 藏猪IFN-λ3融合蛋白IPTG浓度优化
pET-32a(+)-mZPoIFN-λ3转化BL21(DE3)菌株培养至对数生长期,使用终浓度为0.2、0.4、0.6、0.8或1.0 mmol·L-1的IPTG,摇床中37 ℃诱导5 h。SDS-PAGE结果发现,IPTG终浓度为0.4 mmol·L-1时目的蛋白表达量最大(见图8)。
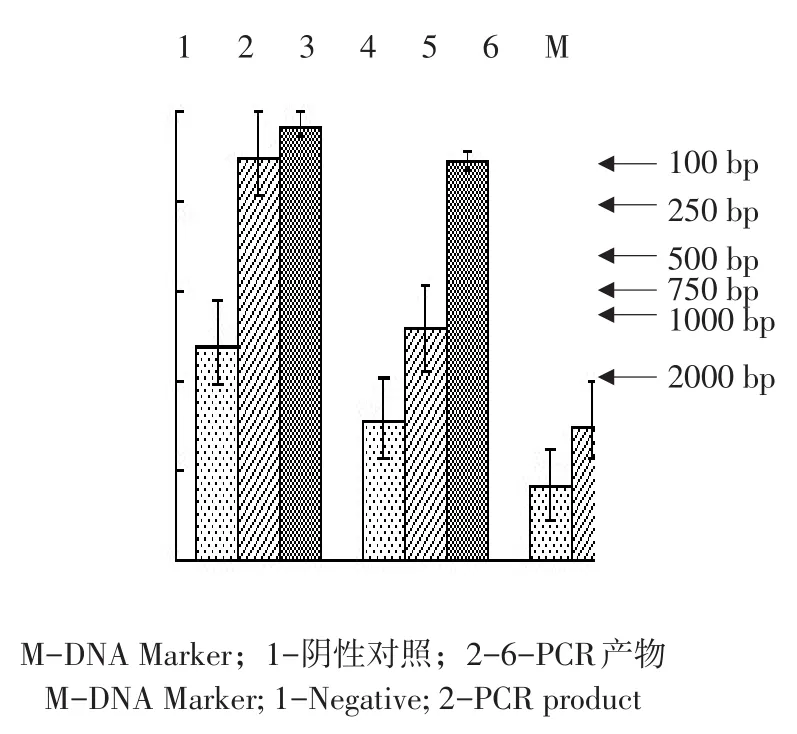
图6 pMD19-T-mZPoIFN-λ3 PCR鉴定Fig.6 PCR identification of the pMD19-T-mZPoIFN-λ3
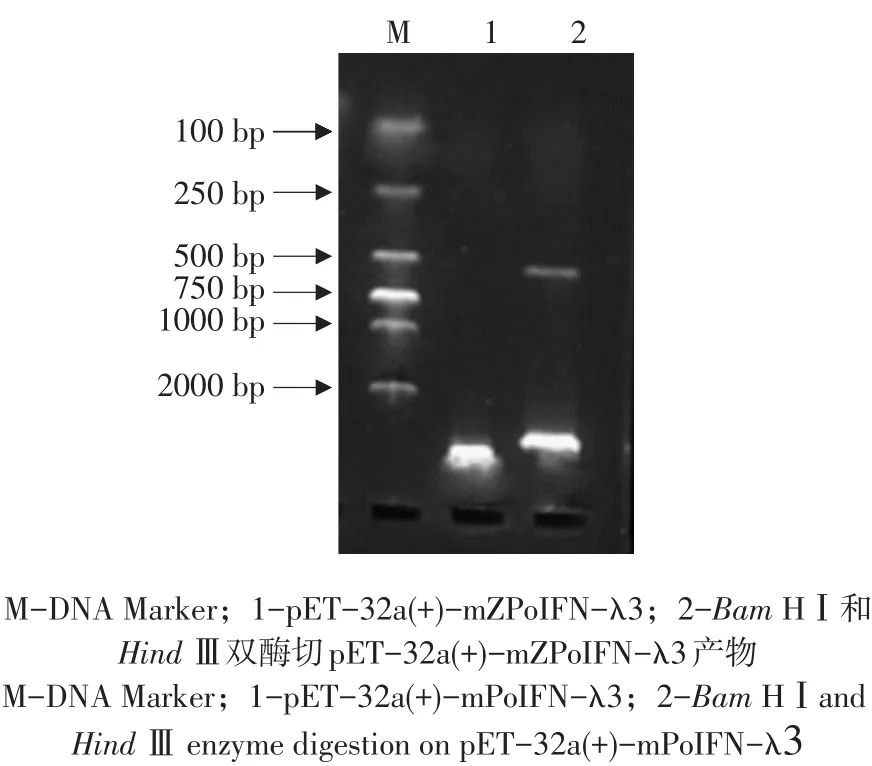
图7 重组质粒pET-32a(+)-mZPoIFN-λ3酶切鉴定Fig.7 Identification of recombinant plasmid pET-32a(+)-mZPoIFN-λ3 by restriction enayme digestion
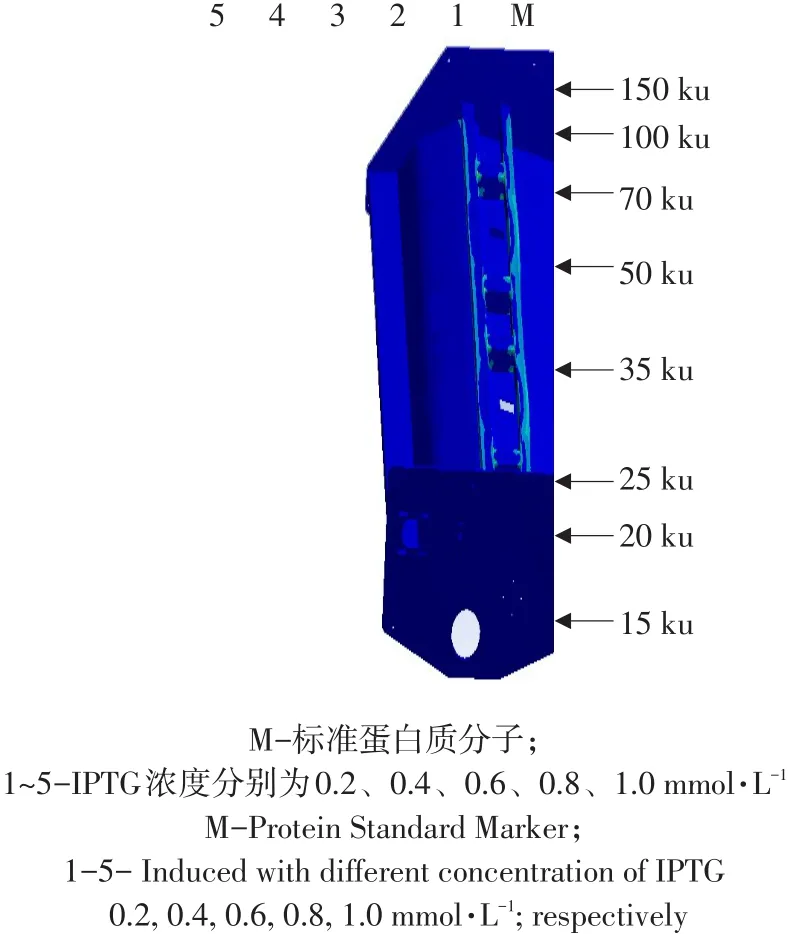
图8 IPTG浓度对重组蛋白表达影响Fig.8 Effect of recombinant protein expression with different concentration of IPTG
2.4 IFN-λ3融合蛋白诱导时间优化
pET-32a(+)-mZPoIFN-λ3转化 BL21(DE3)菌株培养至对数生长期,加入IPTG至终浓度为1 mmol·L-1,在空气摇床中37℃条件下诱导,诱导后1、2、3、4、5 h分别取样作SDS-PAGE分析,不同诱导时间均有目的蛋白表达且呈时间依赖,诱导5 h蛋白表达量最多(见图9)。选择5 h作为最佳诱导时间。
2.5 重组蛋白纯化和Western Blot鉴定
利用融合蛋白组氨酸标签,将洗涤后包涵体通过Ni-NTA亲和层析法去除杂蛋白,250 mmol·L-1咪唑洗脱液洗脱,洗脱液通过SDS-PAGE检测为单一条带(见图10)。洗脱蛋白通过透析法复性以及PEG-20000浓缩,使用考马斯亮蓝G250法测定蛋白浓度为1.13 mg·mL-1。纯化后融合蛋白制备鼠ZPoIFN-λ3多克隆抗体,将纯化pET-32a(+)-mZPoIFN-λ3表达藏猪IFN-λ3成熟蛋白经12%SDSPAGE电泳分离后,置于转膜槽中冰浴转膜,90 V电压转膜40 min,使用鼠高免血清作为一抗,作Western Bolting鉴定,发现在目的蛋白处出现条带(见图10),说明原核表达的藏猪IFN-λ3融合蛋白具有良好免疫原性。
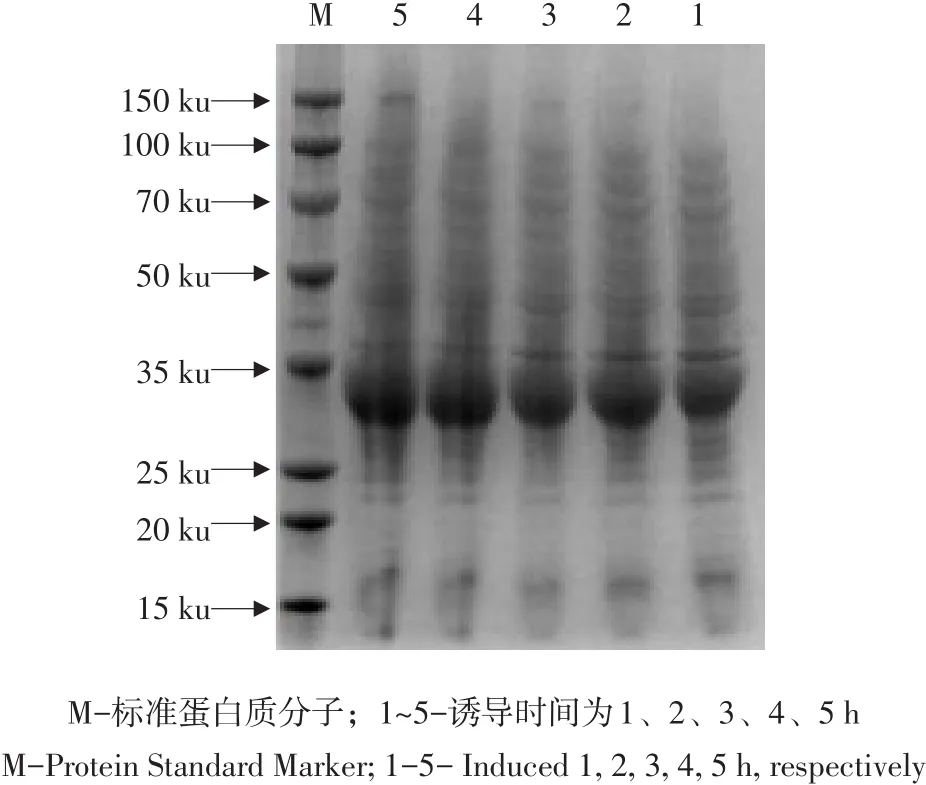
图9 诱导时间对重组蛋白表达影响Fig.9 Effect of recombinant protein expression with different culture times
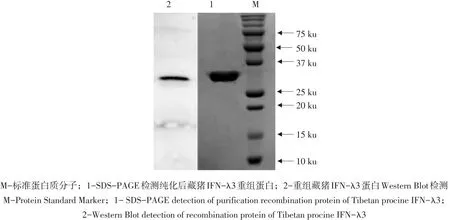
图10 检测复性浓缩后藏猪IFN-λ3重组蛋白Fig.10 Detection of renaturation recombination protein of Tibetan procine IFN-λ3
2.6 重组IFN-λ3蛋白抗病毒活性效价测定
pET-32a(+)-mZPoIFN-λ3表达藏猪IFN-λ3融合蛋白抗病毒效价采用细胞病变抑制法,使用VSV/MDBK系统测定(见图11)。
通过计算可得,距离比=(高于50%的百分比-50)/(高于50%的百分比-低于50%的百分比)=(75-50)/(75-25)=0.5,pET-32a(+)-mPoIFN-λ3表达蛋白在MDBK/VSV系统抗病毒效价为10×24.5U·0.1 mL-1,蛋白质浓度为1.13 mg·mL-1,比活力为2×103U·mg-1(见表1)。
图11 MDBK细胞CPE观察Fig.11 Observation of MDBK cell CPE
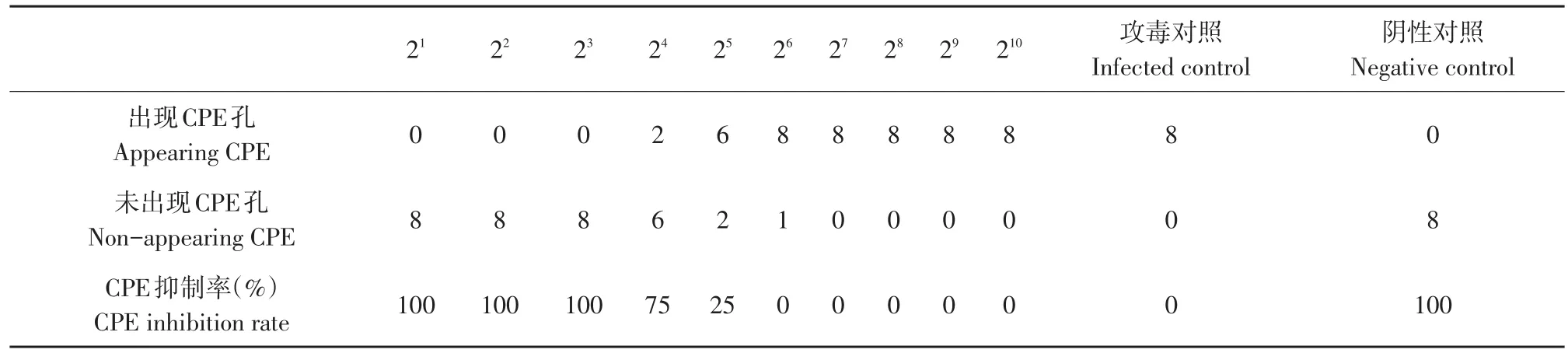
表1 ZPoIFN-λ3抗病毒活性效价测定Table 1 Determination of ZPoIFN-λ3 antiviral effect
3 讨论与结论
藏猪为世界少有高原型原始放牧猪种,是我国唯一生活在高原高寒地区的地方小型原始猪种,具有对恶劣环境适应力强、抗病力强及耐粗饲等特点。本试验选用藏猪为研究对象,克隆藏猪IFN-λ3基因并分析其生物信息学,以期探索藏猪抗病力分子机制及其开发利用价值。本试验扩增得到藏猪IFN-λ3基因,克隆测序鉴定后与Gen-Bank序列比对,其与野猪相似性最高为100%,与西方爪蟾相似性最低为43.1%。提示IFN-λ3基因在不同动物中具有同源性。
目前猪源Ⅰ和Ⅱ型IFN在动物疾病防治中的抗病毒机制研究较成熟,但IFN-λ相关研究较少,猪IFN-λ1对PRRSV、伪狂犬病病毒(PRV)、FMDV细胞增殖有抑制作用,且剂量依赖程度较高[10-11]。周恒等通过在细胞中加入不同浓度重组猪IFN-λ3,分析猪IFN-λ3原核表达及其活性,发现高浓度细胞孔出现细胞皱缩及死亡,低浓度细胞孔中未发现细胞死亡,为干扰素临床使用剂量研究提供理论依据[12]。
本研究成功构建原核表达载体pET-32a(+)-mZPoIFN-λ3,将其转化至表达菌株大肠杆菌BL21(DE3)[13-14],获得高效表达藏猪IFN-λ3融合蛋白菌株[15]。选用MDBK/VSV系统,通过细胞病变抑制法测定猪IFN-λ3重组蛋白活性,发现高浓度蛋白造成细胞死亡。原因是原核表达产物某些成分有一定毒性,需在纯化及透析过程中去除毒性成分,优化临床抗病毒活性使用剂量。研究可为研究猪Ⅲ型干扰素的生物学功能奠定理论基础,为临床新药物研发提供新方向。
