银杏叶提取液对腐生葡萄球菌的作用机理
2018-11-06蓝蔚青张皖君
王 倩 , 蓝蔚青 *, 侯 旻 , 张皖君 , 谢 晶
(1.上海海洋大学 食品学院,上海 201306;2.上海水产品加工及贮藏工程技术研究中心,上海201306)
银杏 (Ginkgo biloba)为银杏科银杏属裸子植物,俗称白果树、公孙树等,是中国最古老的树种之一,有“活化石”之称[1]。相关研究证明,银杏叶中含有200多种药用成分,其中包含46种黄酮类活性成分、25种微量元素、17种氨基酸和生物碱等,具有保护中枢神经系统、扩张血管、保护心脏、抗氧化、抗肿瘤等作用,保健价值高[2-4]。
近年来,研究人员对银杏叶提取工艺、提取物的化学成分、药理作用和药动学等方面研究取得了一定进展[5]。部分研究表明,银杏叶提取物中的银杏酚酸具有抑菌杀菌作用,对此,部分学者对其抑菌活性进行了研究。Sati等[6]研究了不同溶剂(甲醇、乙酸乙酯、正丁醇、水)提取的银杏叶提取物对革兰氏阳性菌、革兰氏阴性菌、放线菌及真菌的抑菌活性,结果表明银杏叶提取物对细菌作用最强,放线菌次之,且甲醇提取物的抑菌效果最好。曲莉等[7]通过测定抑菌圈直径和最低抑菌浓度研究了银杏叶提取物对金黄色葡萄球菌和大肠埃希菌的抑菌作用,最终得出银杏叶提取物对两者均有明显抑制作用。现有研究主要集中于金黄色葡萄球菌、大肠埃希菌等常见致病菌,但对水产品中腐败菌的抑制作用及作用机理方面的研究较少,抑菌机制也不明确。作者以水产品腐败菌——腐生葡萄球菌为研究对象,测定了银杏叶提取液对其的最小抑菌浓度与抑菌率的影响,并研究其对菌体细胞膜通透性、细胞壁完整性与菌体形态的影响,进一步分析银杏叶提取液的抑菌作用机理,为后期将其应用于水产品保鲜研究提供理论依据。
1 材料与方法
1.1 实验材料
银杏叶:摘自上海海洋大学校园主环路上。8月份选取新鲜、无病虫害、叶面扇形、边缘完整的银杏叶进行采摘。采摘后将其清洗、烘干、粉碎后保存备用。
供试菌株:腐生葡萄球菌(Staphylococcus saprophyticus)为作者所在课题组前期从腐败鲳鱼中分离、筛选并鉴定保存菌株。
主要试剂:胰蛋白胨大豆肉汤 (Tryptic Soy Broth,TSB)、胰蛋白胨大豆琼脂(Tryptic Soy Agar,TSA)培养基:国药集团化学试剂有限公司;碱性磷酸酶(Alkaline Phosphatase,AKP)测试盒:南京建成生物工程研究所;其他化学试剂氯化钠、无水乙醇、戊二醛等:均为分析纯。
1.2 主要仪器设备
Centrifuge 5810R冷冻离心机:德国Eppendorf公司;BCD-256KF冰箱:青岛海尔股份有限公司;ZQZY-70B振荡培养箱:上海知楚仪器有限公司;MLS-3750灭菌锅:日本SANYO公司;Synergy2自动酶标仪:美国BioTek公司;DDB-11A电导率仪:杭州齐威仪器有限公司;S3400N扫描电子显微镜:Hitachi日本株式会社;全M334712自动微生长曲线分析仪:芬兰Bioscreen公司等。
1.3 实验方法
银杏叶提取液制备称取10 g银杏叶粉末,加入500 mL 60%乙醇,混合后在60℃下超声波提取30 min,冷冻离心后进行抽滤,取上清液旋转蒸发除去乙醇和水,浓缩至最终体积为20 mL,过0.45 μm滤膜,得到质量浓度为500 mg/mL的银杏叶提取液。
菌悬液的制备挑取活化后的腐生葡萄球菌单菌落接种于TSB培养基中,37℃培养7 h,用灭菌生理盐水将其配制成含菌数106~107CFU/mL的菌悬液备用,现配现用。
1.3.3 最 小 抑 菌 浓 度 (MinimalInhibitory Concentration,MIC) 采用肉汤稀释法[8]和平板计数法[9]测定银杏叶提取液对腐生葡萄球菌的MIC值,以特定环境下孵育24 h,可抑制微生物出现明显增长的最低浓度即最小抑菌浓度。通过梯度稀释将银杏叶提取液用无菌TSB在试管中依次稀释,使各组终质量浓度分别为 300、250、200、150、100、50 mg/mL,对照组用无菌水代替银杏叶提取液。向各组接种菌悬液达最终浓度为106CFU/mL,取100 μL用无菌生理盐水进行10倍稀释,选取合适稀释液100 μL均匀涂布于TSA平板培养基上,37℃培养24 h后进行菌落计数。将试管置于37℃摇床中恒温培养24 h,再次进行稀释、涂布、培养与计数。通过比较银杏叶提取液处理前后菌数变化,得出最小抑菌浓度(MIC)。
抑菌率向无菌96孔板中分别加入MIC、2MIC质量浓度的银杏叶提取液,并接种一定量已制备的菌悬液,使孔中溶液含菌量为106CFU/mL。充分混匀后置于37℃微孔板振荡器中培养12 h,用酶标仪测其600 nm处的吸光度值,计算其抑菌率[10]:
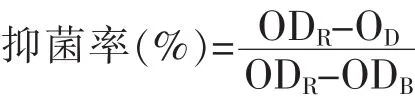
式中,ODR为对照孔吸光值;OD为样品孔吸光值;ODB为空白孔吸光值。
细菌生长曲线将已制备的供试菌菌悬液按1%接种体积分数分别加至MIC、2MIC质量浓度的银杏叶提取液中,以不加银杏叶提取液组为对照组。37℃、150 r/min摇床培养24 h,用全自动微生物生长曲线分析仪每隔30分钟自动取样,测其620 nm处的OD值。以时间(h)为横坐标,OD值为纵坐标,绘制银杏叶提取液对腐生葡萄球菌抑制作用的生长曲线。
细胞膜通透性通过培养液中电导率的变化,表征银杏叶提取液对腐生葡萄球菌菌体细胞膜通透性的影响。将已制备的供试菌菌悬液按1%接种体积分数分别加入到MIC、2MIC质量浓度的银杏叶提取液中,以不加银杏叶提取液组作为对照。37 ℃、150 r/min摇床培养 12 h,参考 Tao等[11]法,每隔2小时取样,测其电导率。
细胞膜完整性当菌体细胞膜完整性遭到破坏时,细胞内容物外泄,通过测定培养液中蛋白质质量浓度的变化反映细胞膜完整性的破坏程度。制备菌悬液后,分别加入MIC、2MIC质量浓度的银杏叶提取液,以不加银杏叶提取液组为对照。37℃、150 r/min摇床培养12 h,每隔2小时取培养液,8 000 r/min离心3 min,取上清液用考马斯亮蓝法[12]测其蛋白质质量浓度。
银杏叶提取液对腐生葡萄球菌细胞壁的影响参考蓝蔚青等[13]方法,将已制备的供试菌液按1%接种体积分数加入到MIC、2MIC质量浓度的银杏叶提取液中,以不加银杏叶提取液组为对照。37℃、150 r/min摇床培养12 h,每隔2小时取样,3 500 r/min离心10 min,取上清液用测试盒进行碱性磷酸酶(AKP)的测定。
扫描电镜观察向MIC、2MIC质量浓度的银杏叶提取液中接种体积分数1%已制备好的供试菌液,37℃、150 r/min摇床培养12 h,取菌液1.5 mL在4℃、8 000 r/min离心5 min,收集沉淀。用2.5%戊二醛溶液使菌体沉淀重悬浮,在4℃固定10 h。将固定后的菌体用磷酸盐缓冲液洗涤3次后,分别用30%、50%、70%、90%、无水乙醇进行梯度脱水。冷冻干燥12 h后,将其涂至金属载体上,喷金后进行扫描电镜观察。
1.4 数据分析
实验数据采用重复实验平均值,以平均值±标准偏差表示。通过SPASS17.0软件用单因素方差分析(ANOVA)进行显著性差异分析(p<0.05),通过Origin8.5软件进行绘图。
2 结果与讨论
2.1 最小抑菌质量浓度(MIC)
如表1所示,银杏叶提取液对腐生葡萄球菌有较好的抑制作用。当银杏叶提取液质量浓度≥200 mg/mL时,腐生葡萄球菌无菌落生长。当银杏叶提取液质量浓度为100 mg/mL时,菌体数量未出现明显上升。因此,银杏叶提取液对腐生葡萄球菌的MIC为100 mg/mL。此结果与白秀君等[14]研究荷叶提取液对大肠杆菌的MIC为125 mg/mL结果相似。
2.2 抑菌率
计算得出MIC、2MIC质量浓度的银杏叶提取液对腐生葡萄球菌的抑菌率分别为60.58%和81.34%,这一结果也表明银杏叶提取液对腐生葡萄球菌有较好的抑制作用。

表1 银杏叶提取液对腐生葡萄球菌的抑菌效果Table 1 Antibacterial effect of Ginkgo biloba leaf extracts against Staphylococcus saprophyticus
2.3 细菌生长曲线
将MIC、2MIC质量浓度银杏叶提取液处理的腐生葡萄球菌与正常生长腐生葡萄球菌的生长曲线进行对比,结果见图1。

图1 银杏叶提取液对腐生葡萄球菌生长的影响Fig.1 Effect of Ginkgo biloba leaf extracts on the growth of Staphylococcus saprophyticus
由图1可知,银杏叶提取液处理组的细菌生长曲线发生了明显变化。在0~4 h内,MIC、2MIC质量浓度银杏叶提取液处理组的细菌数量未出现明显增长,在4 h后进入对数生长期时,其细菌数量也明显低于正常生长的腐生葡萄球菌。因此,银杏叶提取液可显著抑制细菌的菌体分裂,减缓其繁殖速度,延缓菌体进入对数生长期,从而抑制菌体生长。
2.4 细胞膜通透性
细胞膜是 Na+、K+、Ca2+等离子的通透性屏障,细胞膜的结构和化学成分可影响这些小分子物质。当细胞膜的结构发生改变时,可造成其离子渗漏,从而影响菌体的细胞膜功能和生长代谢,导致细胞死亡[15]。表2反映了银杏叶提取液对腐生葡萄球菌细胞膜通透性的影响。
如表2所示,随着时间的延长,培养液中电导率有显著性差异(p<0.05)。经MIC、2MIC质量浓度银杏叶提取液处理的两组菌液中电导率明显高于对照组,说明银杏叶提取液可破坏菌体细胞膜的结构,改变细胞膜的通透性,使细胞中金属离子外泄,抑制细菌正常生长代谢,造成菌体死亡。对照组的培养液中电导率也有上升趋势,可能是由于菌体细胞的自溶和死亡[12]。
2.5 细胞膜完整性
蛋白质等大分子物质是细胞膜和细胞质的重要单位结构物质,当细胞膜的完整性遭到破坏,这些大分子物质被释放出来,影响菌体的正常生长代谢,从而抑制细菌繁殖[12]。图2反映了银杏叶提取液对菌体细胞膜完整性的影响。
如图2所示,随着培养时间的延长,对照组培养液中蛋白质质量浓度相对稳定,而MIC、2MIC质量浓度银杏叶提取液处理组的培养液中蛋白质质量浓度迅速增大,呈明显上升趋势。说明经银杏叶提取液处理的菌体细胞膜完整性受到破坏,蛋白质大量泄漏,影响了其正常生长繁殖。菌体培养液中蛋白质质量浓度的上升趋势与张赟彬等[12]研究结果一致。
2.6 银杏叶提取液对腐生葡萄球菌细胞壁的影响
碱性磷酸酶(AKP)是一种水解酶,可催化β-甘油磷酸酯等有机磷酸单酯的水解,释放无机磷酸盐,广泛存在于动植物及微生物体内,对生物体内物质代谢有重要作用[16]。由于其存在于细胞膜与细胞壁间、与细胞膜相结合,所以当细胞壁遭到破坏时,在胞外可检测到碱性磷酸酶的存在。

表2 银杏叶提取液对腐生葡萄球菌细胞膜通透性的影响Table 2 Effects of Ginkgo biloba leaf extracts on the membrane permeability of Staphylococcus saprophyticus

图2 银杏叶提取液对腐生葡萄球菌细胞膜完整性的影响Fig.2 Effects of Ginkgo biloba leaf extracts on the membrane integrity of Staphylococcus saprophyticus
如图3所示,对照组中碱性磷酸酶量基本未发生变化,而经MIC、2MIC银杏叶提取液处理后,菌悬液中的碱性磷酸酶量变化明显。经银杏叶提取液处理2 h后,其碱性磷酸酶量显著升高,在处理6 h后达到最大值,随后降低直至趋于平稳。结果表明,菌体经银杏叶提取液作用后,菌体细胞壁受损严重,内容物渗出,导致胞外的碱性磷酸酶量明显升高。此结果变化趋势与蓝蔚青等[17]研究结果相似。
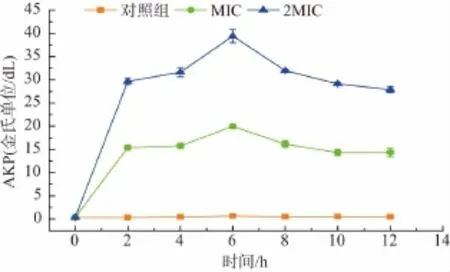
图3 银杏叶提取液对腐生葡萄球菌菌体细胞壁的影响Fig.3 Effects of Ginkgo biloba leaf extracts on the cell wall of Staphylococcus saprophyticus
2.7 扫描电镜分析
扫描电镜图可从细菌的菌体形态上直观反映银杏叶提取液的抑菌机理。银杏叶提取液对腐生葡萄球菌的作用电镜结果见图4。

图4 对照组和银杏叶提取液处理6 h的腐生葡萄球菌扫描电镜图Fig.4 Scanning electron microscopy of Staphylococcus saprophyticus treated by Ginkgo biloba leaf extracts for 6 h
由图4可知,未经银杏叶提取液处理的腐生葡萄球菌菌体细胞呈圆润球状、表面光滑,细胞聚集成葡萄串状,细胞间界限明显。而经银杏叶提取液处理6 h后,菌体细胞呈无规律排列,细胞大小不一、部分菌体细胞相互粘结,菌体细胞周围有小分子物质聚集。说明银杏叶提取液可通过抑制菌体细胞壁的合成或破坏细胞壁、改变细胞膜通透性来影响细菌的正常生长代谢,从而实现抑菌效果。
3 结 语
通过最小抑菌浓度、抑菌率、细菌生长曲线、电导率与碱性磷酸酶量测定,结合扫描电镜观察菌体形态,研究了银杏叶提取液对腐生葡萄球菌的抑菌机理。结果表明:银杏叶提取液对腐生葡萄球菌的最小抑菌质量浓度为100 mg/mL,MIC、2MIC质量浓度的银杏叶提取液对腐生葡萄球菌的抑菌率分别为60.58%和81.34%。各指标测定和扫描电镜结果表明,银杏叶提取液可抑制菌体细胞分裂繁殖,延缓其进入对数生长期,降低细胞膜流动性使细胞膜通透性增大,破坏细胞壁及细胞膜完整性,使细胞内容物外泄,抑制菌体正常生长代谢,造成菌体死亡。通过以水产品特定腐败菌——腐生葡萄球菌为研究对象,实验结果将为银杏叶提取液应用于水产品保鲜贮藏,为其向着天然、安全的方向发展提 供理论基础与研究思路。
