EMS诱变高异丁醇耐受性酿酒酵母的筛选
2018-11-03温智慧李敬知冯瑞琪苏意德张爱利
温智慧,李敬知,冯瑞琪,苏意德,张爱利*
(河北工业大学 化工学院,天津 300130)
随着能源不断短缺和环境不断恶化,新型能源的开发和利用备受瞩目。短链醇类作为清洁可再生生物能源,是重要的化工原料,也是化石燃料的理想替代者[1]。其中异丁醇吸湿性低,辛烷值高,其能量密度(27 MJ/L)与汽油(32 MJ/L)相近,燃烧产物对环境无污染[2],具有良好的应用和发展前景。微生物发酵法生产短链醇凭借绿色、低能耗和生产周期短等优势迅速成为生物能源研究的热点。然而随着发酵的进行,代谢产物不断积累,高浓度的醇类会破坏细胞膜的活性,导致细胞内蛋白质变性[3],影响线粒体的功能[4],严重抑制发酵过程,如延长发酵时间[5]、降低原料转化率和下游产品回收率[6]等,因此,筛选一株异丁醇耐受性高的菌株是提高微生物发酵产醇的关键。
酿酒酵母(Saccharomyces cerevisiae)与其他微生物相比,具有合成异丁醇的天然优势:DICKINSON J R等[7]在2000年就确定了酿酒酵母细胞可通过L-缬氨酸代谢途径合成异丁醇,如今其代谢网络已被研究的相对透彻,易于基因操作[8]。在2011年,CHEN X等[9]在酿酒酵母中过量表达编码乙酰乳酸合酶基因ILV2,厌氧条件下,异丁醇产率达到了0.97mg/g葡萄糖。在2012年,BRATD等[10]将线粒体中的ILV2、ILV5和ILV3基因定位到细胞质中,同时过量表达编码苯丙酮酸脱羧酶的基因ARO10,异丁醇产率达到15mg/g葡萄糖。此外,酿酒酵母细胞细胞壁坚韧,抗逆性强[11],发酵底物来源广泛,可利用自然界中广泛存在的木质纤维素[12],是实现生物发酵产醇的首选微生物。
诱变技术可以弥补一般的基因修饰难以形成生物新性状的不足,对产生优质基因资源有重要意义。甲基磺酸乙酯(ethyl methanesulfonate,EMS)是一类主要作用于细胞内核酸的烷化剂[13],具有点突变频率高、突变专一、染色体畸变相对较少等诸多优点[14]。目前,利用EMS诱变技术已成功构建了多种植物的突变体库,并且成功筛选出了具有优良性状的植物,如玉米、番茄和拟南芥等[15],而将其应用于微生物的研究相对较少。
为了得到异丁醇耐受性良好的菌株,进一步提高异丁醇的发酵产量,本实验利用EMS诱变酿酒酵母(Saccharomyces cerevisiae)W303-1A,筛选出数株突变菌株,通过对比细胞生长及耗糖情况,得到了一株遗传稳定、异丁醇耐受性良好且发酵能力相对较强的突变菌株。在上述筛选得到的突变菌株中过量表达L-缬氨酸代谢途径中的节点基因ILV2、ILV5、ILV3和ARO10并对其发酵性能进行检测,得到一株异丁醇耐受性良好且发酵产物产量较高的工程菌株,为进一步提高酿酒酵母细胞生产异丁醇的能力提供了新思路,为实现新型能源异丁醇投入发酵工业生产奠定了一定的基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
酿酒酵母(Saccharomyces cerevisiae)W303-1A:河北工业大学菌种保藏室保藏。
1.1.2 化学试剂
甲基磺酸乙酯(分析纯):上海麦克林生化科技有限公司;限制性内切酶(10 U/mL)、T4 DNA连接酶(10 U/mL):美国Thermo Scientific公司;Taq DNA聚合酶(500 U/mL):北京天根生化科技有限公司。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:20 g/L胰蛋白胨,10 g/L酵母抽提物,20 g/L葡萄糖,固体培养基添加2%琼脂粉,pH自然,121℃灭菌20min;
含异丁醇的YPD培养基:在YPD培养基中加入体积分数0.5%、1.0%、2.0%、3.0%的异丁醇;
完全选择培养基:6.7g/L无氨基酸酵母氮源(yeastnitrogenbase without amino acids,YNB),20 g/L葡萄糖,2 g/L除去标记氨基酸的氨基酸混合物,pH值为5.6,固体培养基添加2%琼脂,pH值为6.5,121℃灭菌20 min。
1.1.4 引物及质粒
实验中所用的质粒和引物分别如表1和表2所示。

表1 本研究中所用质粒Table 1 Plasmids used in this study

表2 本研究中所用引物序列Table 2 Sequences of primers used in this study
1.2 仪器与设备
SHK-99-Ⅱ台式空气恒温摇床:北方同正生物技术发展有限公司;DHP-9052电热恒温培养箱:上海一恒科学仪器有限公司;Hema3200聚合酶链式反应(polymerase chain reaction,PCR)扩增仪:珠海黑马医学仪器有限公司;721G紫外可见光分光光度计:上海仪电(集团)有限公司;Centrifuge5424高速离心机:上海艾本德生物技术国际贸易有限公司;1260型高效液相色谱仪(high performance liquid chromatograph,HPLC):美国Agilent公司;SCION 456-GC气相色谱仪(gas chromatograph,GC):布鲁克(北京)科技有限公司。
1.3 方法
1.3.1 酿酒酵母细胞活化
将酿酒酵母细胞接种于5 mL YPD液体培养基中,于30℃空气浴摇床中200 r/min振荡培养16 h。
1.3.2 平板稀释法稀释细胞
将酿酒酵母W303-1A活化后,取适量菌液于紫外分光光度计下测定其在波长600nm处的OD600nm值。将菌液OD600nm值调节为1,依次10倍稀释菌液稀释度至101、100、10-1、10-2、10-3、10-4、10-5,分别取10 μL上述不同稀释度的菌悬液,滴于YPD固体培养基上,于30℃恒温培养箱中培养2~3 d,观察菌落数。
1.3.3 W303-1A的异丁醇耐受性
将活化后的细胞悬液稀释至合适倍数,取100 μL分别涂于含异丁醇体积分数为0.5%、1.0%、2.0%、3.0%的YPD固体培养基上,于30℃恒温培养箱中培养2~3 d,观察细胞生长情况。
1.3.4 EMS含量的确定
将菌株W303-1A活化后,于13000r/min离心收集细胞,用磷酸缓冲液洗涤两次,离心去上清。用1 mL磷酸缓冲液重悬细胞后,加入EMS原液,使EMS终质量浓度分别为0、20 μg/mL、30 μg/mL、40 μg/mL、50 μg/mL、60 μg/mL,70 μg/mL,置于30℃、200 r/min摇床中培养30 min。向上述离心管中加入1 mL 5 mg/100 mL的硫代硫酸钠溶液,继续摇床培养10min以解除EMS的毒性。从摇床中取出菌悬液,13 000 r/min离心5 min收集细胞,按稀释平板法稀释至10-3,然后分别取40 μL涂布于含有不同含量异丁醇的YPD固体培养基上,于30℃培养箱培养2~3 d。观察菌株生长情况,并计算致死率,其计算公式如下:

1.3.5 突变菌株的筛选
酿酒酵母菌W303-1A经EMS诱变后按稀释平板法稀释至合适的OD600nm值,涂于含2%异丁醇的YPD固体培养基上,同时涂在不含异丁醇的YPD固体培养基上作对照。观察细胞生长情况并计数,筛选出生长旺盛的菌株重新培养于含3%异丁醇的YPD培养基上再次进行耐受性筛选,连续培养至第8代,验证遗传稳定性。
1.3.6 重组质粒与工程菌的构建
以酿酒酵母W303-1A染色体为模板,利用PCR扩增出所需目的基因ILV2、ILV5、ARO10、ILV3,纯化后用对应的限制性核酸内切酶进行切割。限制性内切酶失活后用T4 DNA连接酶将目的基因ILV2、ILV5与强启动子PGK1p相连后分别插入带有标记基因的高拷贝质粒YEplac195和YEplac112中,构建重组质粒YEplac195-PGK1p-ILV2(Y2)和YEplac112-PGK1p-ILV5-GFP-CYC1(Y5),将目的基因ARO10与强启动子TDH3p相连后插入带有标记基因的高拷贝质粒YEplac181中,构建重组质粒YEplac181-TDH3p-Cox4-ARO10-GFP-CYC1(Y10),以上3种质粒转入酿酒酵母中,通过质粒高拷贝数和强启动子实现ILV2、ILV5、ARO10基因的过量表达。以相同的方法将ILV3基因两端插入带有δ5'及δ3'基因片段的质粒pUC18中,构建重组质粒pUC18-δ5'-His-PGK1p-ILV3-δ3'(P3),转入酿酒酵母后,该质粒以δ整合的方式过量表达基因ILV3。扩增基因所用引物序列及其酶切位点如表2所示。利用醋酸锂转化法将质粒转化到酿酒酵母细胞中,涂于完全选择培养基上,通过质粒上的标记基因筛选转化子。
1.3.7 微厌氧发酵
菌株过夜活化后,以初始OD600nm值=0.2接入20 mL完全选择培养基中,30℃、200 r/min摇床培养16 h。取适量菌液以初始OD600nm值=0.2接入100mL发酵培养基(含40g/L葡萄糖的完全选择培养基)中,30℃、100 r/min微厌氧发酵36 h。
1.3.8 菌株生长及发酵性能的检测
在发酵过程的各个时间节点取样,利用紫外可见分光光度计和3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法分别测定发酵液细胞浓度及残糖量,绘制生长曲线和耗糖曲线。利用高效液相色谱与气相色谱分别测定发酵液中乙醇及乙酸的产量,其色谱条件为Carbomix H-NP色谱柱(7.8mm×300mm×10μm)及示差折光检测器,2.5mmol/L H2SO4作为流动相,流速0.6 mL/min,柱温55℃,检测器温度35℃。采用气相色谱仪测定异丁醇的产量,其色谱条件为HP-INNOWAX色谱柱(60 m×0.32 mm),柱温为80℃,维持10 min,进样口温度稳定在200℃,检测器的温度稳定在300℃。异丁醇产率计算公式如下:

2 结果与分析
2.1 对照型酿酒酵母异丁醇耐受性的测定
由图1A可知,通过平板稀释法将培养液的OD600nm值稀释至10-4时可看到清晰的单菌落,稀释至10-5未长出单菌落,因此确定将菌液稀释至10-4后点样;由图1B可知,出发菌株W303-1A在含异丁醇体积分数为2.0%和3.0%的培养基上不能生长。因此,筛选出能对2.0%及更高含量的异丁醇耐受性的菌株具有较高研究意义。
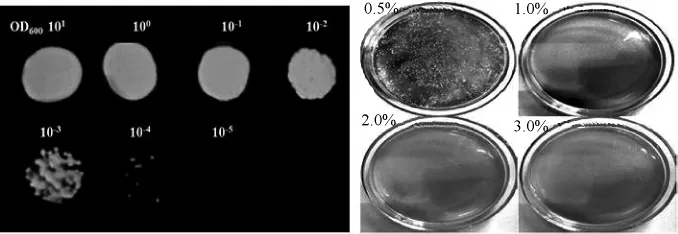
图1 不同稀释度培养液(A)和不同含量异丁醇(B)对菌株W303-1A的影响Fig.1 Effect of fermentation broth with different dilutions(A)and different isobutanol contents(B)on the growth of strainW303-1A
2.2 EMS诱变条件的确定
利用EMS可使酿酒酵母细胞产生突变,但过高浓度的EMS会导致细胞死亡,因此,为了得到最佳的突变效果,需要测定相对适宜的EMS诱变浓度。分别用不同浓度的EMS诱变等量活化过的酿酒酵母细胞W303-1A,诱变完成后分别取适量上述菌液稀释至10-3涂布于YPD固体培养基上培养,并计算致死率,结果见图2。
由图2可知,当EMS质量浓度为40 μg/mL时,酿酒酵母细胞致死率为78%,根据之前的实验研究,致死率为70%~90%时,EMS的诱变效果最佳[18]。因此,选择处于最适EMS质量浓度即40 μg/mL对菌株W303-1A诱变。
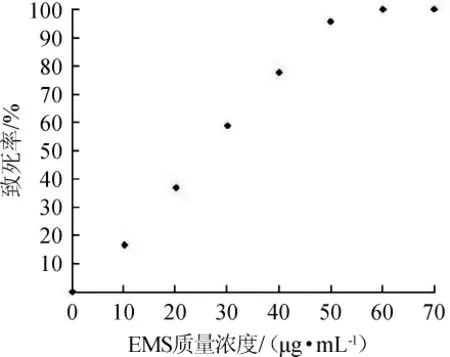
图2 EMS质量浓度与致死率关系Fig.2 Relationship between EMS concentration and fatality rate
2.3 高异丁醇耐受性菌株的筛选
酿酒酵母菌W303-1A经数次EMS诱变及筛选后,共得到60株突变菌株。结果见图3。

图3 突变菌株在YPD培养基与含2%异丁醇YPD培养基上的筛选结果Fig.3 Screening results of mutant strains on YPD medium and YPD medium with isobutanol 2%
由图3可知,通过对比含在有2%(V/V)异丁醇的YPD培养基上稀释度为10-3和10-4时的单菌落的个数及大小可以发现,1#、10#、18#、20#~22#、24#、26#、28#、30#~32#、37#~40#、42#、44#、47#、49#、50#和57#~60#突变菌株生长相对良好,其中7株可在含3%(V/V)异丁醇的YPD培养基上生长,结果如图4所示。
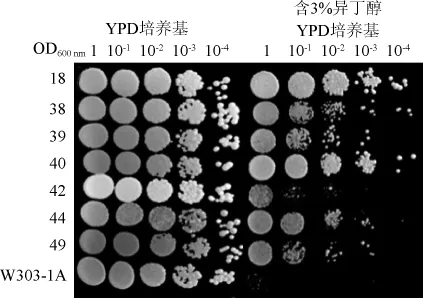
图4 突变菌株在YPD培养基与含3%异丁醇YPD上的筛选结果Fig.4 Screening results of mutant strains on YPD medium and YPD medium with isobutanol 3%
由图4可知,通过对比在含有3%异丁醇的YPD培养基上稀释度为10-3和10-4时的单菌落个数及大小可以发现,18#、38#、39#和40#菌株生长能力较强。因此,选择18#、38#、39#和40#菌株验证遗传稳定性后进行发酵性能的检测。
2.4 突变菌株的发酵性能检测
将18#、38#、39#和40#突变菌株及对照菌株W303-1A进行微厌氧发酵,测定其生长曲线和葡萄糖消耗曲线,结果见图5。
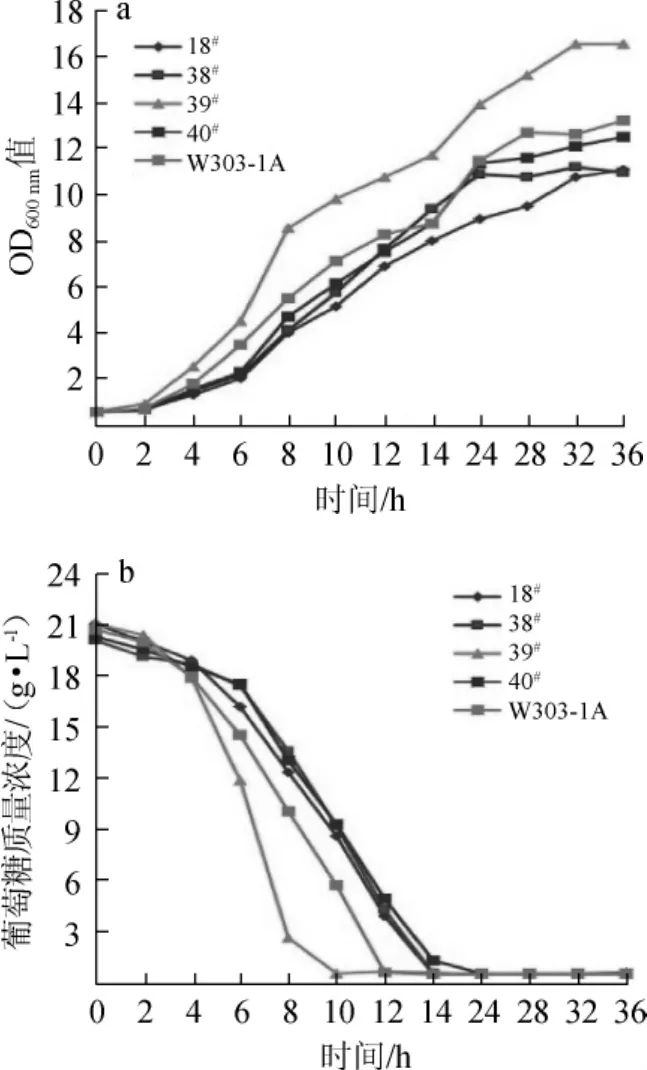
图5 突变菌株与对照菌株的生长(a)及耗糖(b)情况Fig.5 The cell growth(a)and glucose consumption(b)of mutant strains and the control strain
如图5a所示,39#突变菌株生长速率明显高于18#、38#、40#突变菌株和对照菌株W303-1A,细胞浓度最大,OD600nm值达到16。18#、38#、40#株突变菌株与303-1A的相比,生长速率和细胞浓度差异不大。
如图5b所示,39#突变菌株耗糖能力明显强于18#、38#、40#突变菌株和对照菌株W303-1A,在10 h时葡萄糖基本消耗完。而对照菌株W303-1A在发酵12 h时将培养基中的葡萄糖耗尽,18#、38#和40#突变菌株在发酵14 h后逐渐将葡萄糖耗尽。因此,选定异丁醇耐受性最佳、生长能力最强的39#突变株(EMS39)作为宿主菌,进一步优化其合成异丁醇的能力。
2.5 工程菌株的构建及微厌氧发酵能力检测
将重组质粒Y2、Y5、Y10和P3共转化突变株EMS39和对照菌W303-1A中,得到工程菌株EMS39 23510和W303-1A 23510。将对应的4个空载体转化入对照菌W303-1A中得到菌株W303-1A-EP(对照菌)。然后将上述3株菌同时进行微厌氧发酵实验,在发酵的各个时间节点取样测定菌体生长能力及葡萄糖消耗能力,结果见图6。在发酵的各个时间节点取样测定菌株产异丁醇、乙醇和乙酸的能力,各时间节点发酵液中异丁醇、乙醇和乙酸的浓度结果见图7。
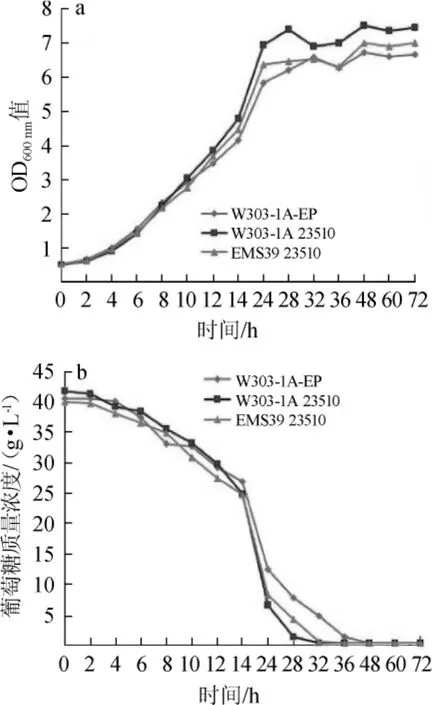
图6 工程菌和对照菌的生长(a)和耗糖情况(b)Fig.6 The cell growth(a)and glucose consumption(b)of engineering strains and the control strain
如图6a所示,在发酵前8h内菌株EMS3923510、W303-1A 23510和对照菌W303-1A-EP生长速率基本相同,8 h后菌株EMS39 23510、W303-1A 23510的生长速率高于对照菌,在24 h后3株菌生长浓度达到最大值。其中菌株W303-1A 23510细胞浓度最大,生长能力最强,出发菌株W303-1A细胞浓度最小,生长能力最弱。
如图6b所示,菌株EMS39 23510和W303-1A 23510耗糖速度较快,32 h后两株工程菌的葡萄糖基本耗尽,而菌株W303-1A-EP耗糖速度相对较慢,于48 h后葡萄糖耗尽。由此看出,突变菌株EMS39与出发菌株W303-1A相比,生长及耗糖能力明显提高。

图7 工程菌和对照菌发酵产异丁醇(a)、乙醇(b)及乙酸(c)结果Fig.7 Results of isobutanol(a),alcohol(b)and ethanoic acid(c)productions by the fermentation of engineering strains and the control strain
如图7a所示,菌株EMS39 23510和W303-1A 23510的异丁醇产量在发酵24h之后逐渐提高。菌株EMS3923510在32 h时异丁醇产量达到404.2 mg/L,菌株W303-1A 23510在60 h异丁醇产量达到389.1 mg/L。在整个发酵期间,对照菌W303-1A-EP的异丁醇质量浓度提高并不明显,在48 h产量最高,为64.2 mg/L。对比3株菌的异丁醇产量可知,菌株EMS39 23510比菌株W303-1A-EP提高了529.6%,比菌株W303-1A 23510提高了3.9%,异丁醇产率达到10.11 mg/g葡萄糖,与菌株W303-1A-EP相比提高了530.0%。
如图7b所示,菌株EMS39 23510的乙醇产量依然高于菌株W303-1A 23510和对照菌W303-1A-EP。菌株EMS39 23510乙醇产量于32 h达到最高,为4 342.9 mg/L,菌株W303-1A 23510和W303-1A-EP和分别于60 h和48 h产量达到最高,分别为4 157.6 mg/L和3 449.3 mg/L。
如图7c所示,菌株EMS39 23510乙酸产量明显高于菌株W303-1A 23510和W303-1A-EP。菌株EMS39 23510的乙酸产量在32 h之后达到最大值,为1 196.4 mg/L,并基本维持在1165.1mg/L。而菌株W303-1A 23510和菌株W303-1A-EP的最高乙酸产量分别为454.6 mg/L和434.1 mg/L,发酵48 h之后产量最低,均为22.4 mg/L。
3 结论
本实验利用化学试剂EMS对酿酒酵母菌株W303-1A进行诱变,确定了突变剂EMS作用的最适的质量浓度为40 μg/mL。筛选得到60株可在含2%异丁醇的YPD培养基上生长的突变菌株,其中7株可在含3%异丁醇的YPD培养基上生长。通过测定生长和耗糖情况,筛选得到1株遗传稳定、耐受异丁醇良好发酵优势菌株EMS39。
在EMS39中过量表达ILV2、ILV5、ILV3和ARO10基因,得到EMS39 23510。发酵数据显示,菌株EMS39 23510发酵产物与W303-1A 23510和对照菌W303-1A-EP相比,产量明显提高,其中异丁醇产量提高尤为明显,在32 h时达到404.2 mg/L,比菌株W303-1A-EP提高了529.6%,比菌株W303-1A 23510提高了3.9%;异丁醇产率达到10.11 mg/g葡萄糖,比菌株W303-1A-EP提高了530.0%;乙醇和乙酸产量较对照菌W303-1A-EP相比分别提高了25.9%和175.6%,与菌株W303-1A 23510相比分别提高了4.5%和163.2%。
菌株EMS39 23510生长和发酵能力较强,也是基因工程操作的优质宿主菌。本工作构建的突变体库在酿酒酵母发酵产异丁醇研究方面具有重要意义,同时,为进一步提高微生物发酵能力提供了新思路,在一定程度上为实现新型能源的开发和利用奠定了基础。
