不同地区小曲中可培养细菌的筛选及鉴定
2018-11-03满都拉郑逸飞孙子羽陈忠军
满都拉,刘 昊,郑逸飞,孙子羽,陈忠军*
(内蒙古农业大学 食品科学与工程学院,内蒙古 呼和浩特 010018)
小曲是中国传统酒曲的一种[1],是酿造小曲白酒和黄酒的重要糖化剂和发酵剂[2]。小曲一般是以米粉、米糠或麸皮为原料,会添加一些中草药或少量白土(观音土),接种曲母或纯培养的根霉、酵母菌,加入适量水制成曲丸或方粒,经人工控制温度、湿度等条件培养而成的干燥物[3-4]。由于曲块个体较小,人们习惯上称为小曲[4]。不同地区叫法略有不同,如白药、白曲、酒药、酒饼、糠曲、药曲、酒曲丸等[5]。
小曲中包含大量的微生物和酶类,一般认为主要由酵母菌、霉菌和细菌组成[6]。虽然细菌在小曲中数量较少,但发挥着不可替代的作用。不同种类的细菌对小曲酒的品质有不同的影响,一些细菌会产生淀粉酶、酯化酶等,对出酒率和酒的风味有重要影响[7],一些细菌代谢产生酸类、醛类等物质,对小曲酒香型的呈现和品格的提升具有重要意义[8]。小曲中添加的不同中草药对曲中微生物有重要影响。有研究表明[9]较添加桑叶和辣蓼,桂皮小曲中细菌总数最低。翟平平等[10-11]利用分子生物学手段分析某地小曲后发现,小曲中主要微生物类群为乳酸菌属(Lactobacillus sp.),此外还有黄单胞菌属(Xanthornonas sp.)、沙雷氏菌属(Serratia sp.)、木崎氏菌属(Kozakia)及片球菌属(Pediococcus)等菌属。
不同气候条件和不同原料等对小曲中微生物组成都有重要的影响。本研究以湖北、安徽和四川3个地区的小曲为研究对象,采传统培养方法及分子生物学方法,分离和鉴定其中可培养细菌,为进一步研究小曲酒风味形成及改良小曲奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 小曲
小曲:采自湖北宜昌(样品A)、安徽亳州(样品B)和四川达州(样品C)。小曲形态及主要原料如表1所示。
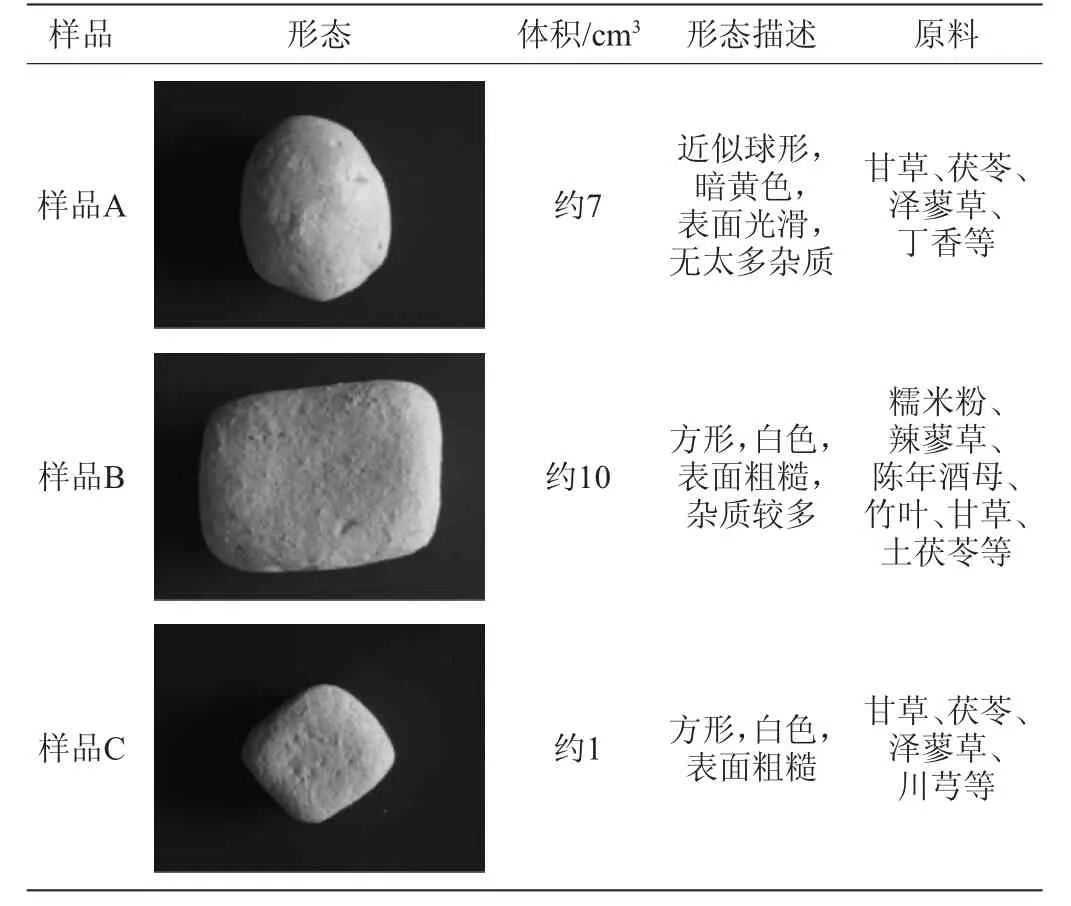
表1 小曲形态及主要原料Table 1 Morphology and main raw materials of Xiaoqu
1.1.2 培养基
LB固体培养基:胰蛋白胨5.0 g,酵母粉2.5 g,氯化钠5.0g,加入蒸馏水500mL,调pH值7.2后加7.5 g琼脂,121℃、20 min高压灭菌。
1.1.3 化学试剂
革兰仕染色试剂盒:广州凯元生物科技有限公司;NaOH、HCl、体积分数为75%乙醇、胰蛋白胨、酵母粉、氯化钠、琼脂、琼脂糖等均为国产分析纯或生化试剂。
1.2 仪器与设备
DYCP-31BN型琼脂糖水平电泳仪:北京六一仪器厂;LDZX-50KBS立式压力蒸汽灭菌器:上海精密科学仪器有限公司;S1000美国伯乐聚合酶链式反应(polymerase chain reaction,PCR)仪:上海旦鼎国际贸易有限公司;PHB-1/PHB-10pH计:上海精贤光电科技有限公司;DHP-9012电热恒温培养箱:品相科仪(上海)有限公司。
1.3 实验方法
1.3.1 小曲中可培养细菌的分离
利用体积分数为75%乙醇对小曲表面进行灭菌后,中心部分用研钵轻微研磨,取1.0 g溶于100 mL无菌水,振荡1~2 min,静置5 min后,待用。吸取上步1 mL菌液进行梯度稀释,取10-3、10-4、10-5各0.1 mL涂布于培养皿,30 ℃恒温培养培养24 h。挑取形态及颜色不同的单一菌落进行划线纯化,每个单菌落纯化3次。镜检:格兰氏染色后进行镜检。
1.3.2 小曲中可培养细菌的分子生物学鉴定
基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取:采取反复冻融法提取基因组DNA,在2 mL离心管中加入1 mL无菌水,挑取单一菌落混匀,-80℃冷冻20 min,取出后立即置于90℃水浴20 min,反复操作3次。
16S rDNA扩增及琼脂糖电泳:利用细菌通用引物27F(5'-AGAGTTTGATCMTGGCTCAG-3')和1492R(5'-TACGGYTACCTTGTTACGACTT-3')为引物,PCR扩增条件为94℃预变性10 min;95℃变性30 s,55℃退火30 s,72℃延伸1.5 min(循环30次);72℃再延伸1.0 min。取5 μL PCR产物与1 μL上样缓冲液混合后进行1%的琼脂糖凝胶电泳。
PCR产物测序:由生工生物工程(上海)股份有限公司完成。
同源性比较:登录美国国家生物技术信息中心(national centerof biotechnology information,NCBI),将所得的基因序列用基本地方调整搜寻工具(basic local alignment search tool,BLAST)进行同源性比较,系统发育树利用Mega 7中的邻接(neighbor joining,NJ)法构建。
1.3.3 分析检测
pH的测定:用研钵将样品粉碎,称取10.0 g溶于100 mL蒸馏水,振荡摇匀,静置30 min后,用pH计测定pH值;含水量测定:失重法;密度测定:排水法。
2 结果与分析
2.1 不同地区小曲pH、含水量及密度
不同地区小曲pH、含水量及密度测定结果见表2。由表2可知,安徽和四川的小曲pH相近(5.35~5.60),而湖北小曲的pH略微偏低,这可能与3种小曲的制作原料及所含微生物不同有关。安徽小曲的含水量(12.33%)明显高于四川小曲(9.41%)和安徽小曲(9.93%),这可能与安徽的气候条件及保藏方式有关。3种小曲的密度差异较小(0.84~0.92 g/mL)。
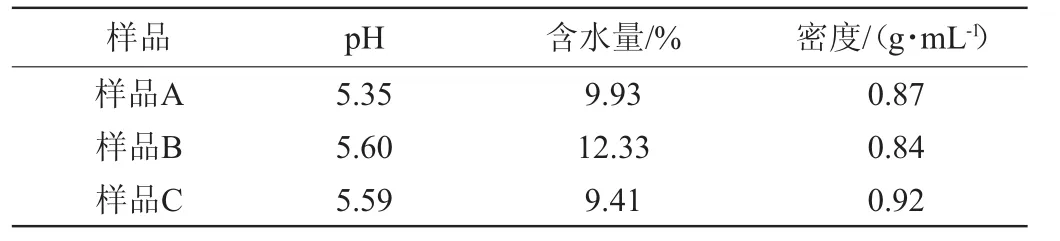
表2 不同地区小曲pH、含水量及密度测定结果Table 2 Determination results of pH,moisture and density of Xiaoqu from different regions
2.2 不同地区小曲中可培养细菌的分离及鉴定
2.2.1 湖北小曲中可培养细菌的分离及鉴定
湖北小曲中共分离出8株可培养细菌,细胞形态及菌落形态如表3所示。由表3可知,湖北小曲中分离的8株可培养细菌均为杆状、革兰氏阳性菌。
经基因组提取、PCR扩增及电泳,湖北小曲中可培养细菌16S rDNA扩增结果如图1所示。由图1可知,PCR扩增产物的长度在1 000~2 000 bp之间,符合所选引物扩增长度。PCR产物测序及同源性比对结果如图2所示。由图2可知,湖北小曲中分离得到的可培养细菌中有6株鉴定为枯草芽孢杆菌(Bacillus subtilis),1株鉴定为泛菌属(Pantoea spp.),1株鉴定为丰年芽孢杆菌(Bacillus toyonensis)。湖北小曲可培养细菌系统进化树中有3个大簇。第一大簇中菌株XQA-3B、XQA-3C、XQA-5C、XQA-5A、XQA-5B和XQA-3D与枯草芽孢杆菌同源性均为100%;第二大簇中只有一株XQA-4A,其与B.toyonensis同源性为100%;第三大簇中菌株XQA-3A与泛菌属同源性为100%。
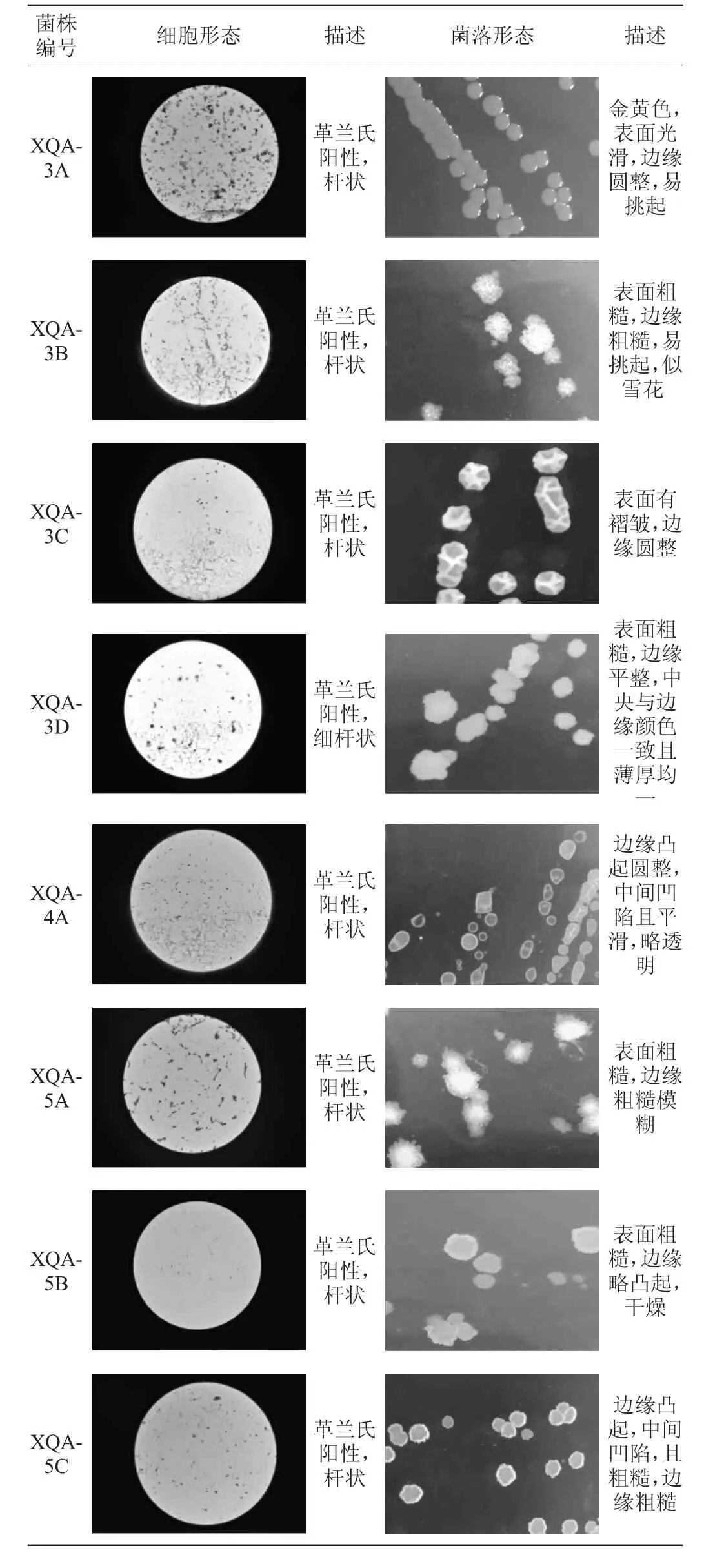
表3 湖北小曲可培养细菌细胞及菌落形态Table 3 Cell and colony morphology of the cultureable bacteria in Hubei Xiaoqu
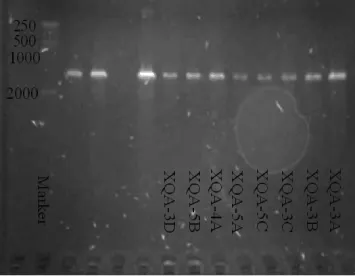
图1 湖北小曲可培养细菌16S rDNA PCR扩增产物结果Fig.1 PCR amplification products results of 16S rDNA of the culturable bacteria in Hubei Xiaoqu

图2 湖北小曲可培养细菌系统进化树Fig.2 Phylogenetic tree of the culturable bacteria in Hubei Xiaoqu
2.2.2 安徽小曲中可培养细菌的分离及鉴定
安徽小曲中共分离出5株可培养细菌,细胞及菌落形态见表4。由表4可知,分离得到的5株细菌均为杆状,革兰氏阳性菌。

表4 安徽小曲可培养细菌细胞及菌落形态Table 4 Cell and colony morphology of the cultureable bacteria in Anhui Xiaoqu

续表
经基因组DNA提取及PCR扩增,安徽小曲中可培养细菌16S rDNA扩增结果如图3所示。由图3可知,PCR扩增产物长度在1 000~2 000 bp之间,符合目的片段长度。PCR产物经测序及同源性比对结果见图4。由图4可知,安徽小曲中分离得到的可培养细菌中3株为植物乳杆菌(Lactobacillus plantarum),1株为埃希氏菌属(Escherichia spp.),1株为枯草芽孢杆菌(Bacillussubtilis)。安徽小曲可培养细菌系统进化树中有2个大簇,第一大簇又分为两个小簇。菌株XQB-4A、XQB-4E和XQB-4C与植物芽孢杆菌的同源性均为100%;菌株XQB-3A与枯草芽孢杆菌同源性为100%;菌株XQB-5B与埃希氏菌属同源性为100%。

图3 安徽小曲可培养细菌16S rDNA PCR扩增产物结果Fig.3 PCR amplification products results of 16S rDNA of the culturable bacteria in Anhui Xiaoqu
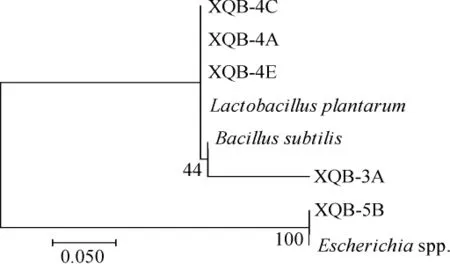
图4 安徽小曲可培养细菌系统进化树Fig.4 Phylogenetic tree of the culturable bacteria in Anhui Xiaoqu
2.2.3 四川小曲中可培养细菌的分离及鉴定
四川小曲中共分离出7株可培养细菌,细胞形态及菌落形态见表5。由表5可知,7株细菌均为杆状,革兰氏阳性菌。
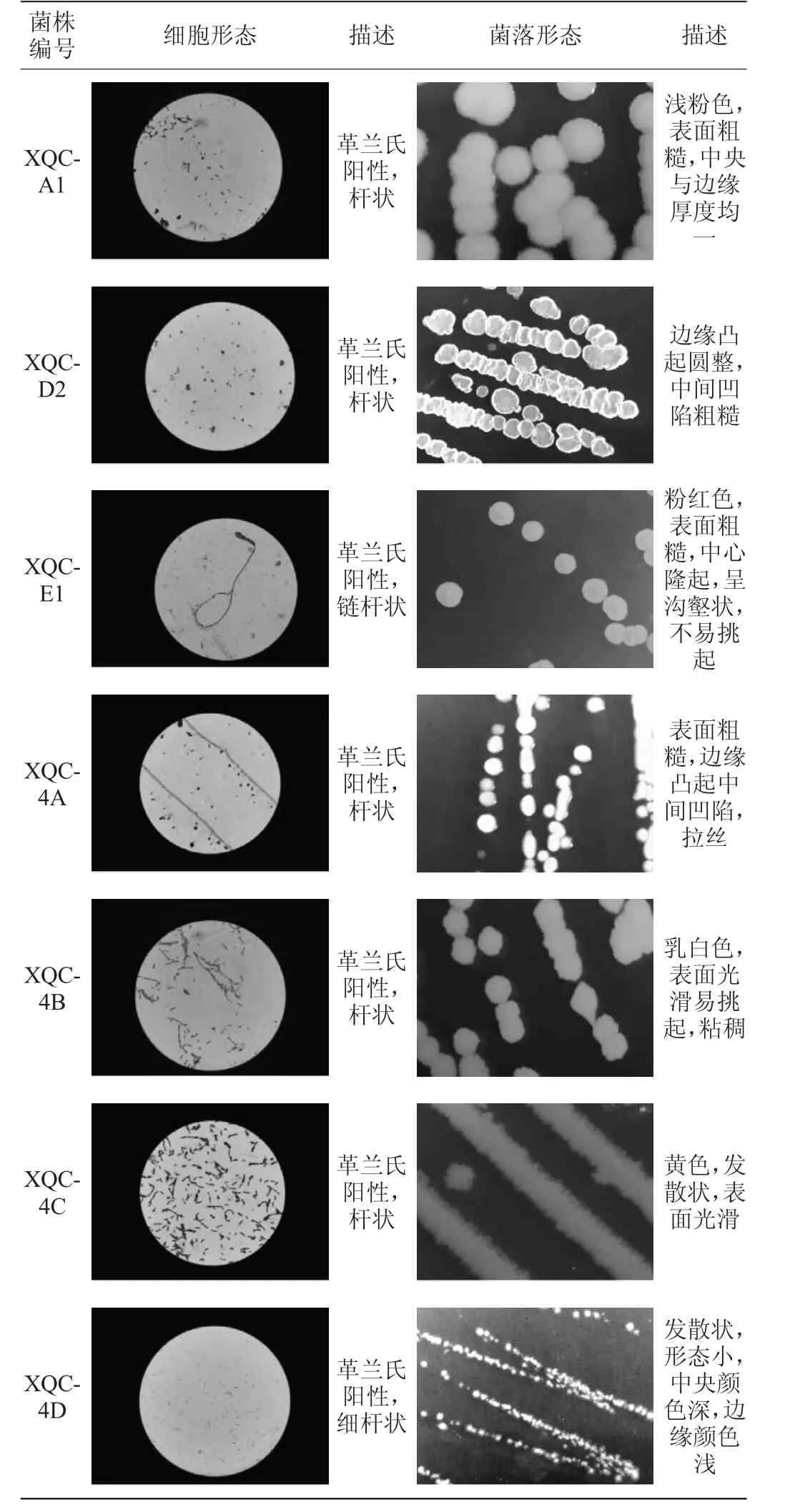
表5 四川小曲可培养细菌细胞及菌落形态Table 5 Cell and colony morphology of the cultureable bacteria in Sichuan Xiaoqu
经基因组DNA提取及PCR扩增,四川小曲中可培养细菌16S rDNA扩增结果如图5所示。由图5可知,PCR扩增产物长度在1 000~2 000 bp之间,符合目的片段长度。PCR产物经测序及同源性比对,结果见图6。由图6可知,四川小曲中分离的可培养细菌分别为2株枯草芽孢杆菌(Bacillus subtilis),1株丰年芽孢杆菌(Bacillus toyonensis),1株普城沙雷氏杆菌(Serratia plymuthica),1株炭疽芽孢杆菌(Bacillus anthracis),1株蜡状芽孢杆菌(Bacillus cereus)及1株Burkholderia fungorum。四川小曲中可培养细菌系统进化树中主要有3个大簇。第一个大簇中的菌株XQC-4C、XQC-A1和XQC-4B分别与蜡状芽孢杆菌、B.toyonensis和炭疽芽孢杆菌的同源性为100%。第二大簇中的菌株XQC-4D和XQC-D2与枯草芽孢杆菌同源性为100%。第三大簇中菌株XQC-E1与普城沙雷氏杆菌的同源性为75%,而菌株XQC-4A与B.fungorum同源性达到100%。

图5 四川小曲可培养细菌16S rDNA PCR扩增产物结果Fig.5 PCR amplification products results of 16S rDNA of the culturable bacteria in Sichuan Xiaoqu

图6 四川小曲可培养细菌系统进化树Fig.6 Phylogenetic tree of the culturable bacteria in Sichuan Xiaoqu
2.3 讨论
本研究中3种小曲内可培养细菌主要以芽孢杆菌为主,其中包括枯草芽孢杆菌、B.toyonensis、蜡状芽孢杆菌、炭疽芽孢杆菌等。3种小曲中均有枯草芽孢杆菌,此类菌在土壤和植物表面普遍存在,易于存活,可分泌出多种酶和抗生素,有良好的发酵基础。湖北小曲中发现了泛菌属,此类菌一般存在于植物中,可能由制作原料带入。它在酿造过程中没有提升酒的产量或质量的作用,且其自身的生长代谢会消耗一定的营养物质[12]。泛菌属在发酵过程中,会发酵糖类产酸,应该适当减少小曲中泛菌属的数量,以防影响酒的质量。在四川小曲中发现了B.fungorum,李浩等[13]在构建该种细菌的分批发酵动力学模型时指出B.fungorum有较好的葡萄糖发酵能力。同时在四川小曲中还发现了蜡状芽孢杆菌和炭疽芽孢杆菌,蜡状芽孢杆菌对单糖的利用率较高。炭疽芽胞杆菌的氨基酸降解和转运途径较丰富[14],对酒产品的发酵起一定的促进作用。有关分子生物学研究显示,小曲中的主要细菌类群以乳酸菌属为主[10-11,15],而在本研究中只有在安徽小曲中分离出了乳酸菌属。这可能由两方面原因造成,一是所用分离培养基为LB培养基,不是乳酸菌属适合的培养基。其次是在初筛的过程中由形态特征不明显,误认为同一株菌而被淘汰。
3 结论
不同原料、不同气候条件对小曲中可培养细菌种类有很大的影响。芽孢杆菌为小曲中主要可培养细菌,其中枯草芽孢杆菌为最常见。湖北小曲中发现的泛菌属可发酵糖类产酸,会影响酒产品的质量,适当减少小曲中泛菌属的数量有利于提高小曲酒的品质。在安徽小曲中发现的植物乳杆菌,它在发酵过程中,对食品的风味和质量有着重要的影响,埃希氏菌属中部分菌种对发酵有利,但部分菌种可致病,因此在生产过程中要注意致病菌。四川小曲中发现了Burkholderia fungorum、蜡状芽孢杆菌、炭疽芽孢杆菌,这3种菌对发酵都有一定促进作用,但某些炭疽芽孢杆菌是致病菌应予以注意。
