褶皱臂尾轮虫Brachionus plicatilis摄食小球藻Chlorella sp.的碳同化与碳排放
2018-11-02刘庆霞周林滨杨玉敏
刘庆霞,周林滨,毋 赟,杨玉敏,张 黎
1 中国科学院南海海洋研究所 中国科学院热带海洋生物资源与生态重点实验室,广州 510301 2 中国科学院大学,北京 100049 3 南京信息工程大学环境科学与工程学院,南京 210044 4 广东省海洋与渔业环境监测预报中心,广州 511400
浮游动物不仅是初级生产者和高营养级鱼类的纽带,其自身排放的有机碳也可为细菌利用,参与微食物环能量流动和物质循环,在海洋碳循环中发挥重要作用。浮游动物摄食的碳主要分配到两个部分:碳同化和碳排放。浮游动物排放的碳以3种形式进入水体:分泌和排泄产生的溶解有机碳(DOC,Dissolved organic carbon)、呼吸作用释放的二氧化碳(CO2)及排泄作用产生的颗粒有机碳(POC,Particulate organic carbon)[1-2]。浮游动物排放的DOC不仅向水体供应氮、磷等营养元素,还参与微食物环的能量流动和物质循环,是海洋DOC的重要来源之一[3]。浮游动物摄食浮游植物产生的粪便(POC)是海洋生物泵向深海输送碳的重要组成部分[4- 6]。不仅如此,部分浮游动物排泄产生的POC会迅速分解成DOC,为微生物提供所需的能量[7- 8]。此外,浮游动物垂直迁移活动使其排放的DOC与POC成为中层海洋有机碳的重要来源[9- 11]。浮游动物通过呼吸作用把有机碳转化为CO2,是浮游动物碳排放的重要组成部分,也是海洋无机碳的重要来源[2,6,12]。
然而,目前对3种形态碳占浮游动物碳排放比例的认识,存在争议。一些学者认为浮游动物碳排放主要以CO2和POC为主,对DOC的排放关注较少[13],但也有学者提出了不同看法。通过直接测定浮游动物排放的DOC,Xu和Wang[2]的研究发现刺尾纺锤水蚤Acartiaspinicauda的碳排放以CO2和DOC形式为主,POC最少;Strom等[14]的研究也表明太平洋哲水蚤Calanuspacificus排放的DOC量占其摄入食物碳的16%—29%,表明浮游动物来源DOC是海洋DOC的重要组成部分。因此,我们有必要定量分析各形态碳占浮游动物碳排放的比例,尤其关注DOC的排放比例。
一直以来,人们认为海洋中的DOC主要由浮游植物贡献,忽略了浮游动物排放的DOC。然而,最近的研究显示,浮游植物产生的DOC不能满足细菌生理活动所需,需要浮游动物等其他生物产生的DOC对海洋有机碳和微食物环的贡献[15- 17]。Williams[15]认为约60%浮游植物初级生产产生的DOC最终被细菌吸收利用;Peterson[16]根据碳流模型估计,浮游植物的有机物释放贡献了细菌所需营养物质的73%;Sharp[17]则认为碳流模型估算比真实值高了大约25%。而越来越多的研究也表明,浮游动物可以产生大量的DOC[1-2,14,18]。因此,我们认为细菌所需的DOC不仅仅由浮游植物提供,浮游动物的碳贡献也可能占有很大的比例[2,18-19]。
轮虫广泛分布于淡水与海洋中,是后生动物中拥有最高繁殖速率的类群,能够极其迅速地抢占生态系统中空的生态位,摄食浮游植物将能量转化为可被次级消费者(甲壳动物和鱼类幼苗)利用的有机物。轮虫转换效率极高,由它所转换的生物量可占总浮游生物现存量的30%左右。虽然轮虫个体小,生物量也不是很高,但由于发育时间短,周转快,故其生产量仍较高。国际上对轮虫的研究多集中于摄食和生态毒理学领域[20- 23],目前还未有轮虫碳同化及碳排放的相关报道。
褶皱臂尾轮虫Brachionusplicatilis是一种海洋轮虫,它们分布在河口及沿岸浅海区,具有分布广、繁殖快、生命周期短、易于实验室培养等优点,因而被美国材料与试验协会选定为海洋模式生物[24]。椭圆小球藻Chlorellaellipsoidea是培养褶皱臂尾轮虫的最佳饵料之一[20]。因此本文以小球藻Chlorellasp.为饵料,分析在不同饵料密度下褶皱臂尾轮虫摄食碳的分配情况。运用放射性同位素14C示踪技术,量化分析褶皱臂尾轮虫摄食碳的分配,计算轮虫的碳同化率,得出DOC、CO2、POC占碳排放的比例。此外,我们根据粒径大小将DOC分为低分子量有机碳(LMW,Low molecular weight organic carbon,< 3 kDa)和胶体有机碳(COC,Colloidal organic carbon,3 kDa—0.22 μm),研究两种形态DOC所占的比例。
1 材料与方法
1.1 概念模型

从图1的概念模型可以看出,浮游动物摄食的碳经过消化后,未被吸收的碳以POC形式排出,被吸收的碳流向两个碳库:代谢碳库和结构碳库。代谢碳库碳周转率较快,一部分碳以DOC和CO2形式排出,另一部分碳最终被同化储存在结构碳库中。

图1 褶皱臂尾轮虫碳收支概念模型 Fig.1 Conceptual model of carbon budget in Brachionus plicatilisDOC:溶解有机碳,Dissolved organic carbon;POC:颗粒有机碳,Particulate organic carbon
1.2 小球藻和褶皱臂尾轮虫
实验材料为小球藻和褶皱臂尾轮虫,小球藻平均细胞直径为3—8 μm,褶皱臂尾轮虫大小为0.04—2 mm,均由广东省实验动物监测所提供。
实验中所用海水采用人工配置海水[27],盐度为30‰,pH值控制在8.0,并用0.22 μm聚醚砜膜(Millipore,USA)过滤。小球藻培养基根据f/2配方配置[28],灭菌处理后用0.22 μm聚醚砜膜过滤。小球藻培养温度控制在(23.5±1)℃,光强为120 μmol m-2s-1,光暗比为14 h∶10 h。当小球藻生长6 d后,其密度达到1×106个/mL左右,取1 L小球藻溶液,用孔径为1.2 μm的聚碳酸酯膜进行过滤收集,然后将收集的小球藻转移到1 L新的培养基中,加入1 mL浓度为40 μCi/L NaH14CO3标记液进行标记。经过2 d的生长,小球藻细胞均已被14C标记,最终标记浓度为3.2×10-9μCi/个。在褶皱臂尾轮虫喂食实验前,用1.2 μm的聚碳酸酯膜分别收集未标记和14C标记的小球藻,用于喂食实验。
在人工海水中进行褶皱臂尾轮虫培养,温度控制在(25±1)℃,在均匀光照下培养,光暗比为14 h∶10 h,饵料为小球藻。
1.3 褶皱臂尾轮虫喂食实验
参考褶皱臂尾轮虫摄食实验(褶皱臂尾轮虫存活和繁殖的最低饵料密度1×105个/mL,最佳饵料密度为1×106个/mL)[20]的结果,褶皱臂尾轮虫喂食实验设置三个小球藻密度:1×105、5×105、1×106个/mL。实验前,将轮虫禁食12 h,然后将饥饿状态的轮虫,分别装入25只盛有25 mL海水的烧杯中,每只烧杯500只轮虫。实验开始后,在暗处用14C标记的小球藻喂食轮虫,喂食密度为1×105个/mL。根据轮虫摄食到排泄时间间隔(10—15 min),喂食时间定为5 min。喂食完毕后,用筛绢(325目)收集轮虫,用过滤的海水清洗后,将其中5组轮虫样品分别装入闪烁瓶中,用于测定摄入的总14C,其余20组轮虫样品分别转移到装有25 mL过滤海水的烧杯中,用相同密度未标记的小球藻喂食,然后将其置于暗处防止轮虫产生的14CO2被小球藻吸收利用。分别于0、2、5、8、12 h取样,每次取样5组,其余各组更换水后加入相同密度未标记的小球藻,继续在暗处净化。在2、5、8、12 h取样时,收集完轮虫样品后,用0.22 μm聚醚砜膜(Millipore,USA)过滤所有水样,收集滤膜至闪烁瓶中用于测定PO14C,分别取3 mL滤液至闪烁瓶中用于测定DO14C和LMW DO14C,另取15 mL滤液用于收集14CO2。当小球藻密度为5×105和1×106个/mL时,喂食实验操作和取样步骤同上。
轮虫样品与PO14C样品需要分别加入1 mL浓度为2 mol/L的NaOH,然后在80℃下消解24 h。参照Lee和Fisher[29]、Wang和Guo[30]收集14CO2:在收集的15 mL滤液样品中,加入100 μL浓度为6 N的稀盐酸,充入氮气,将14CO2驱赶至装有5 mL NaOH溶液(1 mol/L)的闪烁瓶中,充气时间为15 min,14CO2的收集效率为80%。
CO14C和LMW DO14C测量方法依据Zhang和Wang[31]。将3 mL滤液样品置于超滤管(Amicon,Ultra- 4,3 kDa;Millipore, USA)中,然后在4℃下,以10000 r/min离心15 min,将CO14C与LMW DO14C分离。取过滤液用于测定LMW DO14C,然后CO14C占DO14C的比例可根据以下公式进行计算:
式中,%COC代表CO14C占DO14C的比例,Rdissolved代表DO14C样品的值,RLMW代表LMW DO14C样品的值。

1.4 数据分析与统计
用Excel、Sigmaplot软件进行数据分析并做图,用SPSS软件包中的单因素方差分析比较净化过程中及净化结束后各形态碳之间的差异。
2 结果与分析
2.1 轮虫碳同化率(AE)

图2 褶皱臂尾轮虫摄食不同密度小球藻后体内14C含量随净化时间变化(平均值±标准偏差(n=5))Fig.2 Retention of ingested 14C in Brachionus plicatilis fed with different densities of Chlorella sp. during the 12 h depuration period (Means ± SD (n=5))
褶皱臂尾轮虫摄食14C标记的小球藻后,轮虫体内的14C在最初的2 h内迅速下降(降至50%—61%),之后慢慢下降趋于平稳。在8—12 h净化期间,轮虫体内的14C含量基本保持不变,表示12 h后,留存在轮虫体内的14C同化为轮虫自身组织的一部分,进入结构碳库。不同饵料密度对应的轮虫AE为34%—51%,不同AE之间差异不显著(P>0.05),呈现随着饵料密度的增加而降低的特点。在整个净化期间,轮虫的碳排放占摄入碳的比例为49%—66%(图2)。
2.2 各形态碳占轮虫碳排放的比例
图3表示不同饵料密度下轮虫净化过程中各形态碳占碳排放的比例和各形态碳总量分别占总碳排放量的比例。在8—12 h净化期间,轮虫排放的各形态碳所占比例基本保持不变。轮虫碳排放以DOC为主,其贡献量占碳排放的37%—51%,当摄食低密度(1×105个/mL)与中密度(5×105个/mL)小球藻时,DOC占总碳排放比例差异不显著(P>0.05),当摄食高密度(1×106个/mL)小球藻时,DOC所占比例显著高于前两组(P<0.05);CO2也是碳排放的主要形式之一,其贡献量占碳排放的15%—40%,当摄食低密度与中密度小球藻时,CO2占总碳排放比例差异不显著(P>0.05),当摄食高密度小球藻时,CO2所占比例显著低于前两组(P<0.05);POC在整个碳排放过程中所占比例较小,为23%—34%,当摄食中密度与高密度小球藻时,POC占总碳排放比例差异不显著(P>0.05),当摄食低密度小球藻时,POC所占比例显著低于前两组(P<0.05)。此外,还对比分析了摄食相同密度小球藻时不同形态碳所占比例之间的差异。当摄食低密度小球藻时,DOC与CO2所占比例差异不显著(P>0.05),而POC所占比例显著低于前两者(P<0.05);摄食中密度小球藻时,三者所占比例差异不显著(P>0.05);摄食高密度小球藻时,三者所占比例差异性显著(P<0.05),尤其是DOC,显著高于CO2与POC(P<0.01)。DOC与POC占碳排放的比例随着饵料密度的增加而增加,CO2占碳排放比例随着饵料密度的增加而减小(图3)。

图3 褶皱臂尾轮虫摄食不同密度小球藻后在净化期间各形态碳占碳排放的比例(平均值±标准偏差(n=5))Fig.3 Relative contribution of different routes of carbon loss from Brachionus plicatilis fed different densities of Chlorella sp. during the 12 h depuration period (Means ± SD (n=5))不同小写字母(a、b、c)代表同一饵料密度下不同形态碳之间差异显著(P<0.05);不同大写字母(A、B、C)代表不同饵料密度下同一形态碳之间差异显著(P<0.05)
图4表示不同饵料密度下轮虫净化过程中COC、LMW占DOC的比例。在不同饵料密度下,轮虫排放的DOC中,COC所占比例为33%—43%,LMW 所占比例为57%—67%,LMW所占比例高于COC。当摄食低密度与中密度小球藻时,COC占DOC比例较大,分别为41%与43%,两者差异性不显著(P>0.05);当摄食高密度小球藻时,COC所占比例(33%)显著低于前两组(P<0.05)。COC占DOC比例随着饵料密度的增加而减小,LMW所占比例则随着饵料密度的增加而增加(图4)。
2.3 褶皱臂尾轮虫摄入碳的分配
本研究假定轮虫摄入的小球藻碳量为100,图5表示净化结束后轮虫摄入小球藻碳的分配情况。结果表明,在不同的饵料密度下,轮虫摄入的碳主要流向两个方向:碳同化和DOC排放。在不同饵料密度下,DOC占碳摄入的18%—34%,随着饵料密度的增加而增加;CO2占碳摄入的10%—20%,当摄食低密度与中密度小球藻时,CO2占碳摄入的值基本一致,当摄食高密度小球藻时,CO2占碳摄入的值则降低至10%;POC占碳摄入的11%—22%,随着饵料密度的增加而增加(图5)。综合分析图3和图5可以得出,褶皱臂尾轮虫摄食的碳主要用于碳同化和DOC排放,其次是CO2,POC所占比例较低。
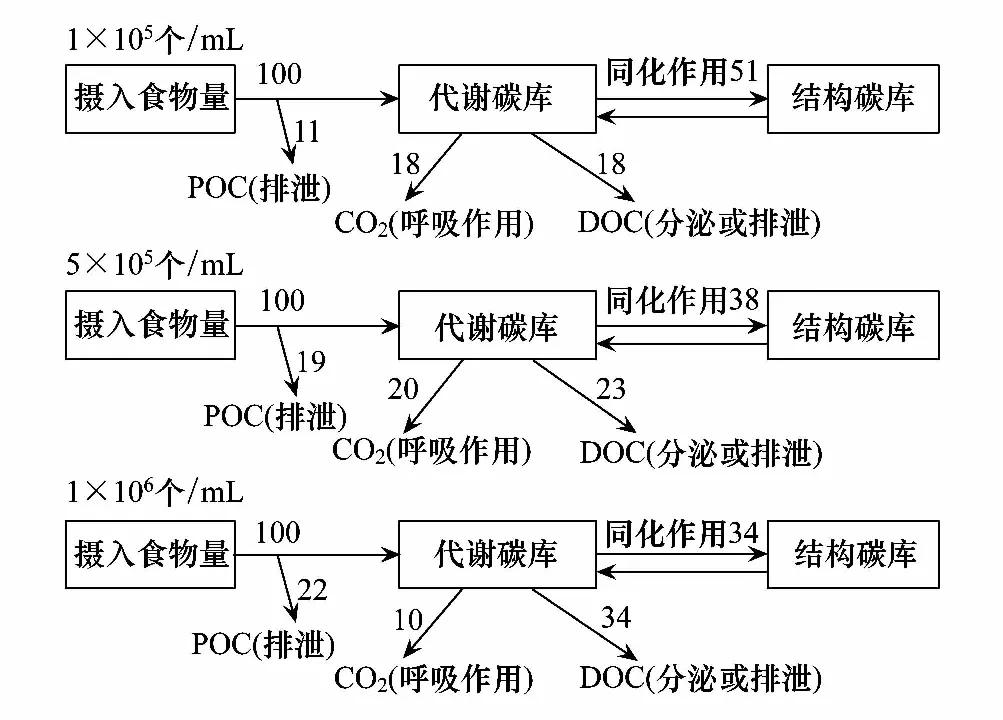
图5 褶皱臂尾轮虫摄食不同密度小球藻碳的分配 Fig.5 The allocation of food carbon into different physiological compartment in Brachionus plicatilis fed with different densities of Chlorella sp.
3 讨论
本文应用14C标记示踪方法,首次定量分析了褶皱臂尾轮虫摄食小球藻的碳同化及碳排放。浮游动物可把相当量的食物碳(18%—34%)转化为DOC,促进细菌生长,参与微食物环的物质循环与能量流动,在海洋碳循环中发挥重要作用。
3.1 浮游动物的碳同化效率
目前浮游动物的碳同化率及碳排放研究主要集中在桡足类,由于尚未有轮虫AE及相关碳排放研究的报道,本文主要与桡足类及枝角类浮游动物进行比较分析(表1)。He和Wang[1]对大型溞Daphniamagna的研究显示,饵料种类与大型溞的大小对AE没有太大的影响,但是饵料密度却影响AE大小。他们发现当衣藻Chlamydomonasreinharditii密度为0.027—0.27 mg C L-1时,大型溞成虫及幼虫AE变化不大;但当衣藻密度增加到2.7 mg C L-1时,大型溞成虫及幼虫AE显著下降,分别下降至38.5%与48%。而Xu和Wang[2]对海洋桡足类刺尾纺锤水蚤Acartiaspinicauda的研究却发现,饵料密度对AE值基本无影响,饵料种类对AE有影响。其中,当圆海链藻Thalassiosirarotula、假微型海链藻Thalassiosirapseudonana及威氏海链藻Thalassiosiraweissflogii密度变化时,桡足类AE变化范围分别为51%—59%、91%—95%及67%—73%,饵料密度对桡足类AE影响不大。而在本研究中,褶皱臂尾轮虫的AE值随着饵料密度的增加而降低,AE大小与饵料密度有关,饵料种类对褶皱臂尾轮虫AE的影响需要作者进一步的深入研究。褶皱臂尾轮虫AE结果虽与大型溞及刺尾纺锤水蚤的AE结果相近[1-2],但是其变化规律却不相同。

表1 不同浮游动物的碳同化率(AE)及各形态碳占碳排放的比例

3.2 DOC为碳排放的主要形式
浮游动物摄食后的碳排放分为3种碳形态: DOC、CO2和POC。由于测量方法的不同,浮游动物碳排放及各形态碳分配比例一直存在较大的争议。常规研究通常通过测定O2的消耗来估算浮游动物呼吸释放的CO2量[12,34],这种方法很难排除细菌等微生物的影响[35],可能高估了浮游动物呼吸作用产生的CO2量。用放射性同位素14C标记浮游动物饵料,直接收集测定浮游动物排放的14CO2、DO14C、PO14C,不仅可以更精确的估算14CO2量,还对浮游动物碳排放的分配产生了新的认识[2,30]。本文中的褶皱臂尾轮虫摄食后的碳排放形态主要以DOC为主,CO2其次,POC较少。He和Wang[1]对枝角类大型溞Daphniamagna的研究也发现,大型溞摄食后碳排放以DOC为主,CO2与POC较少,本文研究结果与其发现一致。浮游动物代谢产生的DOC不仅是微食物环的重要能量来源,对金属的迁移转化也有一定的影响作用。
有研究显示,海洋浮游植物在大多数时间通过光合作用固定的有机碳不足以支持微生物细菌的呼吸消耗,尤其是在寡营养海域,而大多数的微生物细菌只能摄食其他来源DOC来提供能量[36-38]。有研究发现浮游植物每天释放的DOC量,只能满足细菌所需的一半左右[15- 17]。现在有越来越多的研究表明,浮游动物代谢可以产生大量的DOC[1-2,14,18],因此微食物环所需的能量可能不仅仅由浮游植物提供,浮游动物产生的DOC也是细菌的重要能量来源。本研究结果也表明,浮游动物可以把相当量的饵料碳转化为DOC。
浮游动物摄食浮游植物后通过垂直迁移向深海提供有机碳[10,39]。已有大量研究发现,浮游动物垂直迁移不仅增加了海洋中层的有机碳通量,其分泌和排泄产生的DOC是DOC碳库的重要组成部分,在某些海域甚至占到DOC碳库的一半以上[9-10,40-41]。Steinberg 等[10]研究发现,中层浮游生物所需要的有机碳缺口,是由浮游动物垂直迁移将有机碳从上层海洋迁移到中层满足的。Clifford等[40]通过对阿拉斯加湾和大西洋北部调查发现,甲壳类浮游动物(特别是桡足类)通过分泌和排泄等生理活动向海洋贡献了大量的DOC—牛磺酸,大部分牛磺酸为异养细菌提供能量来源。Urban-Rich[9]通过对格陵兰海域桡足类的研究发现,桡足类可以通过排泄(粪球)作用产生大量的DOC,粪球溶解(排泄及POC降解)产生的DOC对DOC碳库贡献高达86%。在格陵兰海中部海域,哲水蚤Calanusspp.在3.52个月长的摄食季节中,粪球释放DOC的平均值(6 g DOC/m2)与新生产力来源的DOC年产量相当。Steinberg 等[41]对马尾藻海浮游动物昼夜垂直移动的研究发现,浮游动物分泌产生的DOC占其代谢碳(DOC和CO2)总量的5%—42%,平均贡献为24%,是水体碳通量的重要组成部分,为深层微生物提供能量来源。Isla等[11]对寡营养盐海域(地中海西北部)浮游动物的研究也发现,在浮游动物垂直迁移过程中,DOC的排放量(3.1 mmol C m-2d-1)已经超过CO2(2.2 mmol C m-2d-1),DOC已经成为浮游动物主要的代谢碳产物。综上所述,本文褶皱臂尾轮虫的研究结果进一步证实,浮游动物产生的DOC(分泌和排泄的DOC以及POC降解生成的DOC)已经成为海洋溶解有机碳的重要组成部分,对海洋碳循环和海洋生物泵过程有重要作用。
此外,对褶皱臂尾轮虫的DOC进行分级测定,发现COC(3 kDa—0.22 μm)占DOC比例约为33%—43%;LMW(<3 kDa)占DOC比例约为57%—67%,LMW量大于COC量。He和Wang[1]曾对枝角类的DOC进行分析研究,发现在不同饵料密度下,COC(5 kDa—0.22 μm)占DOC的比例为21%—38%,LMW量大于COC量;黄文丹[42]对长江口COC(1 kDa—0.45 μm)的研究发现,河口水体中COC占DOC值为32%,LMW所占比例较高。由以上研究可以得出,本文所得结果与室内实验及自然水体中测得结果基本一致。COC与LMW在水体中广泛存在,可以和金属结合影响金属的生物可利用性,但这两种有机碳络合金属的能力及影响金属吸收速率的能力有很大差别。在长江口区域,重金属元素的不同分子量胶体态浓度占胶体态比例存在很大差别,大分子量胶体态(500 kDa—0.45 μm)Fe和Mn占胶体态比例均超过65%,小分子量胶体态(1—5 kDa)Pb和As占胶体态比例均超过50%[42];Wang和Guo[43]通过对比研究发现,浮游植物对胶体(1 kDa —0.22 μm)金属Cd和Cr的吸收速率略高于或者类似于低分子质量组分(<1 kDa)中的金属吸收;Pan和Wang[44]比较了胶体(1 kDa —0.22 μm)结合的Cr和Fe以及低分子质量组分(<1 kDa)中的Cr和Fe被蛤Tapesphilippinarum和翡翠贻贝Pernaviridisde的吸收,发现这两种双壳类对胶体态金属的吸收明显高于小分子结合的金属。因此,大量研究显示,量化胶体态金属与低分子量结合的金属对不同海洋生物的生物可利用性,对海洋生态毒理学的研究有重要意义。而浮游动物来源的COC、LMW与其他来源的COC、LMW对金属的生物可利用有何不同,目前还未有研究报道,需要进一步进行对比分析研究。
4 结论
(1)褶皱臂尾轮虫摄食小球藻后34%—51%的碳被同化;碳排放以DOC为主,其次是CO2,POC所占比例较少。DOC与POC占碳排放的比例随着饵料密度的增加而增加,CO2占碳排放的比例随着饵料密度的增加而减小;
(2)褶皱臂尾轮虫碳同化率与其他已知的浮游动物相仿,并随着饵料密度的增加而减小;
(3)褶皱臂尾轮虫的DOC以LMW为主(57%—67%),COC较少(33%—43%)。COC占DOC比例随着饵料密度的增加而减小,LMW所占比例则随着饵料密度的增加而增加;
(4)浮游动物在其生理活动中也产生大量的DOC,为微生物提供能量,是海洋碳循环的重要组成部分。
致谢:感谢中国科学院南海海洋研究所谭烨辉研究员、宋星宇研究员和徐杰研究员在样品测定过程中给予的帮助。
