建立人α突触核蛋白A30P突变的帕金森病大鼠模型
2018-11-02宋娜王海军李宏彬邵明龙张伟谷腾腾胡庆余建张景航苏蔚赵铁锁李雨姗
宋娜,王海军,李宏彬,邵明龙,张伟,谷腾腾,胡庆,余建,张景航,苏蔚,赵铁锁*,李雨姗*
(1. 新乡医学院基础医学院; 2. 新乡医学院公共卫生学院; 3. 河南省精神病医院,河南省生物精神病学重点实验室,新乡医学院第二附属医院; 4. 新乡医学院第一附属医院;河南新乡 453003)
帕金森病(Parkinson’s disease,PD)是一种慢性、进行性运动障碍疾病,是继阿尔茨海默氏症后第二常见的神经系统退行性疾病。据估计,全球范围内50岁以上的人群每1万人就有570人患有此病,并且该比例随年龄增加而增加[1]。运动迟缓、肌强直、静止性震颤、姿势步态障碍等都是PD的典型特征。此外,PD也会引起非运动特征的改变,严重影响了PD患者的生活质量[2]。临床病理表现为中脑黑质-致密部多巴胺(dopamine,DA)能神经元的进行性丢失,神经元细胞质有路易小体(lewy body,LB)的形成。黑质多巴胺能神经元变性与帕金森病运动功能失调相关,其他外周和中枢神经系统区域参与PD非运动特征的改变[3-5]。
PD患者以散发病例为主,随着家族性PD致病基因α-SYN、UCHL1、LRRK2、Parkin、PINK1和DJ-1等基因的发现,人们认为环境和遗传因素共同作用导致PD的发生[6-8]。α-SYN基因编码突触核蛋白,是第一个被发现与PD发病有关的基因,该基因的A30P、A53T、E46 K以及G51D点突变均与PD的发病相关[9-13]。α-SYN基因突变导致分子结构改变,形成蛋白聚积[14-15]。异常的α-SYN蛋白聚积与Lewy小体的形成,多巴胺能神经元的死亡乃至PD发生有密切的关系,研究人员认为α-SYN聚集是导致散发性PD发生发展的一个中心环节。
α-SYN的A30P和A53T突变是家族遗传性PD发生的主要原因[16-17],而α-SYNA30P突变体可以产生与散发性PD类似的症状,因此研究者们认为α-SYN是把PD的遗传因素和环境因素结合起来的纽带。在本研究中,我们构建了α-SYNA30P慢病毒突变体载体,体外转染293FT细胞,包装并浓缩病毒液。利用立体定位单侧注射技术将过表达α-SYNA30P的病毒注射到大鼠黑质致密部,建立了α-SYNA30P 转基因大鼠模型,通过免疫荧光技术检测发现,在α-SYNA30P过表达的转基因大鼠中,表现出中脑黑质致密部多巴胺神经元大量变性丢失的病理改变,为体外模型的建立及帕金森等神经退行性疾病的研究及治疗奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF级Wistar雌性大鼠,2月龄,体重180~200 g。购于北京维通利华实验动物技术有限公司【SCXK(京)2016-0006】,饲养于新乡医学院第二附属医院【SYXK(豫)2014-0005】。所有操作均符合动物伦理学要求。
1.1.2 实验材料
细胞系293FT、pLKO-GFP质粒、pMD2.G质粒、psPAX2质粒(北京生命科学研究所转基因动物中心馈赠),α-synclein mAb(15G7,ALX-804-258)购于Enzo公司(美国),酪氨酸羟化酶抗体(tyrosine hydroxylase,TH,Ab152)购于Millipore公司(美国),Alexa Fluor 488/555荧光二抗购于Life公司(美国)。
1.2 方法
1.2.1 慢病毒过表达野生型和突变型α-SYN载体的构建和鉴定
(1)pLKO-CMV-α-SYN-WT-P2A-GFP载体构建
以人α-SYN基因 cDNA质粒(Thermo Fisher公司,NM_000345.3)为模版,PCR扩增α-SYN-WT-P2A片段。在上下游引物5’端分别引入HindIII,Xhol酶切位点及P2A片段。通过PCR扩增获得α-SYN-WT-P2A片段,与pcDNA3.1(+) myc-HisB载体连接构建pcDNA3.1(+) myc-HisB-α-SYN-WT-P2A重组载体;以重组载体pcDNA3.1(+) myc-HisB-α-SYN-WT-P2A为模板进行PCR,获得CMV-α-SYN-WT-P2A片段,在上下游引物5’端分别引入SacII,BamHI酶切位点(引物序列见表1)。SacII与BamHI双酶切获得CMV-α-SYN-WT-P2A片段,与pLKO-GFP载体连接,最终获得pLKO-CMV-α-SYN-WT-P2A-GFP基因表达载体。
(2)pLKO-CMV-α-SYN-A30P-P2A-GFP载体构建
以pLKO-CMV-α-SYN-WT-P2A-GFP为模版,在A30P所在的位置进行定点突变(引物序列见表1),将获得的PCR混合物经Dpn1内切酶消化,经转化连接形成pLKO-CMV-α-SYN-A30P-P2A-GFP基因表达载体。
1.2.2 Western blot 检测α-SYN的表达
蛋白样品经15% SDS-PAGE凝胶电泳进行分离、转膜、封闭,加入TBST稀释的大鼠抗人α-SYN抗体,4℃过夜,TBST洗膜三次,加入山羊抗大鼠IgG,室温1 h,ECL发光液显影检测。
1.2.3 慢病毒的包装、浓缩和滴度测定
5×106293FT细胞接种于15 cm的培养皿中。当细胞密度达到80% ~90%时,使用PEI进行转染质粒混合物(慢病毒基因载体质粒、pMD2.G质粒和psPAX2质粒)。转染48 h,吸取上清,并继续加入培养基培养,72 h后吸取上清。吸取的上清用0.45 μm滤膜过滤后浓缩。4℃ 45 000 r/min离心1.5 h,浓缩的病毒液-80℃冻存。将1 μL 浓缩后的病毒加到2 mL的培养基中稀释,分别加10,20,40,100 μL稀释液到细胞培养基中,培养基总体积1 mL。每孔加入终浓度5 μg/mL polybrene,6孔板25℃ 1800 r/min离心1 h进行侵染,72 h流式测定病毒滴度。
1.2.4 大鼠脑立体定位注射慢病毒颗粒
将2月龄,体重约200 g 的Wistar成年大鼠固定于立体定位仪上,异氟烷麻醉。根据文献报道的大鼠脑立体定位图谱确定黑质(substantia nigra,SN)两个注射位点[18],分别注射2 μL慢病毒,按0.2 μL/min的速度推进。
1.2.5 冰冻切片的制备及观察
术后21 d,用10%阿佛丁麻醉剂(1 mL/ 200 g体重)对大鼠腹腔注射进行麻醉。用穿刺针经左心室刺入主动脉灌注0.9%生理盐水冲洗至肝变白,再用4%多聚甲醛固定断头取脑组织。经4%多聚甲醛固定后放入30%的蔗糖溶液中, OCT包埋,冰冻切片厚度为40 μm。切片经甲醇处理后,PBST洗涤3次,微波炉法进行抗原修复,10%驴血清封闭1 h,加入一抗,4℃过夜。PBST洗涤3次,加入荧光二抗,37℃ 1 h,PBST洗涤3次, DAPI染色,激光共聚焦显微镜下观察。
1.2.6 Rotating rod 实验
大鼠分为注射慢病毒稀释液组、α-SYNWT和α-SYNA30P三组,每组4只,雌雄各半。每只大鼠实验前训练5 min,使其能够在转棒仪上停留,随后休息20 min,转速为20 r/min。以180 s作为实验终止时间。每只大鼠测试3次,取平均值。结果进行t检验,P< 0.05表示差异有统计学意义。
2 结果
2.1 人α-SYN基因的慢病毒重组载体的构建
以特异性引物PCR扩增人α-SYN基因片段,经电泳检测可见约506 bp特异性条带(图1A)。按照方法1.2.1进行载体构建,测序结果显示无突变,表明pLKO-CMV-α-SYN-WT-P2A-GFP和pLKO-CMV- α-SYN -A30P-P2A-GFP载体构建成功(图1B)。将载体分别转染293FT细胞,24 h后,Western blot检测人源α-SYN的表达,结果显示293FT-WT和293FT-A30P细胞在18 KD处蛋白表达明显高于对照组,表明构建的野生型和突变型A30P表达载体都能够过表达α-SYN蛋白(图1C)。
2.2 病毒滴度的测定
将1 μL浓缩的病毒颗粒稀释2000倍,从2 mL稀释液中分别取10,20,40,100 μL侵染细胞,根据4个点的数据得到病毒滴度的线性关系y=1.4785x+0.0054(图2A)。之后用1 μL浓缩的病毒颗粒感染293FT细胞后,在荧光显微镜下可观察到较强的绿色荧光,表明病毒可以有效侵染细胞(图2B)。
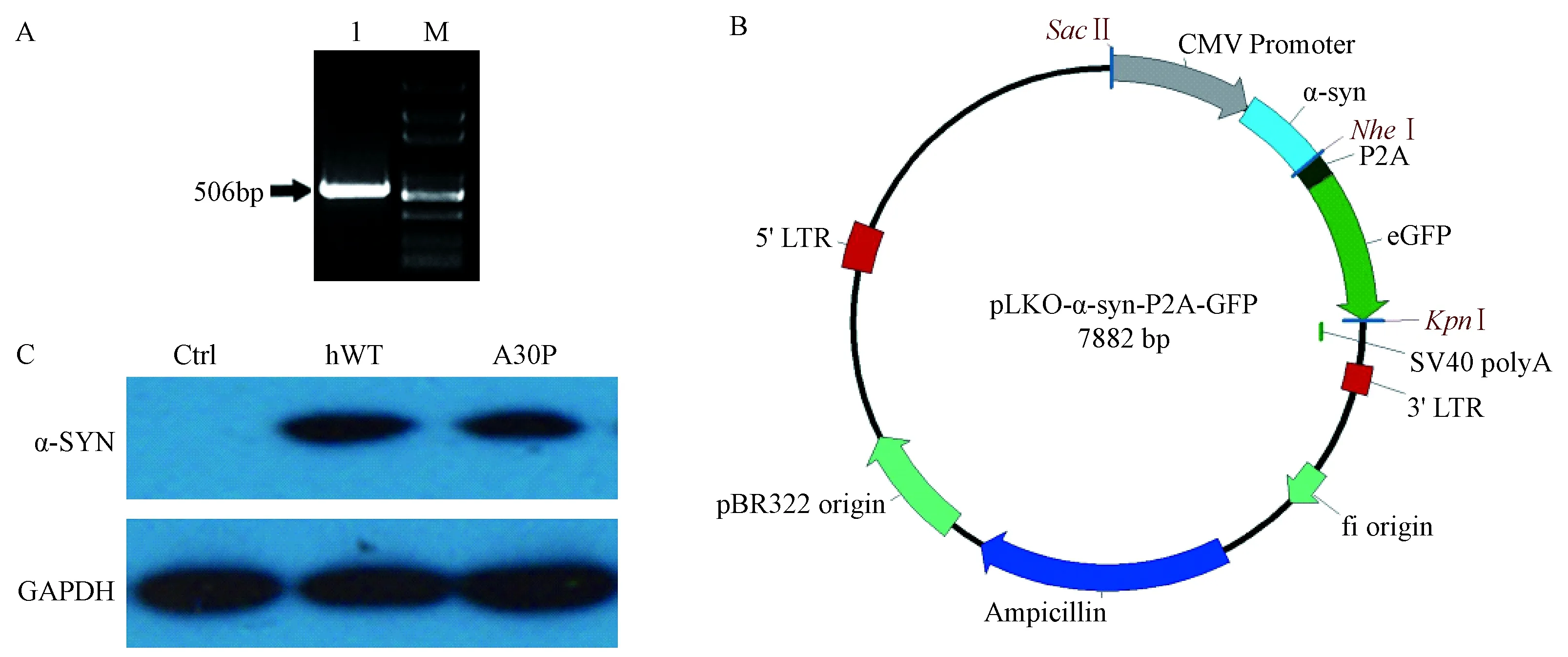
注:A.人α-SYN基因片段的PCR检测。 M,DL2000 DNA marker;泳道1为扩增得到的片段。 B.pLKO-α-SYN-P2A-GFP表达载体的构建 C.免疫印迹检测细胞内α-SYN蛋白的表达。GAPDH为内参,Ctrl:pLKO-GFP空质粒,hWT:人野生型pLKO-α-SYN-WT-P2A-GFP表达载体,A30P:突变型pLKO-α-SYN - A30P -P2A-GFP表达载体。图1 人α-SYN基因慢病毒载体的构建和鉴定Note. A. Amplification of the human α-synuclein determined by PCR. M: DL2000 DNA marker. Lane 1: amplified human α-SYN gene. B. Construction of the pLKO-α-SYN-P2A-GFP vector. C. Expression levels of α-SYN protein in 293FT cells detected by western blot. GAPDH was used as a loading control. hWT, Wild type α-SYN expression vector. A30P, α-SYN-A30P mutation expression vector.Figure 1 Construction and identification of a lentivirus-mediated human α-SYN gene expression vector
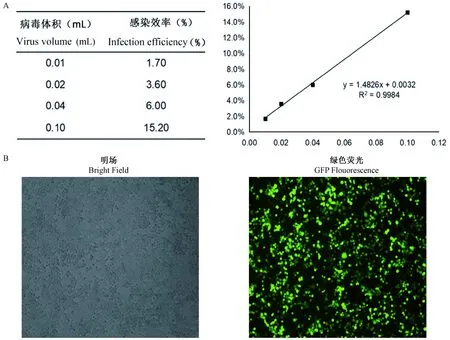
注:A. 病毒滴度曲线;B. 病毒浓缩液感染293FT细胞48 h后荧光检测结果。图2 病毒滴度的测定Note. A. Virus titer curve. B. Fluorescence detection of 293FT cells at 48 h post-infection.Figure 2 Determining the virus titer
2.3 注射过表达慢病毒α-SYN A30P导致中脑黑质酪氨酸羟化酶神经元缺失
取慢病毒α-SYNA30P注射大鼠组织切片,酪氨酸羟化酶免疫荧光检测发现,与对照相比,注射α-SYNWT和α-SYNA30P组的中脑黑质酪氨酸羟化酶阳性信号明显减少,说明多巴胺神经元数量大量减少。另外注射α-SYNWT组与α-SYNA30P组相比,α-SYNA30P慢病毒注射组导致中脑黑质多巴胺神经元数量显著缺失(图3 A)。对注射组α-SYNA30P脑组织切片进行免疫荧光,结果显示注射慢病毒α-SYNA30P的中脑黑质致密部出现α-SYN阳性着色(红色荧光区域),提示α-SYN在此区域的大量聚集,而对应的该区域酪氨酸羟化酶染色几乎呈阴性,表明多巴胺能神经元缺失,可能发生了变性坏死的现象(图3B)。根据该结果,我们可以判定α-SYNA30P突变促进了α-SYN蛋白的聚集和沉积。
2.4 Rotating rod 实验结果
为了进一步证实注射α-SYNA30P慢病毒对大鼠行为的影响,我们选取2月龄大鼠注射慢病毒,三周之后进行rotating rod实验。发现注射慢病毒稀释液组的大鼠没有出现行为改变,在转棒仪上停留平均时间为165 s,而注射hWT和A30P组均出现协调能力下降,在转棒仪上停留的时间均短于注射慢病毒稀释液组,注射hWT组大鼠的停留平均时间为125 s,注射α-SYNA30P组大鼠的停留平均时间为102 s,注射hWT和A30P组较注射慢病毒稀释液组统计结果均为P< 0.05。见图4。
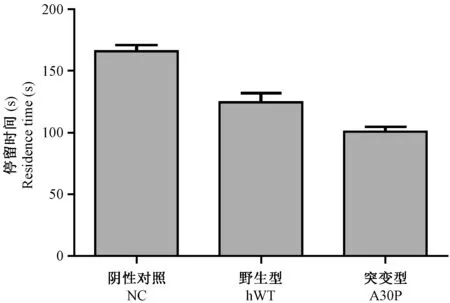
图4 注射过表达慢病毒α-SYN A30P大鼠rotating rod实验结果Figure 4 Rotating rod performance in the lentiviral-mediated α-SYN A30P group
3 讨论
PD是威胁老年人群健康的重要疾病[19],模型的构建是研究该疾病的关键工具。目前PD模型主要有动物和细胞两大类,动物模型作为独立的有机个体,相对于细胞模型能更好的模拟体内PD发病过程,便于直观观测PD的临床病症,利于研究者发现PD新疗法[20-23]。运用转基因技术构建转基因动物是研究PD发病机制的重要途径,慢病毒介导转基因技术以其高效的侵染效率在分子生物领域得到广泛应用[24]。 本研究中,我们利用慢病毒系统构建了过表达野生型α-SYN以及突变型α-SYNA30P载体,并通过立体定位技术对大鼠脑部黑质致密部注射慢病毒颗粒制备α-SYN转基因大鼠。
α-SYN在哺乳动物和人类的脑内含量丰富,主要存在于神经元的突触前末端,在海马、皮质、杏仁和嗅球等突触丰富的区域广泛分布[25]。正常的α-SYN起调节突触囊泡内环境和神经传递的作用,但异常的α-SYN蛋白则聚集成丝状并最终形成小体[14-15]。α-SYN可通过其自身的过表达、突变、分子结构的错误折叠、原纤维及纤维形成参与多巴胺能神经元的损伤过程产生神经毒性作用,同时该基因的改变会激发氧化应激反应,损伤线粒体功能等多个方面影响PD发病[3, 26-34]。
本研究将慢病毒注射大鼠脑部黑质致密部,虽未观察到典型的路易小体形成,但免疫荧光结果显示野生型和突变体两组转基因大鼠中脑黑质致密部神经元大量丢失。与野生型α-SYN注射组相比,注射突变体病毒颗粒导致中脑黑质致密部神经元数量明显减少。过表达α-SYNA30P组织切片的免疫荧光双染结果显示,中脑黑质致密部红色荧光强度高,表明α-SYN在该区域表达量高,在神经元缺失区域内的大量聚集,提示α-SYNA30P突变促进α-SYN蛋白的聚集和沉积。另外在该聚积部位多巴胺合成的限速酶TH几乎不表达,进一步证明黑质神经元在此部位的丢失变性。这些结果提示我们制备的转基因动物较好的模拟了PD病人的重要病理特征。此外,本研究中的rotating rod实验也发现α-SYNA30P大鼠与对照组相比均表现为协调运动能力下降。总之,本研究建立的α-SYNA30P帕金森大鼠可以模拟PD患者的一部分典型运动障碍特征。
α-SYN在家族遗传性和散发性PD中均扮演着重要的角色,构建α-SYN转基因大鼠可以帮助研究人员更好的认识帕金森疾病,明确该疾病的发病机制。我们构建的转基因大鼠可以较好的表现出PD疾病的主要病理特征,为进一步研究帕金森疾病发生发展、靶点药物开发及治疗提供工具。
