硫酸锰溶液制备和净化技术的研究分析
2018-11-02邱花
邱 花
(西安航空职业技术学院,陕西 西安 710089)
0 前 言
硫酸锰是现代工业、农业加工生产中用量非常巨大的化合物,而用于生产、提纯硫酸锰的最基本和主要的原料是软锰矿[1-2],目前主流的通过软锰矿制备硫酸锰的工艺有两类,一种是通过还原、浸出来制备硫酸锰[3-4]。此种方法一般选用煤作为还原剂,浸出液选择硫酸溶液。另一种方法是铵浸法,首先将软锰矿经还原焙烧生成MnO,之后用氨基甲酸铵浸出,[5]。但是,前者使用煤作为还原剂容易造成大量的环境污染且存在能耗高,通过煤和软锰矿进行联合焙烧容易出现转化产物产生偏差,造成实际产量低,残渣较多、难处理,以及长时间的焙烧造成的能源浪费和烟气污染等问题[6]。后者制备方法使用的浸出剂可再生,杂质可以控制,但是成本极高[7-8]。所以,寻找新的加工工艺或对现有工艺进行优化来减少环境污染、提高硫酸锰产量具有重要意义。
本次实验针对上述第1种制备方法,选用了有机物代替煤作为还原剂,在适当的反应条件下将MnO2还原为MnO,中间减少了生成别的杂质造成的原料利用率降低的问题,且有机物是一种清洁的有机还原剂,不会形成大量难以清理的残渣,然后在通过硫酸浸出,制备硫酸锰。本文主要研究了不同的软锰矿与有机还原剂配比、颗粒度和原料厚度等因素对于还原效果和最终硫酸锰的成分的影响,并最终确定制备硫酸锰的最佳工艺参数。
1 硫酸锰溶液制备
1.1 实验材料
本次实验选用的原材料为普通软锰矿石,成分见表1。还原剂选用颗粒度在65~95 μm之间的有机还原物,成分见表2。
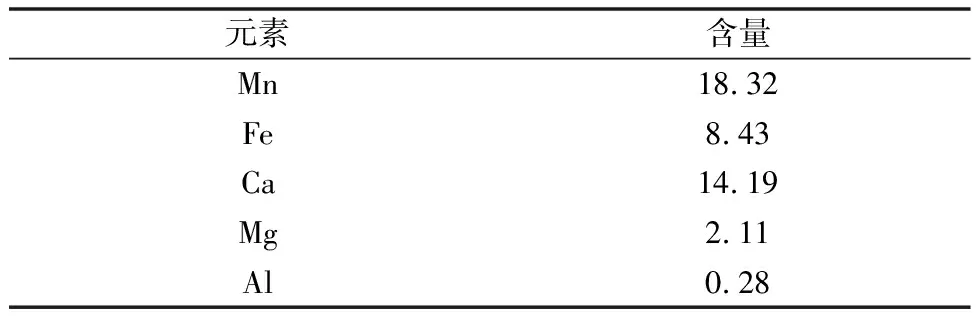
表1 软锰矿石各元素成分(质量分数)/%

表2 还原剂的成分配比(质量分数)/%
1.2 实验方法
首先将原材料进行破碎、球磨至合适的尺寸,本次实验将软锰矿球磨至-120目。随后将软锰矿与上述有机还原剂按不同的配比混合,待还原反应结束后,将产物置于真空箱内冷却,随后用质量分数为30%的硫酸溶液浸泡还原产物,然后对溶液进行提纯、净化最终得到浓缩的MnSO4·H2O。
经过还原反应之后,软锰矿中的MnO2被还原为MnO,在经过硫酸浸泡,软锰矿中的大部分杂质转化为硫酸盐。
本次实验通过控制软锰矿和有机还原剂的配比,软锰矿的粗糙度,还原剂的颗粒度,还有原料的堆垛厚度来研究了不同的加工参数对还原效果的影响。将不同品位的软锰矿与还原剂按照不同的配比混合装入还原反应箱内,进行充分反应,取适量还原产物进行分析,结合已有分析技术,采用过量硫酸在95℃时对还原产物进行浸泡,测量其中Mn2+的浓度来验证还原效果。选择不同颗粒度的还原剂、不同的原料堆垛厚度、选择不同粗糙度的软锰矿,在其余条件不变的条件下重复进行上述实验,分别研究软锰矿和有机还原剂的配比,软锰矿的粗糙度,还原剂的颗粒度,还有原料的堆垛厚度来研究了不同的加工参数对还原效果的影响。
1.3 结果与讨论
1.3.1 配比不同的还原效果
图1为选择不同品类的软锰矿与还原剂按不同比例混合充分反应之后的还原效果对比分析。
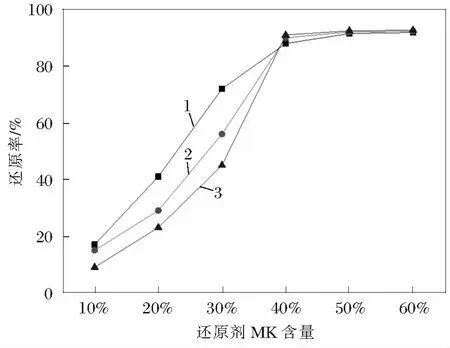
1 软锰矿A; 2 软锰矿B; 3 软锰矿C
由图1可知,3种品类的软锰矿(A含量为18.32%,B含量为25.46%,C含量为31.22%)在不同的还原剂配比条件下,还原效果随着随配料比的增大也不断升高,但是在还原剂含量为40%时,还原效果达到最高值,随后还原剂含量继续增加而还原效果并未提高。同时在添加的还原剂较少时,还原剂对含量较低的软锰矿的还原效果更好,还原剂配比较高时,高品类的软锰矿还原效果更好。实验结果表明,有机还原剂能够有效的起到对软锰矿的还原作用,但是用料较少时会造成还原效果下降的问题。
1.3.2 原料堆垛尺寸对还原效果的影响
将上述A类软锰矿和还原剂按照7∶3的配比混合,高度为30 cm,进行充分反应后测量产物高度为15.2 cm。图2为进行分段取样测量还原效果对比分析。
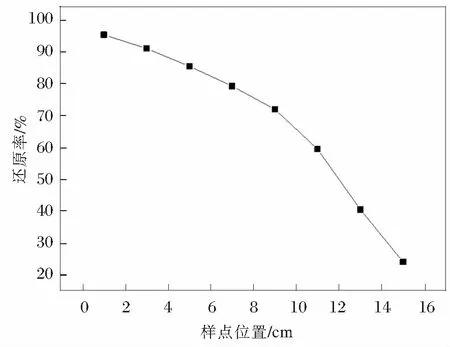
图2 分段取样测量还原效果对比分析
由图2可得,在产物中,随着厚度的降低,还原效果原来越差,还原效果最好的位置在产物的最表层,这可能是由于随着反应的不断进行,还原反应中会不断的生成H2O和CO2,产物表层的气体更加容易扩散出去,随着产物厚度的不断增加,H2O、CO2越来越难以扩散出去,从而限制了还原反应的进一步进行,最底层产物的还原效果非常差,在进行多次实验后发现,在反应过程中对产物进行不断的搅拌可以促进反应的进行,可以显著提高还原剂的还原效果,但是搅拌容易造成粉体飞扬导致原料损失和环境污染。因此需要在反应之初适当的调整原料堆积高度,将厚度控制在12 cm以内,则产物高度就可以控制在5 cm内,还原效果较好。
1.3.3 软锰矿粒度对还原效果的影响
对A品类的软锰矿进行不同程度的球磨实验,随后按照7∶3的配比混合,其余实验参数一致,对还原产物的还原效果进行分析,图3为不同软锰矿的粗糙度对于还原产物的还原效果的对比分析。
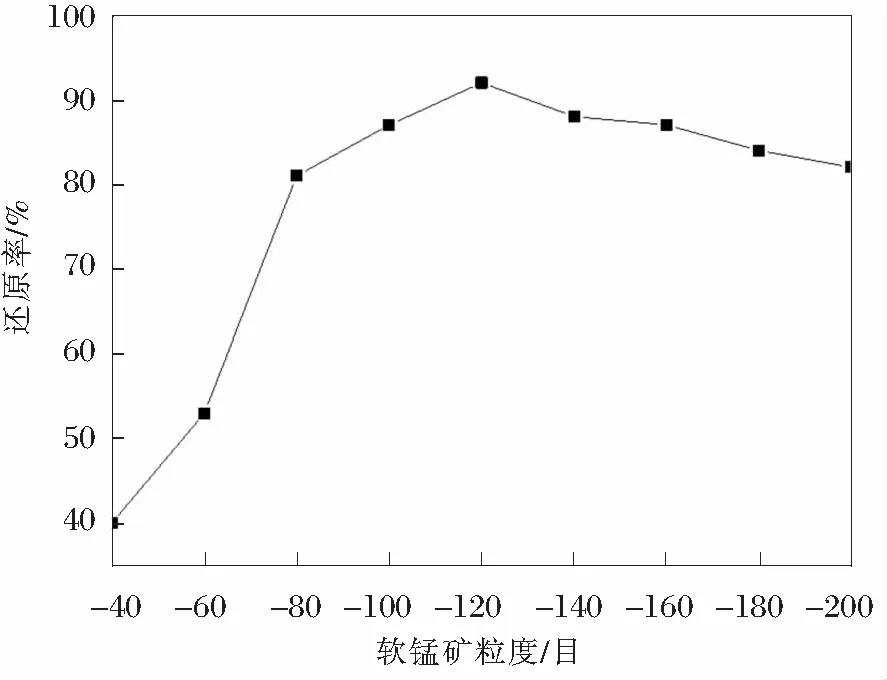
图3 不同的颗粒尺寸的软锰矿的还原效果对比分析
由图3可知,同样的还原剂对于不同的颗粒尺寸的软锰矿的还原效果不同,随着原料颗粒度的减小,还原效果呈先增大后减小的变化趋势。原来的颗粒度在-120目之前,还原效果随着颗粒度的减小而变得越来越好,但是随着颗粒度的继续增大,还原效果开始下降。此类现象的出现是由于,反应时与还原剂的接触面积和反应物之间的间隙都是影响反应效果的重要因素,当原料颗粒度较大时,接触面积在影响中占据主要位置,随着颗粒度的减小,软锰矿与还原剂接触的表面积增大,提高了反应速率,所以还原效果逐渐升高,但是随着颗粒度的继续变小,反应物间的间隙成为了决定反应速率的决定因素,颗粒度的变小,导致反应物间的间隙减小,导致了反应速率的下降,最终出现了还原效果下降的情况。
1.3.4 还原剂的颗粒度对还原效果的影响
选取不同颗粒度的还原剂,按照7∶3的配比混合,其余实验参数一致,对还原产物的还原效果进行分析,图4为颗粒度不同的还原剂对于还原产物的还原效果的对比分析。
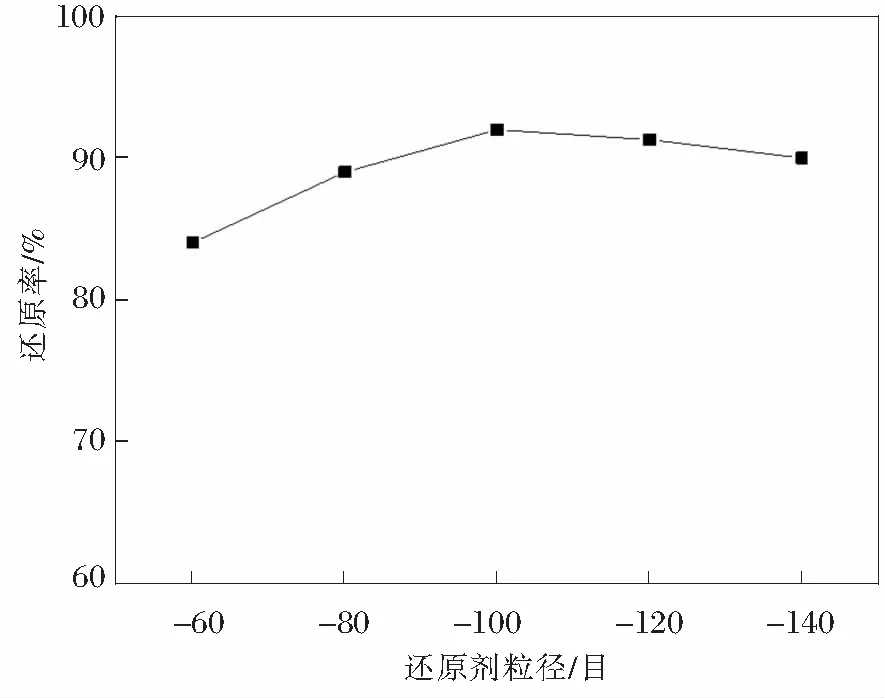
图4 颗粒度不同的还原剂对于还原产物的还原效果的对比
由图4可知,还原剂颗粒度对还原效果的影响不是非常的明显,颗粒度的大幅度改变并未对还原效果起到太大的影响,但是仍可以得出的是选用-100目的还原剂能够获得最好的还原效果。
2 硫酸锰浸出液的净化
2.1 浸出液成分
软锰矿中经常除了含有大量的Mn元素外,还伴随有大量的Mg、Fe、Al元素和Pb、Ni、Co、Cu等重金属元素的存在,通过上述步骤处理后得到的浸出液中具体的含量见表3。
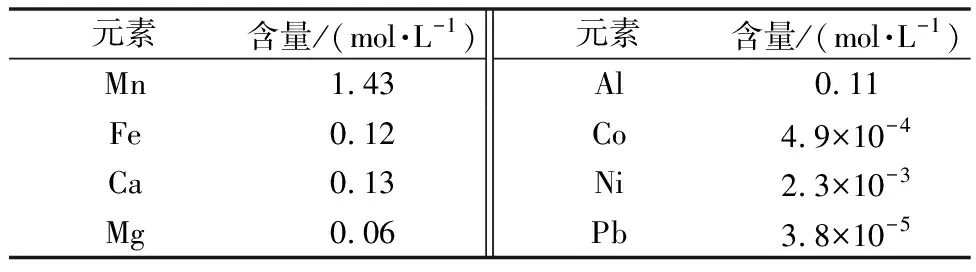
表3 浸出液的成分
由表3数据分析可知,经过上述的操作处理后虽然浸出液中Mn元素的含量较高,但是溶液中含有大量的杂质元素,所以需要经过一系列的提纯、净化操作去除杂质,设计了如下的净化流程,保证最后得到的浓缩的MnSO4·H2O的质量。
2.2 净化流程
具体的提纯、净化工艺如下:
2.2.1 溶液中Fe、Al元素的分离
通过各离子之间不同的溶度积可以实现对于Fe、Al等元素的分离,具体的Mn2+、Fe3+、Al3+的常温溶度积分别为1.9×10-13,4.0×10-38和1.3×10-33。由于Mn(OH)2的溶度积比Fe(OH)3和Al(OH)3的大,也就是说在Fe(OH)3和Al(OH)3更加比Mn(OH)2容易析出,当溶液的pH>6.0时,Mn(OH)3能够完全沉淀,而Fe(OH)3和Al(OH)3能够完全沉淀的溶液临界pH值分别为3.2和5.0,也就是说可以通过控制浸出液的pH值来实现对于Fe、Al元素的分离[9]。试验采取加NH3·H2O调节浸出液的pH达到5.2,可将Fe3+、Al3+去除。也可以在去除Fe3+后的溶液中,用石灰水调节pH至6.0~6.5,用聚丙烯酰胺做絮凝剂净置后过滤可除去Al。
2.2.2 溶液中残余重金属元素的分离
将经过步骤2.2.1处理后的软锰矿放入硫酸溶液中,硫酸可以与软锰矿中含有的Pb、Ni、Co、Cu等重金属元素发生反应,生产硫酸盐,达到去除软锰矿中的重金属元素。选取(NH4)2S作为提纯实验的沉淀剂,这是因为与其他重金属形成的硫化物相比,MnS的溶度积较大,为2.5×10-13。
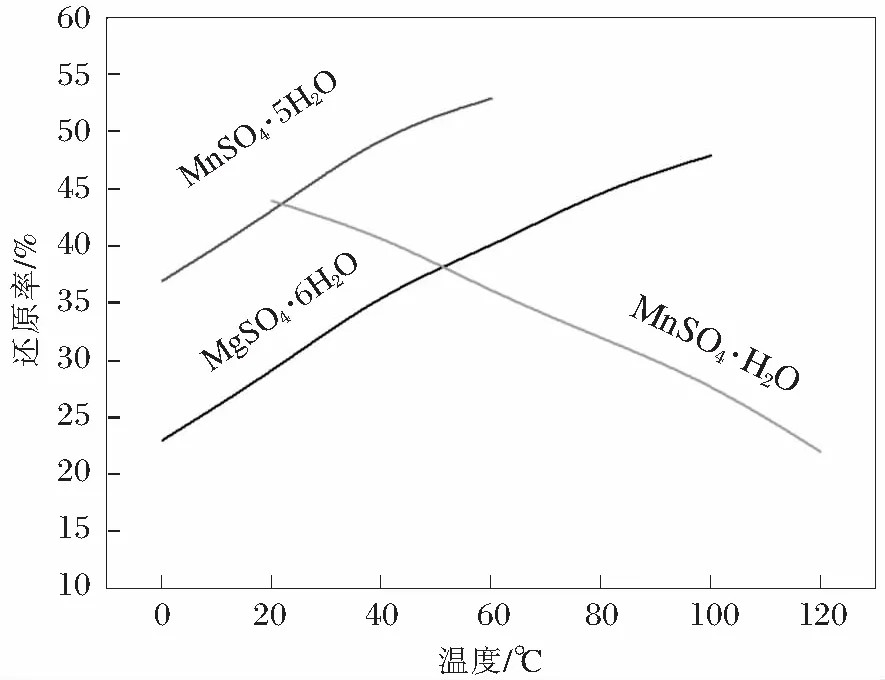
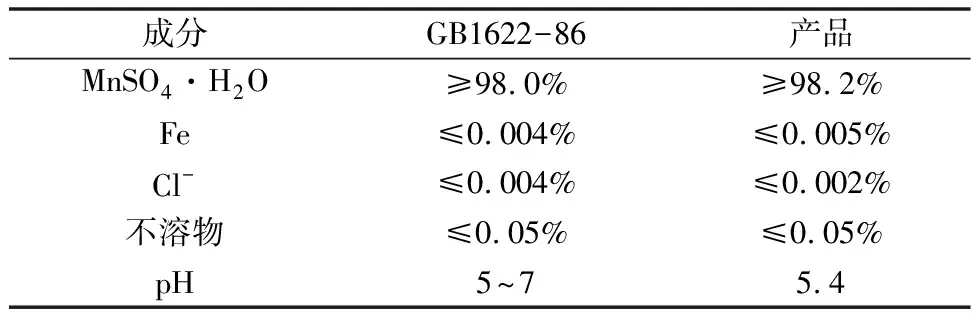
但是需要严格控制溶液的pH值和S2-的浓度,这是因为硫化物是一种呈弱酸性的盐,如果溶液的pH<2.0时,一部分的重金属离子不能形成硫化物析出,如Co2+、Ni2+,如果溶液的pH>6.3时,溶液中的Mn2+也会以MnS的形态析出,造成溶液中Mn2+浓度的下降,导致最终提纯产率降低。根据上述的MnS溶度积可求得:pH=lg[H+]=6.3,所以能够在确保Mn2+浓度不变的基础上实现溶液中重金属离子的去除的合适的pH范围为4 同时,向溶液中添加的硫化剂的量的多少也会在很大程度上影响溶液提纯的结果。如果加入的硫化剂太多,则会在将溶液内所有重金属离子去除完毕之后富余一部分的S2-,在溶液中又加入了新的杂质元素;如果硫化剂加入的量太少,则重金属离子去除不完全。经研究表明每提纯1 kg的软锰矿粉需加入3.4 g的(NH4)2S。 2.2.3 溶液中残余Ca2+、Mg2+的去除 在所有的提纯过程中,Ca2+、Mg2+的去除是决定溶液提纯能否成功的最重要的环节,这是由于CaSO4呈胶体状常规的提纯流程对其效用一般,MgSO4则是由于其自身溶解度非常大,并且其发生水解的pH值要求较高,一般不易达到[10]。为此查阅了日本的浓缩静置提纯方法来达到对于Ca2+、Mg2+的去除。通过浓缩静置,溶液中残余的Ca2+、Mg2+逐渐沉淀析出,Ca2+、Mg2+经过浓缩静置处理后的变化情况如表4所示。 表4 Ca2+、Mg2+在浓缩静置前后的浓度变化 静置1 000 min,温度为室温。 由表4可知,通过采用浓缩静置提纯方法可以在很大程度上达到对Ca2+的去除,但是溶液中仍然残余了一部分的Mg2+,提纯方法仍需改进。 2.2.4 溶液中Mg2+的进一步去除和结晶 经过步骤2.2.3后,可知道溶液中主要为MnSO4和杂质MgSO4,为了实现对于MnSO4和MgSO4的分离,结合MgSO4与MnSO4的溶解度的不同,选用结晶法来进行分离操作。MgSO4与MnSO4的溶解度的曲线如图5所示。由图可得,MgSO4的溶解度随着温度的升高逐渐增大,MnSO4的溶解度则随着温度的升高先增大而后又开始减小,50℃时其溶解度最大。因此升高溶液的温度可以实现对于MgSO4与MnSO4的分离,经实验研究发现,温度为100℃为最佳分离温度,浸出时间为80 min。 图5 MgSO4与MnSO4溶解度曲线 对溶液进行上述步骤处理后,可以得到浓缩的MnSO4·H2O,对其含量进行分析,结果如表5所示。由表中数据,参照国家标准可以发现,本次提纯结晶出的浓缩MnSO4·H2O符合国家GB1622-86标准。 表5 产品质量分析 采用有机还原软锰矿,在通过硫酸浸泡制备硫酸锰,该工艺能耗低、污染小且产量大,可以有效的替代原有的煤还原技术,在低品位的软锰矿开发利用方面非常具有推广意义。其实际的还原效果受到还原剂的用量、颗粒度和原料厚度等方面的因素的影响,经研究发现最佳的还原条件为:矿料颗粒度为-120目,还原颗粒为-100目;原料厚度为12 cm;用量配比:软锰矿的品位为18.32%时,还原剂的具体配比为0.4,软锰矿的品位为25.46%和31.22%时,还原剂的具体配比为0.5。通过有机还原剂处理后的浸出液通过净化精制,制成的MnSO4·H2O可达到国家标准。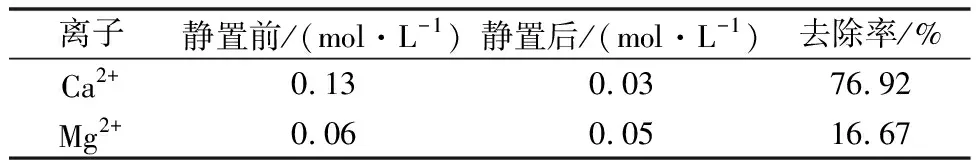
2.3 净化成品分析
3 结 语
