斑马鱼mcm5基因的表达分析及在体节发生中的功能
2018-11-02吴永梅黄四洲
张 雨,吴永梅,刘 敏,黄四洲*
(1.成都医学院基础医学院,成都 610500; 2.成都医学院基础医学院人体解剖与组织胚胎学教研室;四川省发育与再生四川省重点实验室,成都 610500)
在胚胎发育中受精卵从单细胞到完整生命体,经过了一个极其复杂而漫长的发育过程。在此过程中细胞进行细胞分裂的同时也在发生命运决定,细胞分裂和细胞分化各自相互独立却又互为偶联[1]。Gem最早是在非洲爪蟾中被发现参与细胞周期中DNA复制调控[2],随后被发现分别参与了神经[3-4]、眼睛[5]、血液[6]、癌症等发生的调控,并被证明在调控细胞周期和细胞分化中起到了不可取代的作用[1,7],这充分表明细胞周期因子不仅参与了细胞周期的精细调控,同时也作为一重要调控因子参与了胚胎发育的细胞命运决定过程。MCM5是DNA复制起始复合体中MCM2-7复合小体的重要因子,在几乎所有真核生物细胞中都存在[8-9],对DNA复制的起始和延伸起着重要的作用。MCM5在细胞中的数量极为丰富,其数量也远远超过了任何情况下起始DNA复制所必须[10],这便暗示了MCM5可能拥有Gem相似的功能,参与到了细胞命运分化决定的过程中。部分报道表明MCM5参与了细胞命运的决定和组织器官的发育[7,11-12],但这些都与细胞周期的停止和细胞凋亡相关[11],而鲜有MCM5作为调控因子直接参与了胚胎各组织器官发育的特异性调控。
近年来,MCM5在部分研究中已被证实参与了基因转录调控,暗示MCM5可能会作为转录调控因子直接参与胚胎各组织器官的发育调控。运用染色质免疫共沉实验分析复制起始位点与MCM5复合体数量关系时,发现在复制起始位点以外的地方存在许多MCM5结合的染色质位点[13]。这些位点可能与MCM5结合,调控特定基因的转录。在果蝇S2细胞中将MCM5量降低95%后,正常生存环境下S2细胞DNA复制和细胞周期进程仍不受影响[14],这更提示MCM5可能还参与到基因转录调控中。另外,在大鼠成纤维细胞[15]及免疫细胞[16]中发现MCM5直接或间接参与基因转录调控;在细胞缺氧情况下MCM5与其他MCM家族成员形成转录抑制复合体,直接与HIF1结合而抑制HIF1的转录活性[17]。以上信息表明MCM5的确参与了基因转录调控,同时也暗示了在胚胎发育中MCM5可能通过特定基因的转录调控参与了组织器官的发育调控。MCM5少有被报道参与胚胎发育组织器官的发育调控,部分缘于在哺乳动物中重要细胞周期因子MCM5突变将导致胚胎在囊胚期死亡[18]。在斑马鱼中可以成功的将目的基因进行敲降并在体外实时观察胚胎发育的情况,这为本课题组研究MCM5在胚胎发育中的功能提供了便利。
体节是沿胚胎前后轴空间顺序形成一定数目的重复性结构,是轴旁中胚层(presomite mesoderm)细胞通过边缘间充质细胞角质化(MET)以后形成的细胞团[19],他们最后将形成骨骼、肌肉等组织。体节发生在不同模式动物中其分子调控机制存在一定的差异,但从形态发生上看,各个模式动物具有较高的共性。首先是轴旁中胚层的形成,然后沿体轴从前到后轴旁中胚层细胞以次周期性的形成体节,同时伴随前后轴后端按照一定的速度向后生长延伸,以使新的PSM产生[19]。从机制上看分析,调控体节发生的细胞及分子调控机制在不同物种中存在高度的保守性:Notch及Wnt信号通路决定了体节发生的周期性及体节极性;而Fgf信号通路决定了体节发生的大小[20]。三者在胚胎发育早期共同调控了体节的正常发生。
本研究课题组运用原位杂交及MO敲降技术,发现MCM5参与了体节发生的调控。
1 材料和方法
1.1 实验动物
野生型斑马鱼为AB品系。按照3R原则及动物喂养及使用伦理要求,斑马鱼在标准养殖条件下维持和喂养(28℃;pH=7.2)。
1.2 主要试剂
PCR purification Kit(D6492-01,Qiagen);Reverse Transcription(#K1622,Thermo);mMESSAGE mMACHINE(AM1340, Ambion);Morpholino购自Gene Tools公司(mcm5MO:5-ATAGTTTCGATAAGT GCTGTCGATG-3;p53MO:5-GCGCCATTGCTTTGCAA GAATTG-3);T4连接酶购自Invitrogen公司;Q5高保真酶、限制性内切酶购自NEB公司;原位杂交相关的试剂主要购自Roche公司。
1.3 实验方法
1.3.1 胚胎注射
mcm5MO细胞注射:将MO从-80℃冰箱拿出后室温下融化,放入65℃恒温加热5 min让沉淀溶解,离心。吸取上清MO将其稀释成工作浓度(300 umol/L),在胚胎1~4细胞时期进行胚胎注射。
EGFPmRNA注射:将制备好的mRNA分装,取出部分用RNase free水稀释为30 ng/uL备用。胚胎在1~4细胞期注射注射卵黄。
1.3.2 整胚原位杂交
胚胎成长至所需时期,4%PFA固定24 h后剥膜过度到无水甲醇中脱水,于-20℃保存待用。原位杂交按照已报道方法进行[7]。

注:A-C:在10hpf(hours post fertilization)前mcm5广泛表达于胚胎中所有细胞;D-F:在体节发生期,mcm5在头部、尾牙、新生体节等处高表达;G:在第4天部分表达也与胸腺细胞特异重合(箭头)。
1.3.3EGFPmRNA的合成及原位杂交RNA探针的合成
限制性内切酶将质粒DNA线性化,酶切过夜,用DNA快速纯化回收试剂盒回收线性化DNA模板,用mMessagemMachine试剂盒体外转录合成mRNA;然后利用酚氯仿抽提回收mRNA,异丙醇沉淀。测定mRNA的浓度,分装并放置于-80℃保存待用。
使用DIG RNA Labeling Kit(SP6/T7)试剂盒体外转录合成地高辛标记的原位杂交RNA探针,然后通过RNA纯化试剂盒纯化回收,检测浓度并-20℃保存待用。
2 结果
2.1 mcm5在斑马鱼胚胎发育早期的表达模式
在研究mcm5在胚胎发育中的具体作用前,首先运用原位杂交方法检测其在早期胚胎中的表达模式。研究发现mcm5是母源性表达因子,在胚胎发育2细胞及128细胞时呈高表达(图1A,B),在原肠运动及以前在胚胎中呈广泛性表达(图1A-C)。从体节发生早期开始表达出现特异性,从10体节开始mcm5在头部、尾牙、侧板中胚层及新生体节(箭头)处等高表达(图1D-F)。在第4天,mcm5被发现在胸腺等处集中表达(图1G,箭头所指)。以上数据表明mcm5在胚胎发育早期可能参与了体节发生的调控。

注:A:图中所示为mcm5 CDs区域5′ 端部分非翻译序列及MO设计序列。B-C:mcm5MO功能验证。在EGFP序列上游添加一段与mcm5MO互为匹配的核酸序列,将整个序列克隆到pCS2+载体中(B)并制备EGFP mRNA。EGFP mRNA单独注射EGFP. C:mRNA与mcm5MO共注射实验显示mcm5MO能很好的抑制EGFP mRNA的翻译。
2.2 mcm5 MO的设计及功能验证
为研究mcm5在斑马鱼胚胎发育中的作用,本课题组合成mcm5MO以特异的阻断胚胎内源性mcm5 mRNA的翻译(图2A)。同时为了研究mcm5MO是否工作,本课题组构建了体外转录EGFPmRNA的载体(图2B)。在该载体中于EGFP编码区的上游添加了与mcm5MO完全匹配的DNA序列,这样设计并体外转录所获得的EGFPmRNA可以很好的与mcm5MO结合(图2B)。理论上如果mcm5MO工作良好将会有效的抑制EGFP的翻译,进而间接表明mcm5MO在体内能很好的抑制内源性mcm5 mRNA的翻译。结果表明,当单独注射EGFPmRNA时,在胚胎发育到第36小时仍然有较高量EGFP存在;而在共注射mcm5MO和EGFPmRNA的胚胎中,EGFP的量明显降低(图2C)。同时本课题组也发现,mcm5敲降的胚胎外观上无明显表型(图2C)。以上实验间接表明体外合成的mcm5MO能较好的抑制内源性mcm5mNA的翻译。
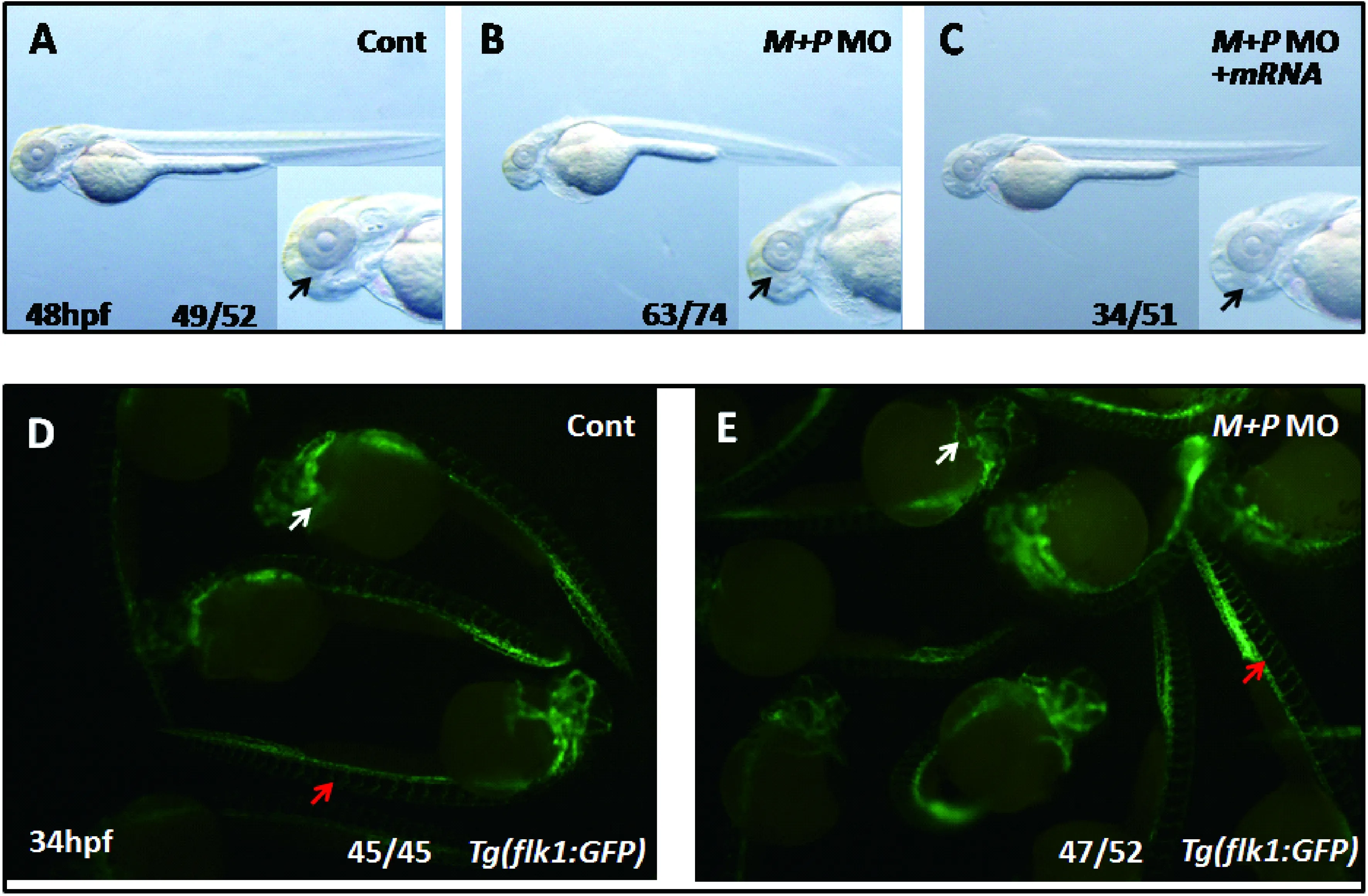
注:A-C:mcm5调控了眼睛及体长的发育。与对照组相比,在注射mcm5MO后胚胎体轴变短(B),眼睛变小(C,箭头所示)。注射mcm5 mRNA回了mcm5MO注射所导致的表型(C)。D-E:mcm5MO注射并未导致心脏和血管发育的缺陷(红色箭头为血管;白色箭头为心脏)。

注:A:与对照组胚胎相比,mcm5和p53功能敲降的胚胎体轴变短,眼睛变小。B-E:体节发生相关基因表达变化。Notch信号通路配体deltaD表达降低(B),振荡基因deltaC和her1表达降低(C,D),体节极性基因mespb从两条变成一条(E)。
2.3 mcm5参与了体节发生的调控
由于MCM5是DNA复制重要调控因子,MCM5功能敲降可能会导致细胞凋亡发生,从而影响MCM5功能敲降后表型的观察。为研究MCM5功能敲降后胚胎特异性表型,本课题组在胚胎中共注射mcm5 MO及p53MO以敲降MCM5的功能,然后分析胚胎表型。结果发现,在胚胎共注射p53MO及mcm5MO后后,胚胎体轴变短且眼睛变小(图3AB),但胚胎无明显外观上的差异(图3A)。进一步分析mcm5是否参与了心脏、血管等的发育调控。结果表明在mcm5功能敲降后心脏和血管的发育无明显缺陷(图3D-E)。为验证mcm5MO功能敲降的特异性,分析是否mcm5 mRNA可以回救mcm5 MO注射所导致的眼睛变小、体轴变短的外观缺陷。结果显示mcm5 mRNA能较好的回救mcm5 MO注射所致的胚胎变短、眼睛变小的表型(图3C),表明mcm5 MO的特异性作用。
由于mcm5 mRNA在体节发生时于轴旁中胚层及新生体节中高表达(图1),暗示mcm5可能参与了体节发生的调控。活体胚观察表明在mcm5功能敲降及对照组胚胎之间,体节形成无明显的形态学差异(图4A)。为进一步研究mcm5是否参与了体节发生,在MCM5功能敲降的胚胎发育到10体节左右本课题组运用原位杂交的方法分别检查体节发生相关基因的表达(图3B-E)。与对照组相比,Notch 信号通路配体deltaD,deltaC表达明显降低(图4B-C),并且在已经形成的体节中,deltaC的表达也明显降低(图4C 虚线半括号所示),表明MCM5可能通过Notch信号通路参与体节发生。为进一步确认mcm5在体节发生中的作用,在mcm5功能敲降后分析振荡基因her1及体节极性基因mespb的表达。与对照组相比,虽然her1的表达降低,但其振荡表达模式并没受到影响(图4D);但极性基因mespb表达明显降低,表达模式改变(图4E)。以上数据表明MCM5功能降低导致了Notch信号活性降低及体节极性缺陷。
3 讨论
MCM5是DNA复制所必须的细胞周期因子,除调控细胞周期外,MCM5被发现在多种肿瘤中高表达,且被作为癌症发生的标记基因。但是MCM5在胚胎发育中的作用鲜有报道。本研究通过研究mcm5在斑马鱼中的表达模式,发现在发育早期mcm5于尾牙、轴旁中胚层及新生体节中表达,推测其可能参与了体节发生的调控。进一步研究发现,在MCM5功能降低后虽然体节外观上无明显缺陷,但是体节标记性基因deltaD等表达受阻,且体节极性基因mespb从野生型中的2条变为1条,表明MCM5参与了体节发生的调控。
Notch信号通路是体节发生的重要调控因子,众多Notch信号通路分子突变直接导致了体节震荡基因deltaC、her1等的震荡表达模式紊乱,同时使得体节发生缺陷。在MCM5功能降低时,本课题组虽然发现Notch信号通路deltaD表达降低,但是并未发现震荡基因的震荡表达模式变化,这暗示在体节发生过程中,震荡基因的震荡表达模式不仅仅受Notch信号通路调控,同时也说明Notch信号通路活性要降低到一定程度才可使得震荡基因的震荡表达模式受损。虽然MCM5功能降低后震荡基因震荡表达模式没受影响,但体节极性基因mespb表达模式变化,说明mcm5以一种较为复杂的方式调控了体节的发生。在体节发生中mcm5以何种方式调控了Notch信号通路活性及体节极性,有待进一步研究。
本课题组以往研究表明在原肠运动时mcm5调控了中内胚层细胞间的剥离[7],本研究又揭示了mcm5在体节发生中的作用,但mcm5在胚胎早期发生中的功能研究还远未结束。从前言分析中可知MCM5在细胞中的表达量远大于细胞周期中DNA复制所必须,作为转录调控因子的作用也被证明。本研究原位杂交实验显示mcm5 mRNA在尾牙、头部等其他组织也搞表达,进一步说明mcm5可能还通过特定的方式参与了发育过程的其他活动。因此mcm5在体节发生及其他组织器官发育中的作用及机制有待进一步研究。
