肺孢子菌肺炎的致病因子纤维连接蛋白作为蛇毒胶原蛋白酶作用位点的预测
2018-11-02,,,2,,2,,2
, , ,2, ,2, ,2
重庆市科委项目(No.2015jcyA10017)和重庆市教委(No.KJ1400210)联合资助
肺孢子菌肺炎[1],又称卡氏肺孢子虫肺炎,卡氏肺囊虫肺炎,是由肺孢子菌引起的间质性浆细胞性肺炎,为条件性肺部感染性疾病。本病20世纪50年代前仅见于早产儿,营养不良婴儿,近10年来随着免疫抑制剂的应用,肿瘤化疗的普及尤其是HIV感染的出现,发病率明显上升,已成为HIV感染患者最常见的机会感染与致死的主要病因。肺孢子菌[2]主要定位在肺泡内,主要通过纤维连接蛋白等黏着蛋白被固着在肺泡巨噬细胞上。此外,菌体的一些抗原成分如主要表面糖蛋白(Major surface glycoprotein,MSG)[3]和P55同时激发宿主产生细胞免疫和体液免疫反应,产生包括α-肿瘤坏死因子、白细胞介素-2、调理素和特异性抗体等一系列细胞和体液因子,使菌体迅速被活化的巨噬细胞吞噬杀灭。但是在免疫功能缺陷的宿主体内,菌体却能逃脱巨噬细胞的吞噬而不断繁殖并充满肺泡腔。如果能够通过破坏纤维连接蛋白从而阻断菌体侵入肺泡的桥梁,就可以为PCP的治疗提供新的研究方向。蛇毒[4],其组成的蛋白质中几乎半数以上是具有各种催化活性的酶类,这些酶无论在生物化学研究上,还是在临床应用实践中,都有其重要意义[5]。如果证明纤维连接蛋白结构具有不稳定性,就可以预测纤维连接蛋白很容易被破坏,然后探索纤维连接蛋白和胶原蛋白的空间结构的相似性,就可以利用蛇毒中的胶原蛋白酶[6]来破坏纤维连接蛋白,从而阻断纤维连接蛋白与肺孢子菌MSG(主要表面糖蛋白,Major surface glycoprotein)的结合,阻止肺孢子菌侵入肺泡。
1 材料与方法
1.1 蛋白质序列的获取与分析
1.1.1从GenBankTM(ftp://ncbi.nlm.nih.gov/genbank)中获得蛋白质序列
1.1.2用NCBI中的BLAST软件进行蛋白质的序列比对
1.2 蛋白质的理化特性及结构分析
1.2.1用ProtParam(http://us.expasy.org/tools/protparam.html)预测纤维连接蛋白及胶原蛋白的分子量、等电点、氨基酸组成、稳定指数等一系列理化特性
1.2.2用ProtScale(http://www.expasy.org/cgi-bin/protscale.pl)预测纤维连接蛋白的亲水性/疏水性
1.2.3用BioEdit(http://www.mbio.ncsu.edu/BioEdit/BioEdit.html)分析纤维连接蛋白的亲水性/疏水性
1.2.4用TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)预测纤维连接蛋白的跨膜结构域
1.2.5用SignalP(http://www.cbs.dtu.dk/services/SignalP/)对纤维连接蛋白进行信号肽的预测
1.2.6用TargetP(http://www.cbs.dtu.dk/services/TargetP/)预测纤维连接蛋白的亚细胞定位
1.3 蛋白质的高级结构分析
1.3.1为准确预测纤维连接蛋白和胶原蛋白的高级结构,利用 SWISS-MODEL(http://www.expasy.ch/swissmod/SWISS-MODEL.html/)和Verify3D,通过同源建模法对纤维连接蛋白和胶原蛋白进行预测,然后通过Verify3D进行质量评估
1.3.2采用expasy系统中的SMART软件预测纤维连接蛋白和胶原蛋白的保守结构域。
2 结 果
2.1纤维连接蛋白的序列查找结果 根据发现纤维结合素的文章所提供的提交在NCBI上的纤维连接蛋白序列号P02751从NCBI上调出该蛋白质的序列,包含2 386个氨基酸。
2.2P02751蛋白的理化性质分析 利用ProtParam工具分析P02751蛋白的理化性质分析得知,P02751的蛋白分子量约为259 kDa,理论等电点PI为5.39,总共包括35 841个原子,分子式为C11351H17590N3169O3644S88。在组成P02751蛋白的20种氨基酸中,苏氨酸所占的比例最高,达到10.8%,而甲硫氨酸所占的比例最低,为1.1%。P02751蛋白的不稳定指数为40.56,脂肪指数为66.02。根据Guruprasad方法表明P02751蛋白不稳定。
2.3P02751蛋白的疏水区 通过访问ExPAsy服务器,计算基于K-D法的蛋白质疏水性,结果得知P02751蛋白有疏水区(图1)。
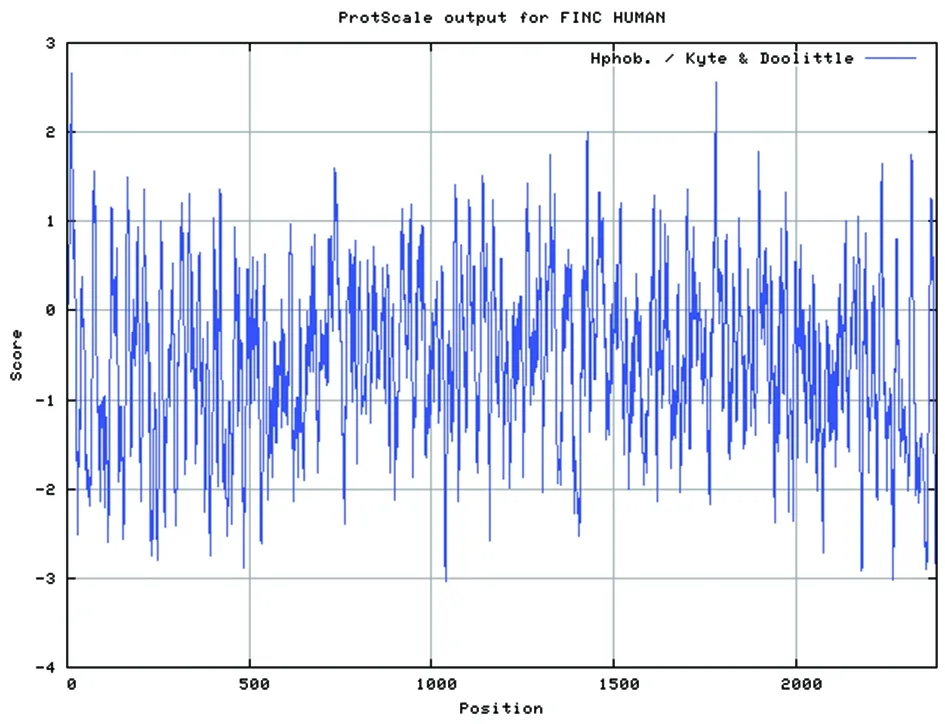
图1 ProtScale程序分析P02751蛋白的疏水性Fig.1 Analysis on the hydrophobicity of P02751 protein by ProtScale program
2.4P02751 蛋白的疏水性分析 使用生物信息学软件BioEdit分析蛋白质的疏水性,结果表明P02751蛋白在0-50位氨基酸之间有一个疏水区,在2200-2300位氨基酸之间有一个亲水区,与ProtScale程序分析结果一致(图2)。

图2 利用BioEdit软件分析P02751蛋白的疏水性Fig.2 Using BioEdit software to analyze the hydrophobicity of P02751 protein
2.5P02751蛋白的跨膜区分析 使用TMHMM对P02751蛋白进行跨膜区分析,结果显示P02751蛋白的1-2386位氨基酸全部位于细胞膜表面,表明该蛋白可能不是一个与细胞信号转导有关的膜受体蛋白,它发挥生物学功能的方式可能不是以信号转导的方式。
2.6P02751 蛋白的信号肽预测结果及分析 使用SignalP3.0服务器对P02751蛋白进行信号肽预测,从结果中分析s平均值>0.5,则预测该蛋白为分泌蛋白,存在信号肽。基于神经网络算法的结果表明,该蛋白具有信号肽序列,最可能的剪切位点位于第26-27位氨基酸之间,具体序列为MLRGPGPGLLLLAVQCLG,说明P02751蛋白可能在跨膜运输中起信号识别作用,剪切位点在第26-27位氨基酸之间,表明成熟肽始于第26位氨基酸(图3,表1)。

图3 使用SignalP3.0软件预测信号肽Fig.3 Using SignalP3.0 to predict signal peptide
2.7P02751蛋白的亚细胞定位预测结果及分析 通过TargetP对P02751蛋白的亚细胞定位进行预测,结果显示目的蛋白P02751的分泌途径为S型,即分泌通路,可靠性级别为2级(0.800>diff>0.600),与SignalP3.0服务器预测的结果一致(表2)。
表1 基于神经网络算法的SignalP预测结果
Tab.1 Prediction results of SignalP based on neural network algorithm

测量指标位置计算值量值信号肽max. C270.303max. Y270.458max. S50.895mean S1-260.717 D1-260.5980.450YES
Name=sp_P02751_FINC_HUMAN;SP='YES' Cleavage site between pos. 26 and 27: TGA-SK D=0.598 D-cutoff=0.450;Networks=SignalP-noTM
表2 TargetP1.1Server亚细胞定位结果
Tab.2 TargetP1.1Server subcellular localization results

名称 长度线粒体导肽信号肽其他类型可能定位可靠性级别sp_P02751_FINC_HUMAN 23860.1670.7970.034S2cutoff0.0000.0000.000
2.8P02751蛋白和Q99715蛋白的序列相似性比对结果 P02751蛋白质在人类基因组数据库用Blastp命令、选择Swissprot and TREMBL proteins(AA)数据库进行蛋白质序列比对,结果得出p02751蛋白和q99715蛋白的各个种属均有不同程度的相似性,一致性在30%(表3)。
2.9Q99715蛋白的理化性质分析 同样对胶原蛋白(Q99715)进行理化性质分析,结果显示胶原蛋白(Q99715)的分子质量约为330 kDa、理论等电点pI为7.62,总共包括46 349个原子,分子式为C14662H23037N3975O4610S65;在组成Q99715蛋白的20种氨基酸中,甘氨酸所占的比例最高,为9.2%,半胱氨酸所占的比例最低,为0.7%;Q99715蛋白的不稳定指数为32.52,脂肪指数为74.92,根据Guruprasad方法表明该蛋白稳定。
2.10同源建模结果 同源建模结果及通过Verify 3D软件对建模结果进行质量评估,得出p02751蛋白的质量评估结果是89.95%,q99715蛋白的质量评估结果是80.5%(在3D结构中,至少80%的氨基酸的得分≥0.2分,建模结果属于可信)。(图4(1,2),图5(1,2))。
2.11蛋白保守结构域的预测结果 纤维连接蛋白和胶原蛋白的保守结构域的预测结果及它们所属蛋白家族,得出纤维连接蛋白和胶原蛋白的保守结构域所属家族同是Ensembl家族(图6(1,2))。
表3 之间的相似性分析p02751蛋白和q99715蛋白
Tab.3 The similarity analysis between P02751 protein and Q99715 protein

类型比对序列最大值序列总长度所占百分比(%)期望值相似度登录号 Collagen alpha-1(xx)chain iso-form x5 [Homo sapiens]130307574e-2930XP011527242.1Collagen alpha-1(xx)chain precur-sor [Homo sapiens]129306574e-2930NP066933.2Collagen alpha-1(xx)chain iso-form x1 [Homo sapiens]129392568e-2930XP011527238.1Collagen alpha-1(xx)chain iso-form x2 [Homo sapiens]129395588e-2930XP011527239.1Collagen alpha-1(xx)chain iso-form x5 [Homo sapiens]129307574e-2930XP011527242.1Collagen alpha-1(xx)chain precur-sor [Homo sapiens]129306575e-2930NP065933.2Collagen alpha-1(xx)chain iso-form x2 [Homo sapiens]129395587e-2930XF011527239.1Collagen alpha-1(xx)chain iso-form x1 [Homo sapiens]129392567e-2930XF011527238.1Collagen alpha-1(xx)chain iso-form x4 [Homo sapiens]128392581e-2630XF011527241.1Collagen alpha-1(xx)chain iso-form x3 [Homo sapiens]128392591e-2830XF011527240.1

图4(1) 纤维连接蛋白的三级结构Fig.4(1) Three level structure of P02751 protein图4(2) 纤维连接蛋白的同源性建模及质量评价结果Fig.4(2) The results of homology modeling and quality evaluation of fibronectin图5(1) 胶原蛋白的三级结构Fig.5(1) Three level structure of Q99715 protein图5(2) 胶原蛋白的同源性建模和质量评价结果Fig.5(2) The results of collagen homology modeling and quality assessment

图6(1) 纤维连接蛋白的保守结构域图Fig.6(1) Conserved domain of P02751 protein图6(2) 胶原蛋白的保守结构域图Fig.6(2) Conserved domain of Q99715 protein
3 讨 论
PCP是一种严重的机会感染性疾病, AIDS患者应用磺胺甲恶唑/甲氧苄啶或喷他脒疗程要长,为3周或更长[7]。初期疗效同非AIDS患者相似,但药物副作用的发生率和严重性更明显,复发率可高达50%[8]。目前,尚没有研制出针对肺孢子菌的疫苗,也没有研制出副作用较小的药物,加之肺孢子菌在不同的生物体中的基因型有很大差异[9],如此一来对于研究靶向疫苗就成为难题了,由于该虫种的体外培养和获取都有一定的难度,动物模型的建立需要很长的时间,最后的结果也不尽如人意,所以对于其治疗手段的研究就出现了挑战。
近年来,随着科学发展,国内外蛇毒研究工作迅速兴起,蛇毒应用越来越广,蛇毒的科学价值和经济价值逐步被认识。例如磷酸二酯酶被用作核酸和核苷酸类辅助因子结构的分析[4];蛋白酶被用作蛋白质和多肽一级结构的测定,磷脂酶A2用作细胞膜结构和功能的研究等[10]。胶原蛋白不被一般水解酶水解,而对动物体内的胶原蛋白酶(EC3,4,24)敏感。动物体内的胶原蛋白酶作用于胶原蛋白三螺旋体特殊部位,释放出二种肽,分别称为TcA和TcB,长度分别为胶原蛋白单体的3/4和1/4。很早就有人怀疑蛇毒中也含有胶原蛋白酶,直到近些年才得以证实[11]。该酶和其他动物胶原蛋白酶相似,作用于胶原蛋白螺旋区的特异部位,水解产生两种肽,大小和其他动物胶原蛋白酶水解的产物相似,只不过TcA分子量稍大而已,可能蛇毒胶原蛋白酶水解的部位更接近C端。它不能水解合成的蛋白酶底物TAME和A-TEE,这说明它与胰蛋白酶、胰凝乳蛋白酶不同,而是一种特异的胶原蛋白酶[12],因此蛇毒的应用就显得更有意义了。但是蛇毒的获取比较困难加上考虑到生态问题,科学家不能大量捕杀蛇类来做科学研究,那么通过生物信息学手段探索出哪些蛋白质能够被蛇毒成分中的哪些酶类水解和破坏就显得极其重要了。
生物信息学软件分析[13]显示纤维连接蛋白疏水区没有亲水区有典型优势。因为氨基酸的疏水的相互作用[14],在保持蛋白质三级结构的形成和稳定性中起着重要作用,所以可以推测纤维连接蛋白结构不够稳定[15]。而分析得知胶原蛋白属于较稳定蛋白,纤维连接蛋白(P02751)与胶原蛋白(Q99715)具有序列相似性,空间结构具有相似性以及具有相似的保守结构域,它们所属的蛋白家族也具有相似性。纤维连接蛋白相对于胶原蛋白又较不稳定,蛇毒中的胶原蛋白酶可以水解胶原蛋白,因此推测蛇毒中的胶原蛋白酶可以水解纤维连接蛋白,为PCP的研究提供了新的方向。纤维连接蛋白广泛存在于动物组织和组织液中,是一种高分子糖蛋白,具有多种生物学功能。纤维连接蛋白在进化过程中保守性很强,各种动物体液中的纤维连接蛋白具有相近的结构性质和生物学功能,因而不同来源的纤维连接蛋白可以相互替代使用,这也给下一步探索肺孢子菌寄生在动物和人体两类宿主内的联系和区别提供了新的线索。从另一个方面来研究,因为蛇毒中还有一些细胞毒素,神经毒素等可以对细胞等结构进行破坏,也可以作为肺孢子菌治疗的研究热点,后续的研究需要各国科学家极力探索。
