不同加速成像方法在动脉粥样硬化斑块动态增强MRI中的应用
2018-11-01刘娴蔡小英齐海坤吴婷婷陈慧军
刘娴,蔡小英,齐海坤,吴婷婷,陈慧军
清华大学医学院生物医学工程系医学影像中心,北京 100084;
动脉粥样硬化是全球致死率最高的心脑血管疾病的主要成因[1],其主要特征是血管壁斑块形成,而炎症和新生血管化是动脉粥样硬化的重要病理生理过程[2]。近年来,动态增强磁共振成像(dynamic contrast enhanced magnetic resonance imaging,DCEMRI)用于评估动脉粥样硬化斑块内的炎症和新生血管[2-3],其不仅与临床症状相关[4],还可以作为临床及病理研究的重要在体炎症和新生血管量化工具[5-6]。
然而,DCE-MRI对血管壁的动脉增强成像技术要求极高。首先,一般血管斑块较小,必须保证DCE-MRI序列有足够的空间分辨率。而对DCE-MRI图像的药代动力学分析要求DCE-MRI有较高的时间分辨率。此外,在对血管壁的DCE-MRI中,血流也会对斑块的成像产生影响,直接导致传统的亮血 DCEMRI技术仅能量化较大的斑块[7-8]。近年提出的HOBBI(homologous black-bright-blood and flexible interleaved imaging sequence)技术[9]通过交替采集黑血和亮血图像,实现了黑血和亮血的不同空间和时间分辨率,以获得较高精度的DCE-MRI量化分析结果。然而,由于未使用任何加速成像算法,使其成像覆盖范围和量化分析精度受到限制。近年来,各种加速成像方法在其他组织和序列成像中得到广泛应用[10-12],可在保证一定程度信噪比(SNR)的情况下获得较高的时空分辨率。然而,HOBBI技术在动脉粥样硬化斑块DCE-MRI这一依赖动态成像、注重时间上量化的准确性、并受到血流影响的成像任务中尚未得到应用和验证。
因此,本研究通过使用数字仿真模型和在体数据仿真,探讨各种主流加速成像方法应用于动脉粥样硬化斑块 DCE-MRI的可能性,并比较各种方法对药代动力学分析精确性的影响,为临床应用提供参考。
1 资料与方法
1.1 快速成像方法 本研究基于目前较为先进的HOBBI序列(图1),选取4种不同原理的主流快速成像方法对血管壁 DCE-MRI进行加速:keyhole[13]、ktGRAPPA[14]、ktPCA[15]与 ktSLR[16]。由于HOBBI序列亮血部分已采用小视野成像加速,故加速方法主要应用于采集较慢的黑血序列。参数设置参见序列原始文献[9]。
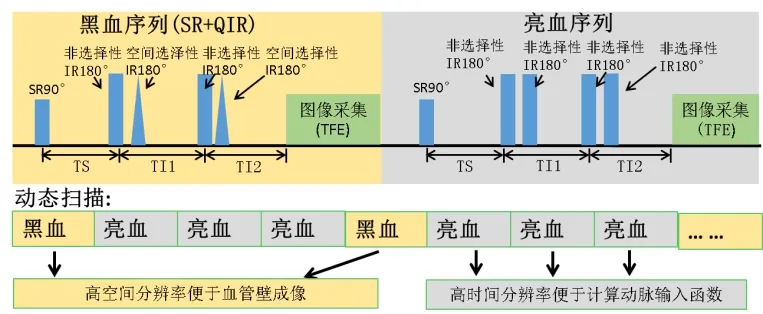
图1 HOBBI序列。SR、IR、QIR、TS、TI1、TI2为饱和脉冲
1.2 数字仿真模型 由于实采数据无法提供药代动力学参数真实值,因此本研究首先采用数字仿真测试各方法。数字仿真模型(图2)参考获取的新西兰兔腹主动脉图像建立。鉴于实际扫描中研究对象侧卧、垂直方向相位编码减轻了腹部运动对图像的影响[9],因此模拟时不考虑腹部运动的影响。
1.2.1 成像序列对应的信号计算 本研究采用传统双指数模型[17]模拟血液中造影剂浓度的变化(图3),其他组织造影剂浓度则选用表现稳定[18]的 Patlak模型[19],通过设置容积转运常数(Ktrans)和血浆体积分数(Vp)计算得出。根据各组织造影剂浓度与T1值变化的换算关系[20],结合初始T1值可以得出各组织T1值变化情况。鉴于血流速度随空间、时间的差异,本研究假设腹主动脉血流为最简单的层流,根据实测数据[21]采用谐波合成模拟血管中心血流在一个心动周期内的变化[22]。应用HOBBI[9]的仿真参数设置和信号公式计算出各组织信号。由此可得加速前的k空间与图像数据,对仿真所得每幅k空间加入SNR可控的噪声[9],每次测试添加10次,展示平均后的最终结果。通过改变参数值,共进行4组测试(表1)。
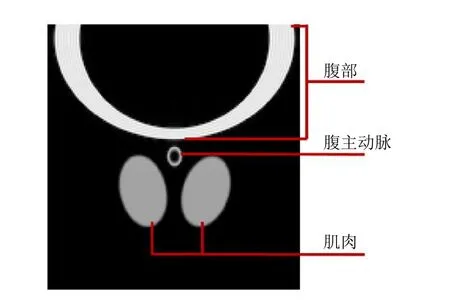
图2 仿真模型模拟图像各部分
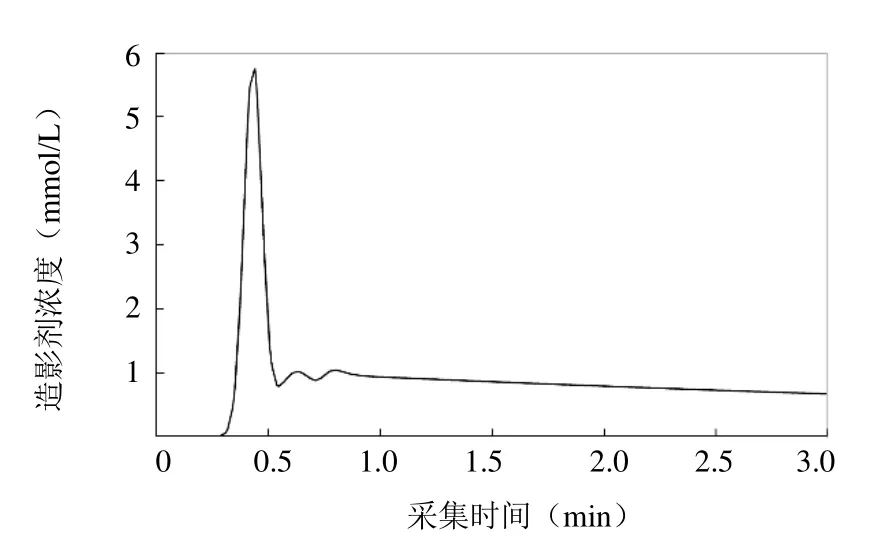
图3 数字模拟中动脉输入函数
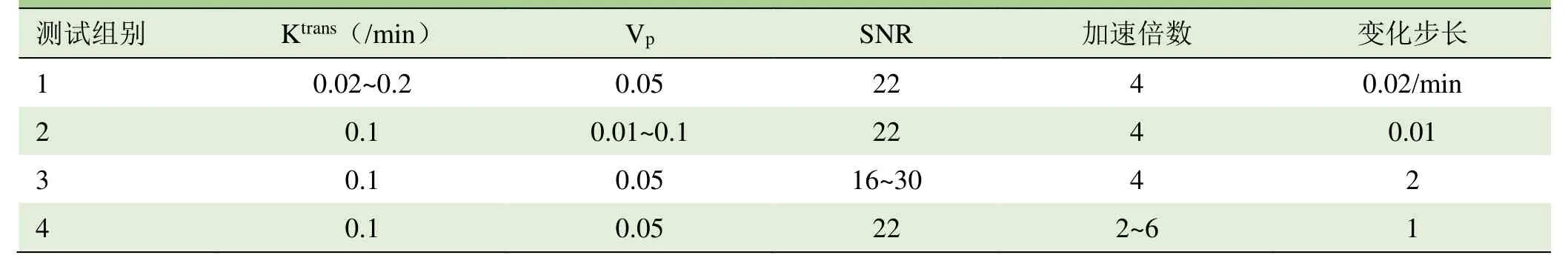
表1 4组测试对应的参数设置
1.2.2 数字仿真的图像处理和分析 为减少人为因素的影响,本研究将设置的各组织范围应用于加速后的图像中,得到各组织信号强度和相应的造影剂浓度,使用Patlak模型进行药代动力学分析获得Ktrans。由于在血管壁的 DCE-MRI研究中[8,18,23]Ktrans是主要检测参数,因此本研究专注于各种方法对 Ktrans的影响,计算各条件下 Ktrans的均值和标准差,比较各方法与真实值的均方根误差(root mean square error,RMSE)。
1.3 在体数据仿真 本研究使用的 HOBBI在体数据是在10只新西兰白兔的动脉粥样硬化斑块动物模型上扫描所得,具体动物模型制作和数据的获取参见文献[9],本研究使用的数据为该项目中的第一次扫描数据。与数字仿真类似,本研究使用 4种加速算法对黑血成像分别进行加速倍数为2、3、4、5的模拟。
在体仿真的图像处理和分析:为准确评估图像质量和药代动力学分析的准确性,本研究从2个层面对4组加速成像和1组未加速的实测图像进行评价。
首先评价图像质量,将实测图像设为参照,对每个实验对象选择其质量最好的一帧,与相同帧数下加速图像随机排序,由人工使用盲法打分,其中4分为最好(管腔管壁边界清晰),1分为最差(管腔管壁无法分辨)。
其次,为了评估药代动力学参数分析结果,使用CASCADE 1.9.0软件[9]处理图像,由1名经过相关培训的医学生在软件中逐组逐帧圈出腹主动脉血液(亮血)和腹主动脉血管壁(黑血)的区域,得到感兴趣区造影剂浓度-时间曲线(图4)。在画腹主动脉的过程中,为了避免附近的静脉信号污染,去除部分靠近静脉的主动脉(图4A)。然后使用Patlak模型计算药代动力学参数,并比较各加速方法与未加速图像所得 Ktrans。
1.4 统计学方法 采用SPSS 21.0软件,在体仿真加速图像与实测图像评分的差异比较采用配对t检验,P<0.05表示差异有统计学意义。
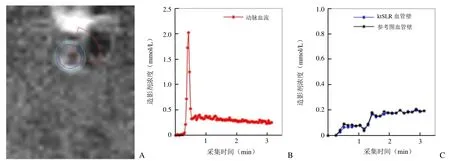
图4 Cascade的使用。A为在黑血图像上圈出血管壁,绿色曲线勾画血管壁外边缘,蓝色曲线勾画血管壁内边缘,红色扇形确定动脉和静脉相邻的部分;B、C分别为该个体对应的血流和血管壁造影剂浓度曲线
2 结果
2.1 数字仿真结果 设定加速倍数为 4、Ktrans为0.10/min、Vp为0.05、SNR为22时,各方法所得的部分黑血图像和造影剂浓度曲线见图5,未加速参考图像因时间分辨率不够,所得造影剂浓度曲线无法准确跟随真实值(图5A第3帧和图5B)。除keyhole所得曲线偏离真实值外,其他加速方法所得曲线均与真实值相符(图5B)。
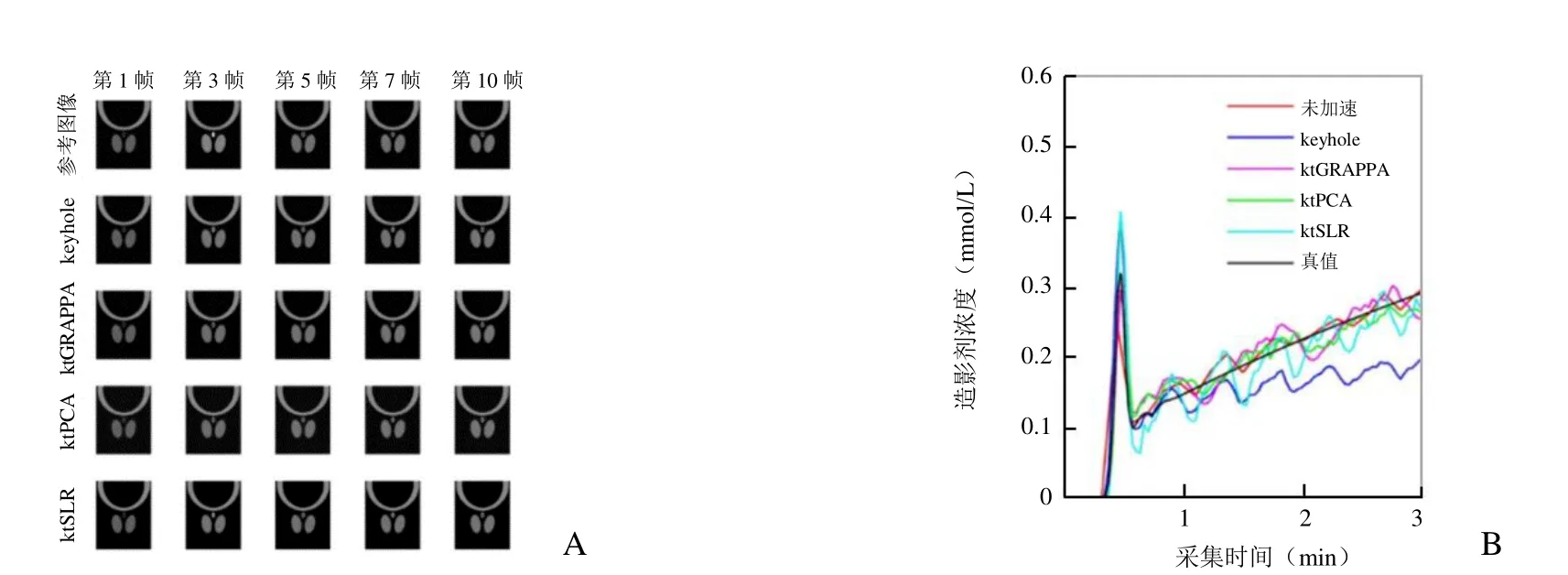
图5 各加速方法所得图像和血管壁造影剂浓度对比。A.各加速方法所得黑血图像与不加速参考图像对比(标注的帧数指参考图为此帧的时间);B.对应的血管壁造影剂浓度变化曲线
各种加速成像方法在不同条件下的表现:由图6可见,在所测Ktrans范围内,所有加速方法获得的Ktrans均值均小于未加速参考值,ktGRAPPA与ktSLR的Ktrans均值更接近真实值,所得RMSE比参考组更小,ktPCA的RMSE与参考组相近,keyhole方法所得Ktrans的误差非常大;而在所测Vp范围内,所有加速方法获得的Ktrans均值均小于未加速方法,大部分情况下ktGRAPPA与ktSLR均能获得比参考组更小的RMSE。
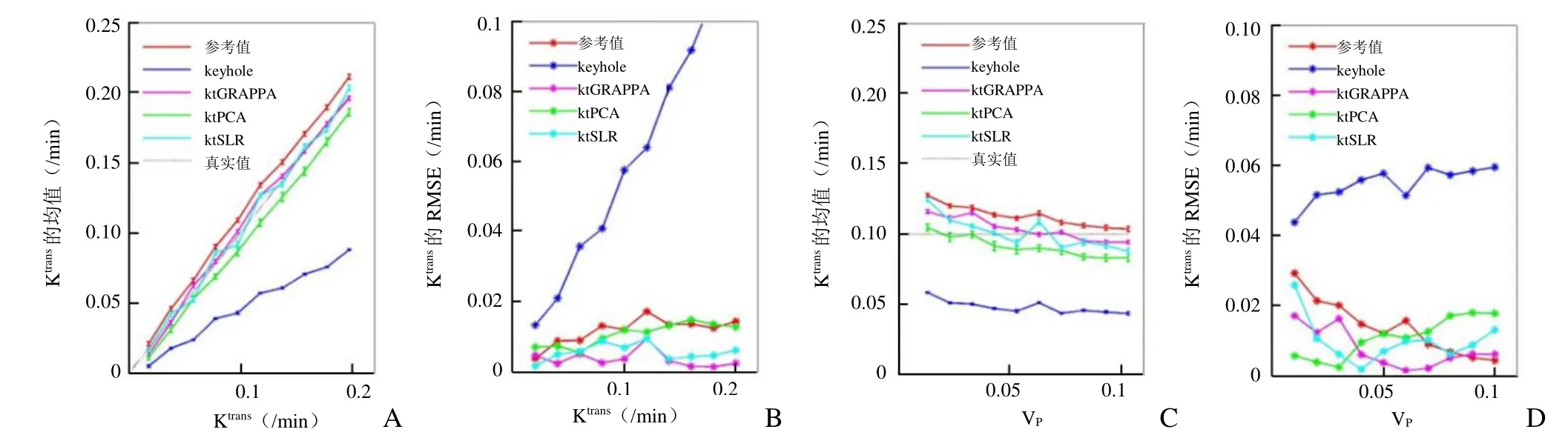
图6 药代动力学参数变化时各加速方法所得Ktrans与未加速参考值、真实值的比较。A为Ktrans变化时,所得Ktrans的均值和标准差;B为对应Ktrans的RMSE;C为Vp变化时,所得Ktrans的均值和标准差;D为对应Ktrans的RMSE
由图7可见,在所测试的SNR范围内,各种加速算法对SNR的改变不敏感,ktGRAPPA与ktSLR的RMSE最小,Ktrans的均值也更接近真实值,ktPCA与参考组RMSE相近,而keyhole的Ktrans误差较大;在所测加速倍数范围内,各方法所得 Ktrans的 RMSE均随加速倍数变大,而ktGRAPPA与ktSLR始终是Ktrans的 RMSE最小、均值最接近真实值的方法,前者在低倍加速时最接近真实值,后者在不同加速倍数下的表现更为稳定。鉴于加速6倍时ktGRAPPA和ktPCA的精度下降,活体实验设置的加速倍数为2~5。
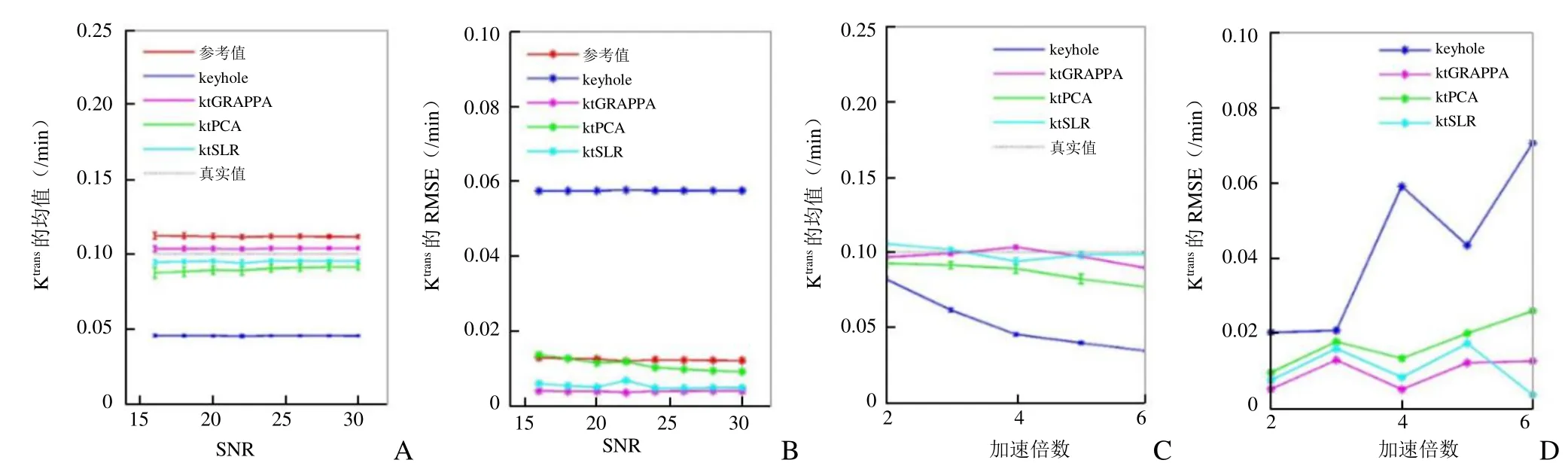
图7 各加速成像方法计算得出的Ktrans与未加速图像的参考值、真实值的比较。A为设定SNR变化时,所得Ktrans的均值和标准差;B为对应Ktrans的RMSE;C为设定加速倍数变化时,所得Ktrans的均值和标准差;D为对应Ktrans的RMSE
2.2 在体图像仿真实验结果
2.2.1 图像质量评分 由实际图像(图8)可见,keyhole加速的图像质量较差,而其他方法的加速图像与参考图像较为接近。各组图像质量的平均分见表2,结果发现,除keyhole的图像质量评分显著低于未加速方法外,各方法在不同加速倍数下评分接近参考图,各组加速后图像也与参考图的评分无显著差异(表2)。
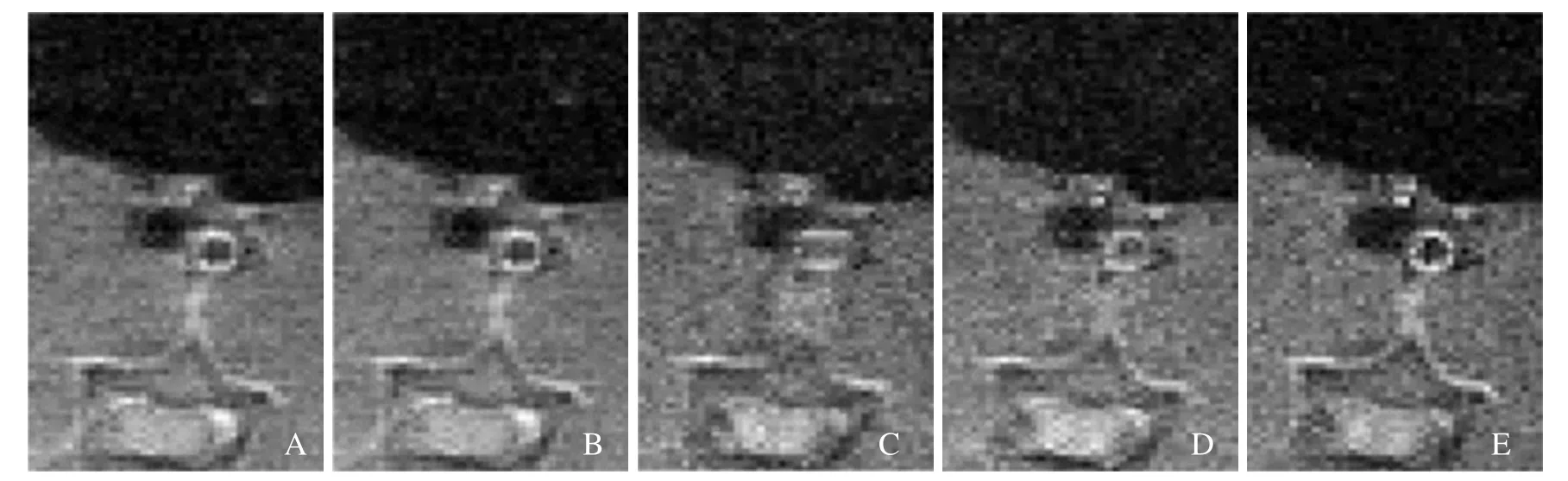
图8 一组评分图像(加速倍数3,第5帧)。ktPCA示血管壁结构较为清晰(A);ktSLR所示血管壁结构略有模糊(B);keyhole所示血管壁边界模糊不清(C);ktGRAPPA所示结构管腔存在高信号噪声(D);参考图像的血管壁结构相对清晰,但图像存在多处高信号噪点(E)
表2 各组图像评分比较(±s)
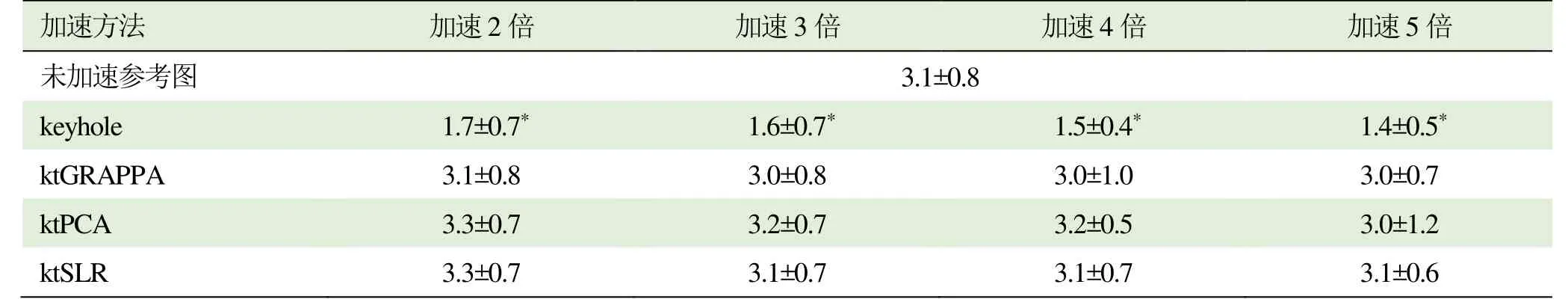
表2 各组图像评分比较(±s)
注:与未加速图像评分比较,P<0.001
2.2.2 药代动力学参数分析 由图9可见,各加速方法所得 Ktrans的均值低于参考图像所得均值,而ktGRAPPA和ktSLR结果较为接近,与数字仿真趋势一致。
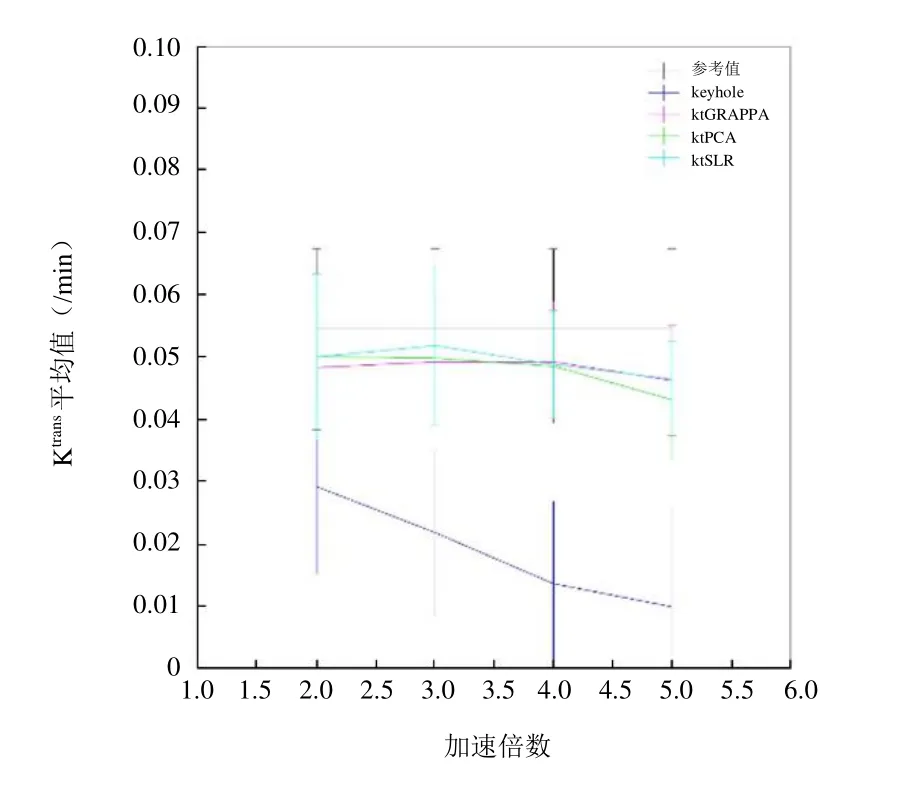
图9 在不同加速倍数下,各种加速算法于在体图像仿真中的Ktrans均值与标准差
3 讨论
血管壁DCE-MRI作为非侵入性地研究斑块新生血管和炎症程度的工具,在斑块诊断、预防急性病方面有极高的应用价值。然而,较小的斑块组织、血流的影响和药代动力学参数高精度分析对DCE-MRI的空间和时间分辨率均提出了很高的要求,本研究通过在数字仿真模型和在体数据上模拟HOBBI序列的加速成像,发现ktGRAPPA和ktSLR加速成像方法可进一步提高目前较为先进的HOBBI序列进行血管壁DCE-MRI药代动力学分析和量化的精度,为加速算法在血管壁DCE-MRI中的应用提供了可行性验证。
通过数字仿真各方法RMSE比较发现,各个加速成像方法中基于并行成像的ktGRAPPA、基于压缩感知的ktSLR结果与真实值更为接近,优于未加速参考图像的结果。关注 Ktrans这一与新生血管情况密切相关的参数,容易发现未加速方法会高估Ktrans,而这两种加速方法所得的 Ktrans结果更小、更接近真实值,同时其在多次独立噪声影响下所得的RMSE也最小,因此得到的结果更为准确。本研究检测了各种方法在不同药代动力学参数、不同等级噪声干扰、不同加速倍数下的结果,可以看出三者之间的大小关系始终成立。而本研究在体数据的仿真结果也表明加速成像分析结果低于未加速计算结果的这一关系依然成立,提示于在体数据模拟实验中加速成像的结果可能更接近真实数值。
同时,通过不同加速倍数下各种方法的对比发现,不同方法的表现有所差异。数字仿真中ktGRAPPA在加速不大于4倍时是加速的最优方案,当加速倍数进一步提高时,则采用 ktSLR的方法更佳。这可能是因为ktSLR同时利用了动态图像的稀疏性和低秩性,故对加速后空间信息的丢失更不敏感。基于 x-f域重建的 ktPCA方式表现中等,不如ktGRAPPA和 ktSLR的原因可能是因为在图形处理中将一部分对象信息当作噪声去除,从而对结果产生影响。而基于k空间替代的keyhole表现较差,可能是因为仅保留了图像大体轮廓随时间的变化,不能准确记录信号随时间的变化,因而计算结果出现较大的偏差。活体数据模拟的图像评分也与数字仿真结果基本一致,其中ktPCA和ktSLR获得的图像得到与不加速图像虽不显著但偏高的评价,可能与其重建方法有一定的降噪作用有关。
本研究中在体数据的加速仿真通过实际k空间数据(传统笛卡尔采样)的欠采样进行,因此并未充分利用加速成像提高时间分辨率的特性。在实际应用中可以通过k空间欠采样提升单位时间内采集的帧数,为药代动力学模型的拟合提供更多的信息,进一步提升结果的精度。活体数据模拟中仅考虑了加速倍数2~5倍的情况,并未进一步提高加速倍数。但结合数字模型仿真结果发现,大多数加速方法在加速6倍时结果精度出现显著下滑,因此目前的加速倍数设置可以覆盖各方法表现较优的情况。
总之,本研究将加速成像应用于HOBBI序列,通过在数字仿真模型和在体数据上的测试,不仅证实了在血管壁 DCE-MRI中使用快速成像方法的可行性,而且还发现使用ktGRAPPA和ktSLR加速成像方法所得的 Ktrans精度更高,为进一步改进血管壁DCE-MRI提供了方向。
