冬小麦旗叶大小及籽粒相关性状的QTL分析
2018-11-01逯腊虎史晓芳彭惠茹倪中福孙其信
逯腊虎,杨 斌,张 婷,张 伟,袁 凯,史晓芳,彭惠茹,倪中福,孙其信
(1.山西省农业科学院 小麦研究所,山西 临汾 041000;2.中国农业大学 植物遗传育种系,北京 100193)
灌浆期是小麦(TriticumaestivumL.)产量形成的关键时期[1-2],作为灌浆期最重要的光合器官,旗叶为小麦籽粒干质量的形成贡献了30%~50%的光合同化产物[3-5]。旗叶对产量的影响主要是通过对穗粒数、穗粒质量与千粒质量的调控而实现[4,6],前人研究结果表明,旗叶的形态指标如叶长、叶宽、叶面积等性状对穗粒数、穗粒质量与千粒质量均具有较大的影响。钱雪娅[7]研究发现,灌浆期小麦旗叶的长、宽与千粒质量、单株产量呈显著正相关。傅兆麟等[8]研究表明,小麦旗叶的长、宽、叶面积与穗粒数呈显著或极显著正相关。王义芹等[9]研究也发现,小麦旗叶面积与单株生物产量与经济产量呈显著正相关。因此,对小麦旗叶形态指标与籽粒相关性状进行遗传剖析,从遗传机理角度深入解析这些紧密关联性状的相互关系,可为小麦高产育种与分子聚合育种提供理论数据支撑。
近年来,得益于分子标记技术的快速发展,在小麦旗叶性状[10-17]、籽粒性状[18-23]的遗传机理研究方面已取得一定的进展。Garcia-Suarez等[10]利用包含114个家系的RIL群体,分别在2A、2D和6D染色体上检测到了控制叶面积的QTL。Xie等[12]以Forno×Oberkulmer构建的RIL群体,共检测到了21个控制叶面积的QTL;常鑫等[14]利用小偃81×西农1376构建的RIL群体,分别检测到9个控制叶长、10个控制叶宽以及12个控制叶面积的QTL。然而,旗叶性状与籽粒性状均是复杂的数量性状,容易受到环境的影响[11],这就要求用于遗传分析的初级定位群体家系数目不能太少、遗传图谱标记间的平均距离不能过大、并且需要进行多个环境下的验证[24],以此降低QTL检测的假阳性,从而获得稳定表达的QTL。据此标准,此前关于小麦旗叶性状的遗传研究或多或少存在一些不足。此外,目前尚未见到从遗传关系的角度分析小麦旗叶大小与穗粒数、穗粒质量与千粒质量这些紧密关联性状的研究报道,而基于不同遗传群体的分析结果往往因为遗传背景的不同无法直接进行相互比较[25]。
本研究以农大3338×京冬6号构建的包含216个家系的DH群体为材料,构建了包含469个SSR标记的遗传连锁图谱,并进行了2年共计4个环境下的表型值测定,以期发掘能够稳定表达的QTL,并从遗传机理角度深入解析旗叶大小与籽粒性状这些紧密关联性状的相互关系。
1 材料和方法
1.1 试验材料
本研究利用农大3338和京冬6号构建的DH群体包含216个家系。其中,母本农大3338是中国农业大学选育的优良矮秆亲本,父本京冬6号是北京市延庆县农业科学研究所育成的水地高产品种[26]。
1.2 遗传连锁图谱的构建
采用Mapmaker version 3.0构建了小麦DH群体(农大3338×京冬6号)的遗传连锁图,总长度为2 205.93 cM,469个SSR标记被锚定在小麦的21条染色体上,每条染色体上平均有22.33个标记,平均2个标记的距离为4.7 cM。
1.3 田间试验及性状调查
于2015,2016年将DH群体及其亲本分别种植于山西省农业科学院小麦研究所试验站(临汾市)与山西省农业科学研究院棉花研究所试验站(运城市),2年共计4个环境,分别记为E1(2015临汾)、E2(2016临汾)、E3(2015运城)和E4(2016运城)。试验采用随机区组设计,双行区种植,行长1.5 m,行距0.25 m,重复3次,按常规栽培技术进行管理。
于开花10 d时,在亲本与每个家系中选取发育正常、长势一致的10株小麦进行旗叶长(Flag leaf length,FLL)、旗叶宽(Flag leaf width,FLW)的测定,并根据公式计算旗叶面积(Flag leaf area,FLA)(旗叶面积=长×宽×0.83)。小麦成熟后,将挂牌标记的小麦收获,进行千粒质量(Thousand grain weight,TGW)、穗粒数(Grain number per spike,GNS)、穗粒质量(Grain weight per spike,GWS)的测定。
1.4 数据分析及QTL定位
采用Excel和SPSS 19.0统计分析软件(IBM SPSS,Somers,NY,USA)对小麦DH群体以及双亲各表型数据进行统计分析,包括均值、标准差、变异范围、变异系数、偏度、峰度以及方差分析等。
2 结果与分析
2.1 各家系与亲本旗叶相关性状的表型变异分布
由表1可知,4个环境条件下,双亲之间旗叶宽的差异均未达到显著水平(P>0.05),而父本京冬6号旗叶长、叶面积与母本农大3338之间差异均达显著(P>0.05)或极显著(P<0.01)水平,说明双亲之间叶面积的差异主要是通过叶长的变化引起的。
4个环境条件下,双亲的旗叶长、宽和面积表型值均介于DH群体的最小值与最大值之间(表1),表明控制叶性状的有利等位基因在群体之间得到了广泛分离。4个环境中,偏度与峰度的绝对值均小于1,表明群体之间叶性状呈现出连续性正态分布,适宜于进行QTL分析。
2.2 各家系与亲本籽粒相关性状的表型变异分布
由表2可知,4个环境条件下,双亲除E2、E4的穗粒质量与E1、E2穗粒数差异未达到显著水平(P>0.05)外,其余籽粒性状差异均达显著(P<0.05)或极显著(P<0.01)水平。与叶性状趋势类似,4个环境条件下,双亲的籽粒性状表型值也均介于DH群体的最小值与最大值之间(表2),说明籽粒性状也呈现典型数量性状的特征,可进行QTL分析。

表1 不同环境下DH群体与亲本旗叶长、宽和面积的表型变异Tab.1 The variation of flag leaf length,flag leaf width and flag leaf area of parents and DH (doubled haploid)lines under different environments
注:*.差异达显著水平(P<0.05);**.差异达极显著水平(P<0.01);ns.差异未达到显著水平。表2同。
Note:*.Significant difference at 0.05 level;**.Significant difference at 0.01 level;ns.Not significant difference. The same as Tab.2.
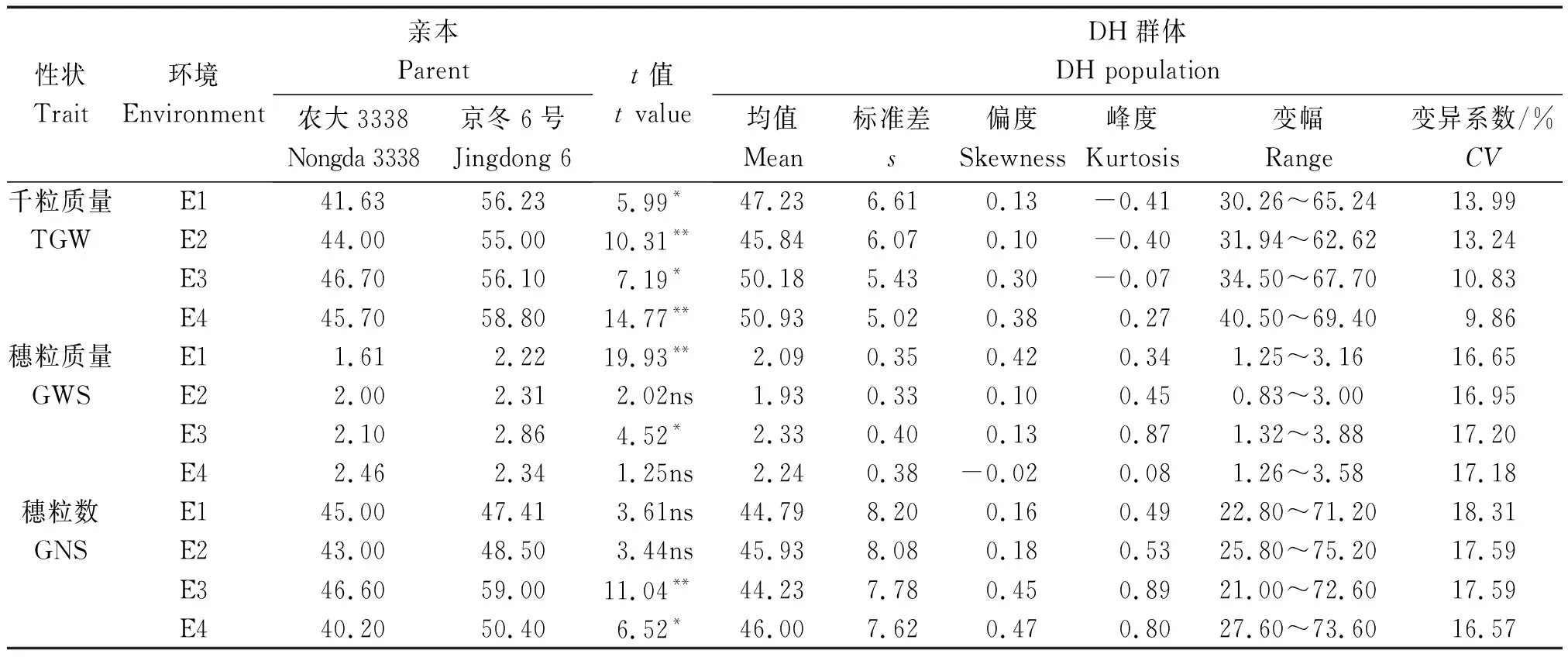
表2 不同环境下DH群体与亲本千粒质量、穗粒数和穗粒质量的表型变异Tab.2 The variation of thousand-grain weight,grain number per spike and grain weight per spike of parents and DH(doubled haploid)lines under different environments
2.3 旗叶长、宽和面积的加性QTL分析
4个环境中,共检测到40个旗叶性状的加性QTL,位于除1D、3A、3D、5B、5D、6B、7A、7B和7D外的其余12条染色体上,其中,19个QTL(47.50%)位于A染色体组,12个QTL(30.00%)位于D染色体组,B染色体组上的QTL最少,仅有9个(22.50%)。这些旗叶性状QTL阈值介于2.35~7.33,能够解释表型变异的3.67%~26.77%(表3)。
10个控制旗叶长的QTL对表型变异的贡献率为4.19%~15.32%,其中,Qfll-1B.1、Qfll-4A.2和Qfll-5A.1对表型的贡献率大于10%,是控制旗叶长的主效QTL。Qfll-2B(E3、E4)、Qfll-4A.2(E1、E2)和Qfll-5A.1(E3、E4)能够在2个环境条件下被同时检测到。
14个旗叶宽的QTL对表型变异的贡献率介于4.52%~26.77%,其中,6个QTL(Qflw-2D.2、Qflw-4A.1、Qflw-4B.1、Qflw-4D.1、Qflw-6D.1和Qflw-6D.2)是控制旗叶宽的主效QTL。5个QTL(Qflw-4A.1、Qflw-4A.3、Qflw-4B.1、Qflw-4D.1和Qflw-6D.1)分别能在2个或2个以上环境条件下被检测到,其中,位于4B染色体Xcau506~Xwmc141标记区间的Qflw-4B.1能在4个环境中同时被检测到,解释表型变异的13.88%~26.77%,说明该QTL可能具有不受环境影响稳定表达的特点。此外,位于4A、4D染色体上的2个旗叶宽QTL(Qflw-4A.1、Qflw-4D.1)在E1、E2、E3环境中也均能被检测到。

表3 不同环境下旗叶长、宽和面积的加性QTLTab.3 Additive effect of quantitative trait loci (QTLs) for flag leaf length, flag leaf width and flag leaf area under different environments
注:R2为加性QTL对表型值变异贡献率。表4同。
Note:R2is rate of contribution explained by the additive QTL. The same as Tab.4.
共检测到16个旗叶面积的QTL,贡献率为3.67%~21.88%,其中,5个QTL(Qfla-2D.3、Qfla-4A.2、Qfla-4A.4、Qfla-4B和Qfla-6D)能在2个或3个环境条件下被检测到。4个QTL(Qfla-2D.3、Qfla-4A.1、Qfla-4A.4、Qfla-4B)为控制旗叶面积的主效QTL,其中,位于2D染色体上Xcfd53~Xcfd2标记区间的QTL(Qfla-2D.3)在E1、E2这2种环境条件下对表型的贡献率为20.08%和21.88%。
2.4 千粒质量、穗粒数和穗粒质量的加性QTL分析
从表4可以看出,4个环境条件下,共有65个籽粒性状的QTL在除1A、3D和5B之外的18条染色体上被检测到,其中,B染色体组上检测到的籽粒性状QTL数量最多,为30个,占籽粒性状QTL总数的46.15%,A染色体组上共检测到24个QTL(36.92%),D染色体组上最少,仅为11个(16.92%)。

表4 不同环境下千粒质量、穗粒数和穗粒质量的加性QTLTab.4 Additive effect of quantitative trait loci (QTLs) for thousand-grain weight,grain number per spike and grain weight per spike under different environments

表4(续)
检测到24个千粒质量相关的QTL,贡献率介于2.28%~39.91%,其中,有9个QTL为控制千粒质量的主效QTL;8个QTL能在2个或2个以上环境中被检测到,占千粒质量QTL总数的33.33%。位于4A、4B染色体上的3个QTL(Qtgw-4A.1、Qtgw-4B.2和Qtgw-4B.3)分别能在3个(E1、E2、E4)、3个(E1、E3、E4)和4个环境中被检测到,其中,位于4B染色体Xcau506~Xwmc141标记区间的QTL(Qtgw-4B.3)在4个环境下对表型的贡献率为19.43%~39.91%。
共检测到23个穗粒质量的QTL,对表型的贡献率为3.75%~26.82%,其中,有5个QTL能在2种环境中同时被检测到。有5个QTL为控制穗粒质量的主效QTL,对表型的贡献率为10.55%~26.82%,其中,位于4B染色体上Xcau506~Xwmc141标记区间的QTL(Qgws-4B.3)能够在E2环境下解释表型变异的26.82%。
4个环境条件下共检测到18个穗粒数的QTL,能够解释表型值变异的3.89%~26.52%,其中,5个为穗粒数的主效QTL,对表型的贡献率介于10.12%~26.52%。位于4A染色体Xcau467~Xbarc343标记区间的QTL(Qgns-4A.2)在E4环境中对表型的贡献率为26.52%。未检测到能在多个环境下同时表达的控制穗粒数的QTL。
3 讨论
3.1 旗叶性状与籽粒性状遗传关联解析
小麦是全世界最重要的主粮作物之一,提高产量一直是小麦育种家亘古不变的目标。旗叶是小麦花后主要的光合器官,大量研究表明,旗叶的长、宽和面积与小麦千粒质量、穗粒数和穗粒质量具有紧密的正相关性[9],即合理地增大旗叶长、宽和面积,可以增加光合面积,促进光合产物的形成,最终实现小麦产量的提高。此外,已有研究证实,控制关联性状的QTL在染色体上并不是均匀分布的,而是倾向于分布在相同或相近的QTL区间,即关联性状通常由紧密连锁的QTL调控,这一现象被称为QTL的“一因多效”或紧密连锁[27]。Keller等[28]在2A、4A和5A染色体上发现了多个能够同时影响小麦形态与产量这些紧密相关性状的QTL,这些QTL位于相同标记区间;Sourdille等[29]在2B染色体Xfbb121~XE38M60标记区间与7B染色体Xfbb121~XksuD18标记区间检测到2个同时控制光周期与抽穗期的QTL;Zhang等[30]利用包含168个家系的DH群体为材料,在4B染色体Xwmc718~Xwmc262标记区间同时检测到了控制叶绿素含量和产量的QTL,在5D染色体Xbarc320~Xwmc215~Xgdm63标记区间同时检测到了控制叶绿素含量、产量、抽穗期和开花期的QTL;王文文等[31]利用包含187个株系的RIL群体为材料,在5A染色体Xcfa2149~Xgpw2136标记区间检测到1个千粒质量和灌浆速率QTL。本研究也在1B、2A、2B、2D、3A、4A、4B、4D、6A、6D和7A染色体上发现多个调控紧密关联性状的QTL富集区。在1B染色体Xcfd48~Xbarc349标记区间同时检测到1个旗叶长QTL(Qfll-1B.3)、1个旗叶面积QTL(Qfla-1B)、1个千粒质量QTL(Qtgw-1B.2),并在相邻的Xbarc349~Xbarc308a标记区间检测到1个千粒质量QTL(Qtgw-1B.3);2D染色体Xcfd53~Xcfd2标记区间同时检测到1个旗叶宽QTL(Qflw-2D.2)、1个叶面积QTL(Qfla-2D.3)、1个穗粒质量QTL(Qgws-2D.1)和1个千粒质量QTL(Qtgw-2D.2);4A染色体Xksm71~Xwmc161标记区间同时检测到1个旗叶长QTL(Qfll-4A.1)、1个旗叶宽QTL(Qflw-4A.4)、1个旗叶面积QTL(Qfla-4A.3)和1个穗粒数QTL(Qgns-4A.1)。在这些富集区段中,相同标记区间检测到的旗叶性状QTL与籽粒性状QTL均具有相同方向的效应值,即同为正值或同为负值,这个现象一方面从QTL水平证实了旗叶长、宽、面积和千粒质量、穗粒质量、穗粒数是高度相关的,另一方面对这种QTL富集区域进行深入研究与挖掘,找出稳定表达的QTL,可为MAS育种与分子聚合育种提供数据支持。
3.2 QTL表达的一致性分析
QTL定位结果容易受到遗传背景、群体大小等因素的影响,因此,利用不同的作图群体检测控制同一性状的QTL,其结果往往很难具有复现性[32]。本研究也证实了这一现象,即本研究中检测到的105个旗叶与籽粒性状的QTL中,仅有极少数与前人报道重合。赵朋[33]在1B染色体Xgwm268~wmc134标记区间检测到1个旗叶长的QTL,本研究也在Xgwm268标记附近检测到了1个旗叶长QTL;Fan等[11]在4A染色体Xwmc161~Xgpw2331~Xwpt-4230~Xgpw7543标记区间检测到多个控制旗叶长、宽、面积及籽粒性状QTL,本研究也在Xwmc161标记附近检测到了1个旗叶长QTL、1个旗叶宽QTL、1个旗叶面积QTL和1个穗粒数QTL;Wu等[34]在2D染色体Xcfd53标记区间附近检测到1个穗粒质量QTL;Deng等[35]在Xcfd53标记区间附近检测到1个穗长QTL;Zhang等[30]在Xcfd53标记区间附近检测到1个旗叶叶绿素含量QTL和1个产量QTL,本研究也在Xcfd53标记区间附近检测到1个旗叶宽QTL、1个旗叶面积QTL、1个千粒质量QTL和1个穗粒质量QTL。由于作图群体、所使用分子标记类型不同,很多QTL无法对比是否是同一QTL区间,但通过对比前人研究仍可发现一些共性:Garcia-Suarez等[10]在2D染色体上检测到多个旗叶性状的QTL;常鑫等[14]在1A、2D、4A染色体上检测到多个旗叶性状的QTL。闫雪等[15]在4A染色体上、吕学莲等[16]在1B、2D、4B染色体上均发现了多个旗叶性状的QTL,本研究也在上述染色体上发现了控制旗叶性状的多个富集区。此外,本研究中检测到的5个具有较高贡献率的QTL(Qflw-4B.1、Qflw-4D.1、Qfla-4B、Qtgw-4B.2、Qtgw-4B.3)则未见前人报道过,这些QTL可能是新发现的QTL,对旗叶性状与籽粒性状的遗传资源挖掘具有重要意义。
3.3 环境影响与稳定表达的QTL
旗叶长、宽、面积和千粒质量、穗粒数、穗粒质量都是典型的数量性状,控制这些性状的基因容易受到环境影响[4-16],绝大多数只在特定的环境条件下才能表达[25],而这些依赖于特定环境表达的QTL,一般不能用于MAS育种,只有在多个环境能够被多次重复检测到的QTL才被视为是环境间稳定表达的QTL[32]。本研究中共检测到105个旗叶性状与籽粒性状的加性QTL,其中能在4个环境中同时检测到的QTL仅为2个,在3个环境中同时被检测到的为5个,2个环境中被检测到的QTL为19个,其余79个QTL均为依赖于环境特异表达的QTL。QTL定位的最终目的是能检测到在多个环境条件下稳定表达的QTL,本研究在3种或3种以上环境中被重复检测到的7个稳定表达的QTL为:Qflw-4A.1、Qflw-4B.1、Qflw-4D.1、Qfla-4B、Qtgw-4A.1、Qtgw-4B.2、Qtgw-4B.3。这些QTL都具有较高的LOD值(最高为17.93),并对表型具有较高的贡献率(最高能解释表型变异的39.91%),这也与前人研究结果一致。对这7个稳定表达的主效QTL进行深入挖掘与精细定位,对于MAS育种和基因克隆具有重要的意义。
