微波辅助提取工艺对大豆种皮水溶性多糖-蛋白乳状液乳化活性及表面电位的影响
2018-10-31范宏亮赵玲玲王胜男朱丹实韩金莲
范宏亮,赵玲玲,李 君,王胜男,朱丹实,刘 畅,韩金莲,刘 贺,*
(1.渤海大学食品科学与工程学院,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁 锦州 121013;2.锦州亿和豆业有限公司,辽宁 锦州 121016;3.锦州市产品质量监督检验所,辽宁 锦州 121013;4.盘锦宋大房食品有限公司,辽宁 盘锦 124000)
食品乳状液体系分水包油(oil in water,O/W)和油包水(water in oil,W/O)两种类型[1]。蛋白质、油脂、多糖是食品乳状液体系中重要的3类生物大分子,是影响食品稳定性和质构的主要因素,分子间的相互作用,体系的乳化活性、乳化稳定性并非这3种分子之间作用的简单加和[2-5]。O/W型乳状液能够通过絮凝、聚集、交联、分层等形式破坏整个体系的稳定性,因此在制备O/W型乳状液时需要加入表面活性剂,Mcclements等提出乳状液的稳定性可以通过添加多糖,形成“双层”或者“逐层”涂覆微滴从而改善乳状液的物理特性[6-7]。多糖可降低油-水界面张力,因而也降低了乳化时能量的消耗,有利于体系的乳化和乳状液的稳定[8]。多糖对乳状液稳定性的影响取决于蛋白质与多糖之间相互作用,这种作用大部分是共价键作用,部分非共价键作用(静电作用、疏水相互作用、氢键作用等)使多糖分子与蛋白分子在乳状液分子层界面上排列紧密,乳状液相对稳定[9-10]。向大豆分离蛋白乳状液中添加多糖,形成大豆分离蛋白与多糖共价复合物,其中多糖的引入是对蛋白质的一种改性或者是对其功能性质的强化,可提高蛋白质的乳化能力、乳化稳定性[11]。有报道称蛋白质与多糖的共价结合提高蛋白质的乳化特性,增加乳状液的黏度,乳状液的黏度仅取决于油体积分数,而不是油的种类[12-13]。
大豆种皮中含有丰富的果胶类多糖[14],大豆多糖的提取属于固液浸提过程,大豆种皮多糖与其近似[15]。国内外关于大豆种皮多糖研究目前开展了关于提取分离和初步理化性质分析方面工作,如Kalapatuy等[16]研究得知大豆种皮中半乳糖醛酸质量分数为60%~85%,刘贺等[17-22]研究发现微波辅助提取可显著提升多糖提取率,并研究了多糖的单糖组成等性质,所提多糖中总糖质量分数达82.36%,从所带电荷来看,一般包括中性糖组成及酸性糖组成,相对分子质量为2.293×105~4.094×105Da,为阐明大豆果胶类多糖结构与功能性质的关系奠定理论基础。但目前关于大豆种皮多糖-蛋白乳状液乳化方面的研究报道较少,课题组前期研究发现,提取工艺对多糖性质影响较大,因此本实验重点考察微波辅助提取工艺对以大豆种皮多糖为乳化稳定剂的多糖-蛋白乳状液性质的影响规律,以期为工业化生产大豆种皮多糖提供参考。
1 材料与方法
1.1 材料与试剂
大豆种皮 锦州大豆皮经销公司;乙醇(分析纯)天津市天力化学试剂有限公司;草酸铵(分析纯)天津市津东天正精细化学试剂厂。
1.2 仪器与设备
UV-2550紫外-可见分光光度计 日本岛津公司;NANO-ZS90 ZS-90粒度分析仪 英国马尔文仪器有限公司;Turbiscan LAB多重光散射仪 法国Formulaction公司;OA21002型精密电子天平 上海舜宇恒平科学仪器有限公司;L-535R型离心机、SL-250A型离心机 长沙湘仪离心机仪器有限公司;RE-3000型旋转蒸发仪 上海亚荣生化仪器厂;FJ-200型高速分散均质机 上海标本模型厂;SH-3型双显恒温加热磁力搅拌器 北京金紫光科技发展有限公司;SL-250A高速多功能粉碎机 浙江省永康市松青五金厂;DHG-9055A型电热鼓风干燥箱上海一恒科学仪器有限公司;AR224CN型电子天平奥豪斯仪器(上海)有限公司;PHS-3C型精密pH计上海雷磁仪器厂;WD800G型微波炉 格兰仕微波炉电器有限公司。
1.3 方法
1.3.1 大豆种皮水溶性多糖的制备
大豆种皮水溶性多糖的提取采用课题组前期研究方法[17],提取剂为草酸铵溶液,微波辅助萃取工艺参数的设置按照响应面试验设计方案。
准备材料(大豆皮)→干燥粉碎→加入乙醇溶液脱色、搅拌→过滤→滤渣干燥→取干燥后滤渣→加入萃取剂(草酸铵)溶液→微波处理→离心→取上清液→真空浓缩→调pH值→乙醇沉淀→干燥→大豆种皮多糖
1.3.2 大豆种皮水溶性多糖-蛋白乳状液的制备
配制50 mg/mL的大豆分离蛋白溶液,取40 mL,加入10 mL的大豆油。利用高速剪切机于10 000 r/min剪切1 min,制成50 mL的初级乳状液。将大豆种皮多糖配制成60 mg/mL的水溶液,与初级乳状液以1∶1(V/V)混合,并利用高速剪切机于10 000 r/min剪切1 min,最终使乳状液包含10%油、2%大豆分离蛋白、3%大豆种皮多糖[21],再加入0.02%叠氮化钠用来抑制微生物的生长,制成的乳状液于4 ℃贮存[23]。
1.3.3 响应面试验
参考刘贺等[17]微波辅助提取大豆种皮果胶工艺,结合本课题组前期单因素试验结果的基础,筛选出显著影响乳状液性质的大豆种皮多糖提取工艺的因素进行Box-Behnken试验设计[24],以所提取多糖制备乳状液的乳化活性指数(emulsifying activity index,EAI)、Zeta电位绝对值为指标,确定乳状液相关性质最佳的工艺参数。试验因素与水平见表1。
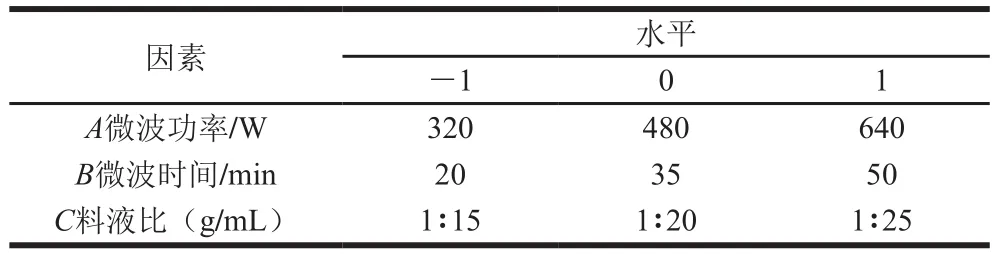
表1 响应面试验因素与水平Table 1 Factors and levels used in Box-Behnken design
1.3.4 乳状液EAI的测定
用微量取样器取出底部的乳状液5 0 μ L,用0.1 g/100 mL十二烷基硫酸钠溶液稀释到一定倍数后放入比色皿中,以相同的十二烷基硫酸钠溶液作参比液,立即测定其在500 nm波长处的吸光度A。根据赵国华等[25]的方法进行简化,乳化活性用EAI表示,见式(1)[26]:
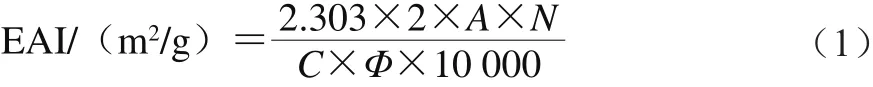
1.3.5 乳状液Zeta电位的测定
利用NANO ZS90激光粒度分布仪测定乳状液的Zeta电位,取1 mL稀释10 倍的乳状液于样品池中,在20 ℃条件下进行Zeta电位测定[27]。根据布朗运动理论计算电泳迁移(μep),见式(2):

式中:v为液滴速率/(m/s);E代表外加电场/V。
应用Henry关系计算出Zeta电位,见式(3):

式中:ε为液体介电常数;η为黏度/(Pa·s);ζ为Zeta电位值/mV;f(ka)为Henry函数。
1.3.6 多重光散射仪对乳状液稳定性分析
采用Turbiscan LAB多重光散射仪对乳状液进行扫描,可得到不同响应值随时间变化的曲线[28]。稳定性动力学指数(turbiscan stability index,TSI)是通过累计样品所有高度处前后两次扫描测量的光强度变化值,得到样品稳定性的评价指标,见式(4)[29-32]。对乳状液进行扫描,间隔1 min,共扫描20 min,进行TSI对比。
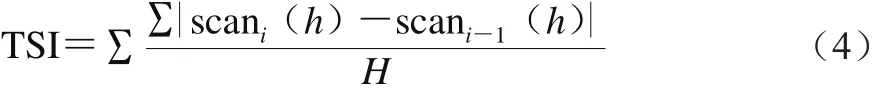
式中:h为扫描点高度/mm;H为样品总高度/mm;|scani(h)-scani-1(h)|为h高度处相邻两次扫描点光强度变化绝对值。
2 结果与分析
2.1 响应面试验结果
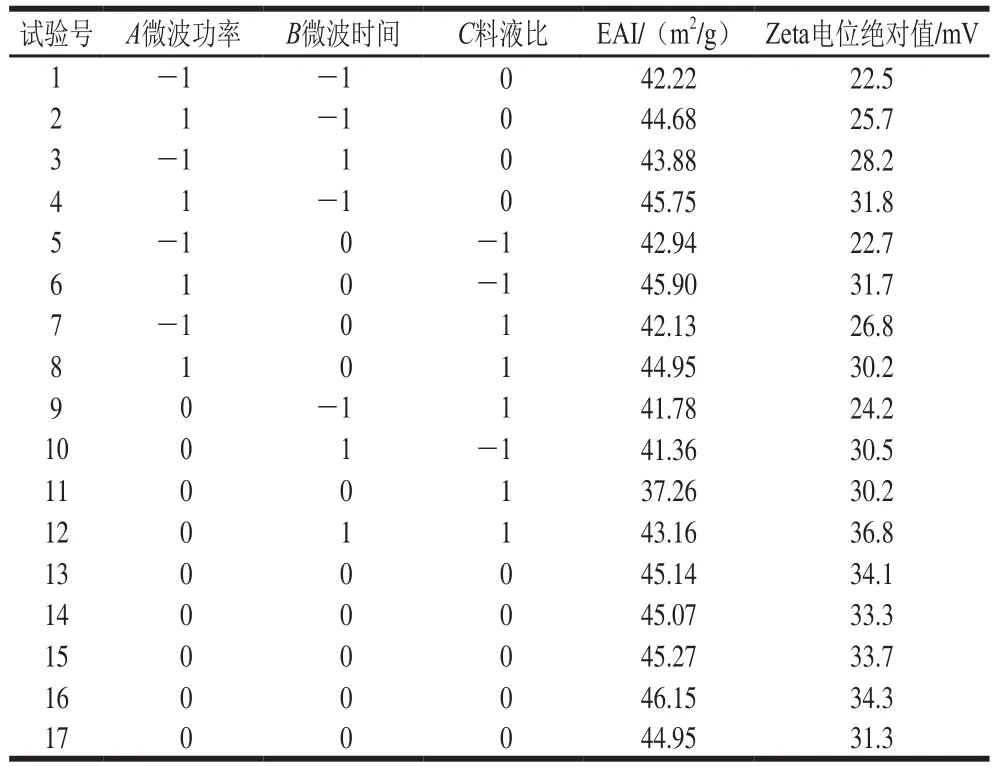
表2 响应面试验方案及结果Table 2 Experimental design for response surface analysis and corresponding experimental data
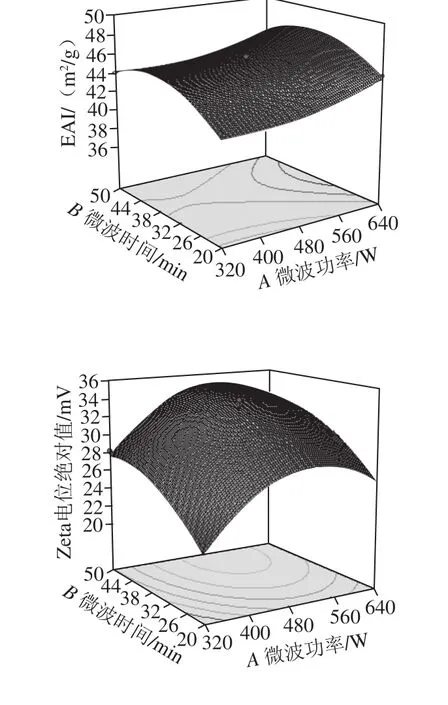
以EAI、Zeta电位绝对值为指标,进行3因素3水平设计,筛选影响响应值的主要因素。如表2所示,不同条件下EAI为37.26~46.15 m2/g,Zeta电位绝对值在22.5~36.8 mV之间,均优于大豆分离蛋白空白对照乳状液(EAI为16.31 m2/g,Zeta电位绝对值为21.5 mV)。根据表2的试验结果,进行方差分析,结果见表3、4。EAI数学回归模型为EAI=45.32+1.26A+1.03B-0.56C-0.15AB-0.035AC+1.58BC+0.95A2-2.14B2-2.29C2。
由表3可知,回归模型与响应值之间的关系具有极显著性(P<0.01),失拟项具有不显著性(P>0.05)。由表3可以看出,各因素中一次项A、B均极显著,C显著,其次是二次项A2显著,BC、B2、C2极显著,模型极显著。说明各因素对EAI的影响不是简单的线性关系。失拟项不显著,说明此模型对试验的拟合度较好,试验误差较小,故可用此方程预测不同微波作用条件对大豆种皮多糖乳状液乳化活性的影响。由表2可知,添加大豆种皮多糖的乳状液EAI值增加,微波功率480 W、微波时间35 min、料液比1∶20工艺下提取的大豆种皮多糖制备的乳状液EAI为46.15 m2/g,空白对照大豆分离蛋白乳状液EAI为16.31 m2/g,说明添加大豆种皮多糖后,乳状液乳化活性明显提高。过高微波功率作用使大豆种皮多糖构象改变,所获得的酸性糖组分和中性糖组分含量及分子质量发生变化[21],造成乳化性的降低,由于微波条件不同,导致大豆种皮多糖中总糖含量发生变化,具体结构差异有待后续深入研究。相比于大豆分离蛋白乳状液,蛋白质与多糖非共价键的连接改善了蛋白质的界面性质[33],增加了乳状液乳化活性。在此研究中,乳状液中的大豆分离蛋白与大豆种皮多糖之间能够很好地进行交融,大豆种皮多糖溶液带负电,大豆种皮多糖的增加略减少了大豆分离蛋白在乳状液中氮溶解指数,乳化活性有所下降,乳化稳定性显著提高[34]。在此方面,对于乳状液中分子间静电相互作用,在乳状液分子层界面上,多糖分子在蛋白分子外围排列紧密形成空间位阻[12],因此影响了乳状液EAI。各因素对EAI影响主次顺序为A(微波功率)>B(微波时间)>C(料液比)。试验模型的相关系数R2值为0.972 5,其矫正决定系数值为0.937 2,表示该模型的拟合度较好,试验误差相对较小,其回归方程可以很好地描述各因素与响应值之间的关系,可以利用该回归方程确定最佳提取工艺条件。
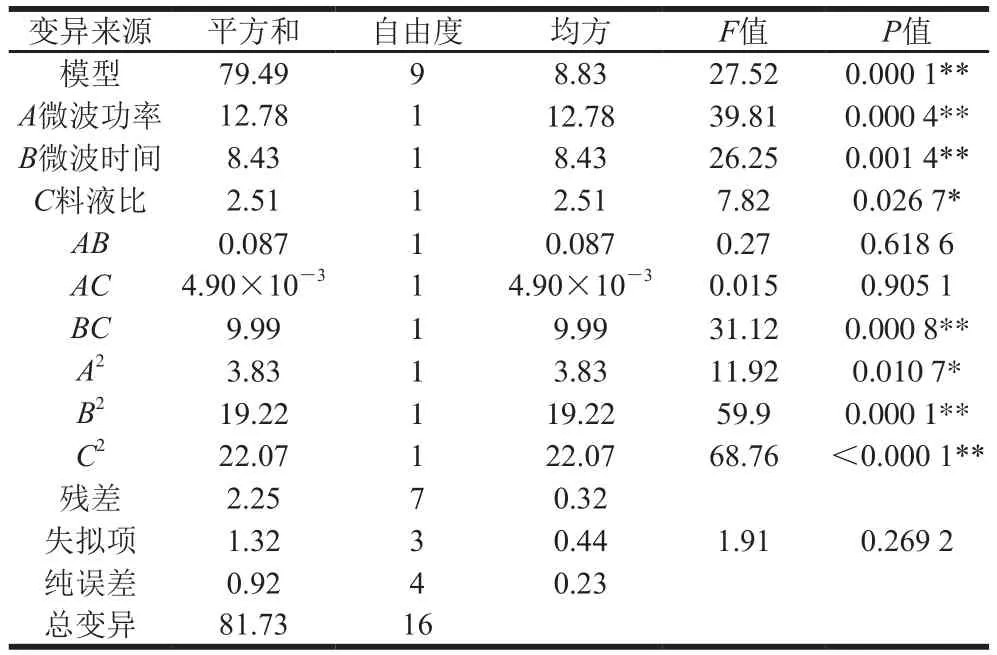
表3 EAI方差分析Table 3 Analysis of variance for EAI
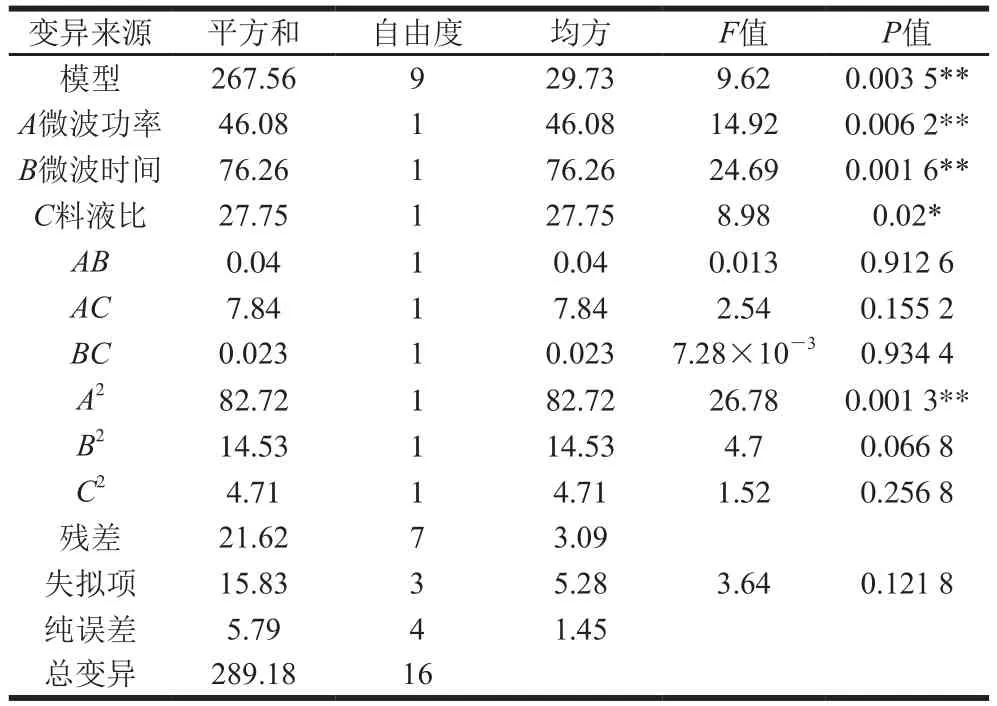
表4 乳状液Zeta电位绝对值方差分析Table 4 Analysis of variance for Zeta potential absolute value
对Zeta电位绝对值回归模型Y及其系数进行显著性检验,方差分析见表4。Zeta电位绝对值回归模型为Y=33.34+2.4A+3.09B+1.88C+0.1AB-1.4AC+0.075BC-4.43A2-1.86B2-1.06C2。
由表4可以看出,各因素中一次项A、B均极显著,C显著,其次是二次项A2极显著,模型极显著,失拟项不显著,说明此模型对试验的拟合度较好,试验误差较小,故可用此方程预测不同微波作用条件对大豆种皮多糖乳状液Zeta电位的影响。通过对比Zeta电位的相关数据,结合原理,根据课题组前期对大豆种皮多糖的单糖组成及分析[22],可能原因是大豆种皮多糖的中性侧链产生的空间位阻稳定乳状液,多糖连接到蛋白质表面,部分结构可以伸入两相中形成有效的乳状液保护层,降低界面张力,增强液滴间静电排斥或空间位阻[35],而粒子间的静电排斥作用只起到次要的辅助稳定作用。乳状液絮凝主要受界面层上发生的吸引和排斥作用影响,增强液滴间的静电可提高乳状液抗絮凝能力,由实验结果可知,添加大豆种皮多糖后乳状液液滴的Zeta电位绝对值增大,电荷量不断增加,说明添加大豆种皮多糖后,使蛋白颗粒间的斥力增大,从而提高乳状液的稳定性。得到各因素对Zeta电位绝对值重要性依次排序为B(微波时间)>A(微波功率)>C(料液比)。试验模型的相关系数R2值为0.927 0,其校正决定系数j值为0.829 1。
2.2 响应面分析与最优条件的确定
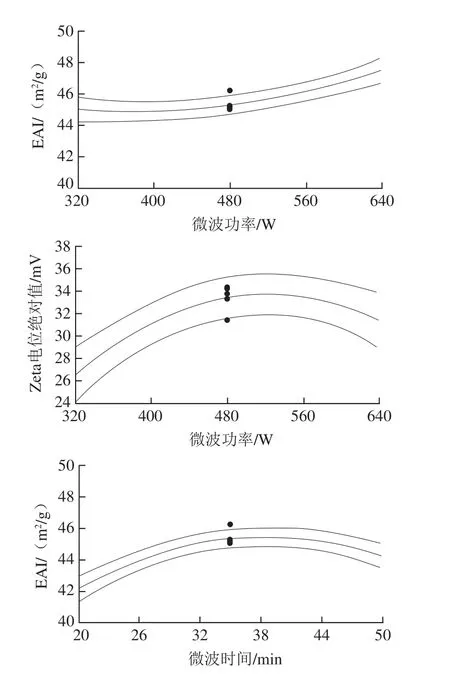
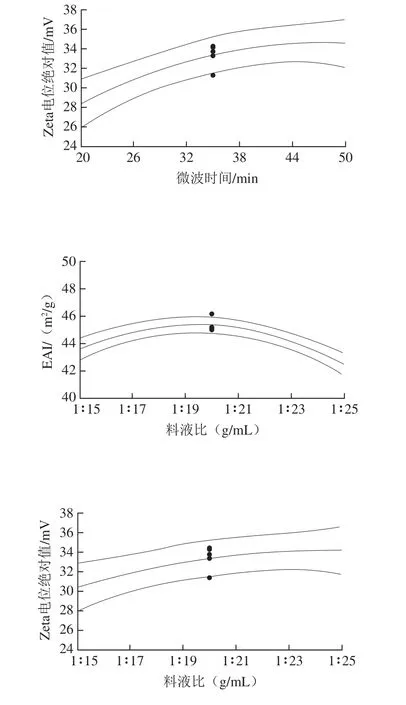
图1 各因素单独作用对指标影响的趋势图Fig. 1 Effect of individual factors on the response variables
通过图1可以看出,EAI随着微波功率的增加,EAI逐渐增大,而随着提取时间的延长呈现先增大后减小现象,料液比的影响具有同样规律。这说明提取出来的大豆种皮多糖的结构随着微波功率变化而变化[36],即微波作用条件的不同,导致了提取的大豆种皮多糖自身结构的变化[37-43],可能是由于多糖表面张力受到破坏,从而再次与蛋白质乳状液结合后,不能更好地发挥出乳化活性剂的作用,导致EAI发生变化。如图1所示,各个单因素对Zeta电位的影响中,Zeta电位绝对值随着微波功率的增大,先增大后减小,随着微波时间的延长,曲线上升趋势由明显变为舒缓,料液比的影响也具有同样规律。Zeta电位绝对值的大小关乎着乳状液是否絮凝和聚结,因为乳状液稳定性受界面电荷的影响,Zeta电位绝对值越大,说明颗粒间斥力越大,乳状液越不容易聚结,因而也就越稳定。微波作用条件的不同,可能导致大豆种皮多糖结构以及表面电荷的影响[44]。在食品乳状液中,多糖作为一种表面活性剂,对整个乳状液的稳定性起决定性作用。提取条件不同导致多糖表面电荷不同,从而影响电荷稳定,乳状液液滴的有效电荷与它的实际电荷不符。当带电荷偏离液滴表面时,它们的表面会出现带电不平衡现象,从而影响乳状液稳定性[45]。
通过图2可以看出,影响因素AB、AC、BC间存在两两作用,其中微波时间、料液比之间的交互作用明显,形状更接近于椭圆形。结合表3可知,虽然AB、AC交互作用不显著,但是三者间对EAI的影响存在规律。与EAI相比,Zeta电位绝对值的两两因素交互作用,明显优于EAI,尤其微波功率与微波时间的交互作用更强,图形接近椭圆形,并且结合图1可知,单因素对Zeta电位绝对值的影响非常显著,这与表4方差分析结果相符。
利用Design-Expert V 8.0.6软件对试验数据进一步分析,并对拟合的回归方程进行计算,预测最佳提取工艺为微波功率567 W、微波时间42.92 min、料液比1∶20.96(g/mL)。为考察试验结果的准确性与可行性,将验证工艺调整为微波功率640 W、微波时间43 min、料液比1∶21(g/mL)。此条件下的乳状液EAI为45.65 m2/g,Zeta电位绝对值为34.16 mV,接近预测值,但是并不是最佳的试验条件,因此根据试验结果,选取最佳乳化活性、稳定性较好的大豆种皮多糖提取工艺为微波功率480 W、微波时间35 min、料液比1∶20(g/mL)。此结果可能是由于根据实际情况所选取的工艺条件与验证实验实际相差较大,但是通过本次实验,得到了微波辅助提取工艺对大豆种皮水溶性多糖乳状液性质的影响规律,验证了外界因素对蛋白与多糖复合物乳化性能的影响[46]。为后续深层次剖析其乳化相关性提供了参考依据。
根据实验结果,选取最佳乳化活性、乳化稳定性的大豆种皮多糖提取工艺为微波功率480 W、微波时间35 min、料液比1∶20(g/mL),此条件下得到的最优多糖-蛋白乳状液EAI为46.15 m2/g,Zeta电位绝对值为34.3 mV。
2.3 多重光散射对不同提取条件TSI影响规律
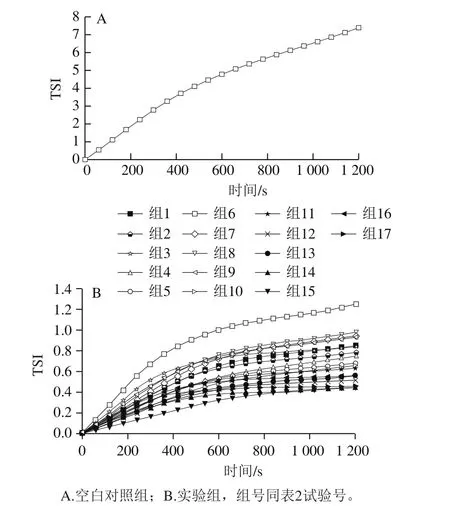
图3 不同提取条件所制备乳状液稳定性TSI值的影响Fig. 3 Stability TSI values of emulsions containing polysaccharides prepared under different extraction conditions
TSI稳定系数越小、斜率越小,表明乳状液越稳定[47]。如图3所示,添加大豆种皮多糖的乳状液TSI曲线斜率均小于大豆分离蛋白空白对照乳状液,20 min后,TSI整体小于1.3,大豆分离蛋白空白乳状液TSI大于7。说明在相同时间内,添加大豆种皮多糖的乳状液稳定性较好。从斜率变化趋势来看,添加大豆种皮多糖的乳状液TSI变化趋于平稳,乳状液逐渐趋于稳定[48]。第15组乳状液的稳定性最好,第14组其次。根据响应面设计方案,第13~17组为相同工艺条件下的平行实验,此工艺条件下乳状液稳定性相对较好。结合响应面分析获得的最佳工艺参数,并通过EAI、Zeta电位绝对值的分析,结果能够相互印证。
3 结 论
采用微波提取法提取大豆种皮多糖,通过响应面分析可知,3 个因素对大豆种皮多糖-蛋白乳状液乳化性影响顺序从大到小依次为微波功率>微波时间>料液比。经响应面试验,得出乳状液稳定性最优的大豆种皮多糖的提取条件为微波功率480 W、微波时间35 min、料液比1∶20(g/mL)。在此条件下乳状液EAI为46.15 m2/g,Zeta电位绝对值34.3 mV。多重光散射实验结果验证了此结论。本研究内容为工业化生产高乳化稳定性大豆种皮多糖提供参考。
