酶法消减花生浆中两种主要过敏蛋白的研究
2018-10-31石振鹏吴子健刘敏尧刘靓
石振鹏,吴子健,*,刘敏尧,刘靓
(1.天津商业大学生物技术与食品科学学院天津市食品生物技术重点实验室,天津300134;2.天津滨海诺奥酶工程技术有限公司,天津300300)
花生不仅富含油脂(其脂肪含量约为45%~56%), 还富含蛋白质(蛋白质含量为22%~30%)[1],是生产食用油重要的原料,也是重要的食品原料、以及食品添加剂、风味剂等,其已经被广泛应用于人们日常食品的生产与加工中[2-4]。然而,摄食花生或含花生的食品会导致众多花生过敏者严重甚至是致命的过敏反应,由其诱发的过敏反应为速发型,通常过敏者在摄入半小时后就会产生过敏,危害程度很高。2002年Bindslev-Jensen C等利用统计学分析发现牛奶、鸡蛋和大豆粉引起过敏反应的阈剂量(即1百万过敏者发生1例过敏的食物剂量)分别为 0.005、0.002、0.001 3 mg,而花生粉仅为0.000 7 mg[3]。在美国,约0.8%的儿童以及0.6%的成年人对花生过敏[4]。而我国民众食用花生的量不断提高,因而花生过敏反应的比例也在不断增加。目前已知的花生过敏原(分别为Ara h1、Ara h2、Ara h3、Ara h4、Ara h5、Ara h6、Ara h7、Ara h8、Ara h9、Ara h10和Ara h11)是一类分子量在0.7 kDa~100 kDa的糖蛋白[5],其中 Ara h1(63.5 kDa)和 Ara h2(16 kDa~17 kDa)是最主要的两种,分别占花生总蛋白的12%~16%和5.9%~9.3%,90%的花生过敏症患者对这两种蛋白过敏[6]。2006年Kagan等研究表明约75%花生过敏反应是由意外接触引起的,进而危及生命,占已报道与过敏相关死亡的59%[7]。因此消减花生、花生制品及其原料中过敏原至关重要,不仅可有效防止过敏,并且可以提高过敏者的生活质量,更可保护过敏者的生命安全。
目前,消减花生过敏原的方法包括热处理[8]、辐射处理[9]、酶法[10]以及基因工程法[11]。其中酶法是通过修饰或破坏花生抗原决定簇,进而降低其过敏性,是目前较为有效且安全的处理方式。2007年丛艳君[12]研究发现脱壳烘烤后的花生中所提取的蛋白经过碱性蛋白酶Alcalase酶解,其花生蛋白致敏性降低了34.5%。2006年尤丽丽[13]研究发现利用胰蛋白酶水解可有效将花生乳的致敏性降低61.6%。
本文通过采用复合蛋白酶制剂消减花生过敏原性的方法,将预处理过的花生仁浆通过控制酶用量,酶解时的pH值,温度以及时间来确定最佳消减花生过敏原性的工艺手法,消减情况通过双抗夹心酶联免疫吸附(enyme-linked immunosorbent assay,ELISA)法进行测定。
1 材料与方法
1.1 材料与试剂
花生:市售;食品级碱性蛋白酶(200 000 U/g)、中性蛋白酶(200 000 U/g)、木瓜蛋白酶(8 000 000 U/g)和风味酶(40 000 U/g):天津诺奥酶科技发展有限公司;BCA法蛋白定量试剂盒:北京百泰克生物技术有限公司;花生过敏原Ara h1酶联免疫分析试剂盒、花生过敏原Ara h2酶联免疫分析试剂盒:上海酶联生物研究所;其余试剂均为国产分析纯;试验所用超纯水均为天津商业大学生物技术与食品科学学院实验室自制。
1.2 主要仪器和设备
3-18K低温高速离心机:美国Sigma公司;KQ-500B超声波清洗器:昆山市超声波仪器有限公司;SpectraMax190光吸收酶标仪:美国美谷分子仪器有限公司;UPT-11-20T超纯水器:成都优普超纯科技有限公司;FiveEasy PlusTMpH计:瑞士METTLER TOLEDO公司;FDU-810型EYELA冷冻干燥机:日本东京理化公司。
1.3 试验方法
1.3.1 花生仁浆的预处理
取100 g脱壳花生仁经过研磨,加入100 mL蒸馏水打浆,然后沸水浴30 min,作为酶解底物。
1.3.2 复合酶酶解花生仁浆
将预处理好的花生仁浆中加入一定浓度的复合蛋白酶制剂溶液,调节其反应pH值,置于已调至所需酶解温度的恒温水浴箱内,酶解一定时间。然后提取蛋白并以ELISA法测定其过敏原性。
1.3.2.1 复合蛋白酶制剂的最佳配比优化
参考相关资料[12-13],初定酶解条件为酶用量2%,pH值7.0,酶解温度55℃,酶解4 h。
选用碱性蛋白酶(Alcalase,A)、中性蛋白酶(Neutrase,N)、木瓜蛋白酶(Papain,P)、风味酶(Flavorzyme,F)按照不同的体积比例的复合,其中以前3种酶为主。设置复配比例如下:
复合酶样品 1:A∶N∶P∶F=2∶1∶1∶1;复合酶样品 2:A∶N∶P∶F=1∶2∶1∶1;复合酶样品 3:A∶N∶P∶F=1∶1∶2∶1;复合酶样品 4:A∶N∶P∶F=2∶2∶1∶1;复合酶样品 5:A∶N∶P∶F=2∶1∶2∶1;复合酶样品 6:A∶N∶P∶F=1∶2∶2∶1;复合酶样品 7:A∶N∶P∶F=2∶2∶2∶1。
1.3.2.2 酶用量的优化
5份样品的复合蛋白酶制剂用量分别为1.0%、2.0%、3.0%、4.0%、5.0%。
1.3.2.3 pH值的优化
5 份样品的 pH 值参数分别为:6.0、6.5、7.0、7.5、8.0。
1.3.2.4 酶解温度的优化
5 份样品的温度参数分别为:45、50、55、60、65 ℃。
1.3.2.5 酶解时间的优化
5 份样品的酶解时间参数分别为:3、3.5、4、4.5、5 h。
1.3.2.6 酶解正交试验
在以上条件下所测得结果中,选择合适的参数进行正交试验分析,确定最佳方案。
1.3.3 花生蛋白的提取
将花生仁浆冷冻干燥后按10 mL/g的比例加入正己烷,于4℃振荡过夜脱脂,然后4℃离心(8 000 r/min,离心20 min),取沉淀冻干得脱脂花生粉。
参考Prakash等[14]的方法:将脱脂花生粉,按1∶20(g/mL)比例加入pH值为7.8的20 mmol/L磷酸盐缓冲溶液(含1 mol/L氯化钠),4℃振荡提取4 h,然后于4℃离心(14 000 r/min,离心10 min),取上清液,4℃透析(透析袋分子截留量为8 kDa~10 kDa)48 h之后冻藏备用。
1.3.4 蛋白浓度的测定
采用二辛可宁酸法(bicinchoninic acid,BCA)[15]测定花生蛋白溶液的浓度。
1.3.5 酶联免疫试验(ELISA)
使用Ara h1及Ara h2酶联免疫吸附分析试剂盒测定两种过敏原的浓度及消减情况,采用双抗体夹心酶联免疫吸附法。
2 结果与分析
2.1 复合蛋白酶制剂的配比试验结果
碱性蛋白酶、中性蛋白酶和木瓜蛋白酶进行复配使用进行花生浆的酶解克服了花生过敏原对于单一酶的抑制作用。各种酶的降解底物存在差异,将几种酶复配使用,各自的差异特性会产生协同增效作用,提高酶的催化活性。而添加风味酶能有效的改善因蛋白降解而引起的味道不适,增加酶解后花生浆的口感。7种复合酶样品酶解后Ara h1及Ara h2消减率变化如图1所示。
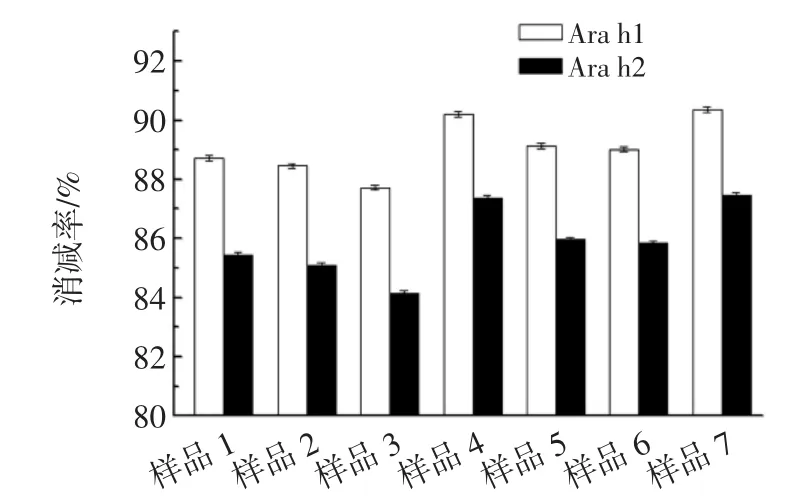
图1 复合蛋白酶比例对花生蛋白致敏性消减率的影响Fig.1 Effect of the ratio complex enzyme on the reducing allergenic property of peanut protein
由图1可知,样品1~3为分别单独增加前3种酶的用量是,花生致敏蛋白消减率的变化,此时致敏蛋白消减率为1>2>3,即碱性蛋白酶对致敏蛋白的消减作用强于中性蛋白酶及木瓜蛋白酶;由样品4~6可知,同时增加两种酶在复合酶中的配比,致敏蛋白消减效果最好的为样品4,Areh1消减率为90.21%,Areh2消减率为88.33%;样品7为增加了3种酶在复合酶的配比,Areh1消减率90.36%,Areh2消减率87.45%,与样品4相比,复合酶制备成本增加,但效果提升不明显,故选用A∶N∶P∶F=2∶2∶1∶1作为复合蛋白酶制剂的较优配比。
2.2 复合蛋白酶制剂的酶解条件单因素试验结果
2.2.1 酶用量对花生蛋白致敏性的影响
图2为酶用量对酶解后Arah1及Arah2消减率变化的影响。
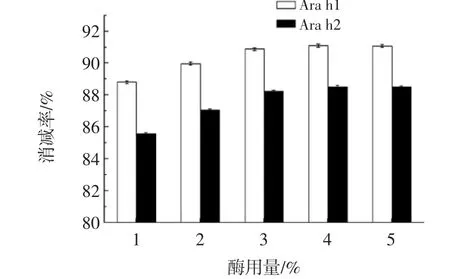
图2 酶用量对花生蛋白致敏性消减率的影响Fig.2 Effect of the enzyme dosage on the reducing allergenic property of peanut protein
由图2可知,随着酶用量的增加,花生致敏蛋白消减率呈增长趋势,当酶液浓度达到3%后,其消减花生蛋白过敏原性效果趋于平缓。这表明酶与底物的作用达到了平衡,继续增加酶量造成了成本的浪费。因此,选用3%为最适酶用量。
2.2.2 酶解pH值对花生蛋白致敏性的影响
复合蛋白酶制剂为多种酶的混合,需综合考虑各种酶的适用pH值范围,以确定最佳酶解条件。酶解pH值对Arah1及Arah2消减率变化的影响如图3所示。
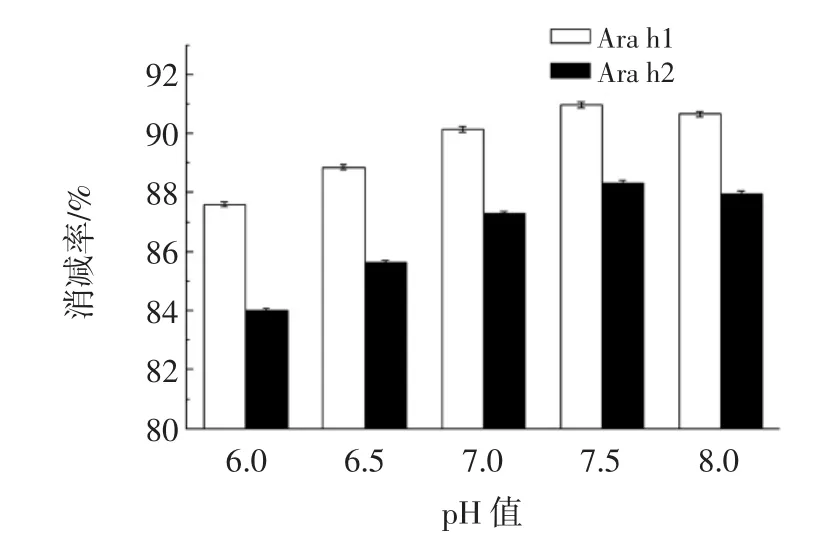
图3 pH值对花生蛋白酶解致敏性消减率的影响Fig.3 Effect of the hydrolysis pH on the reducing allergenic property of peanut protein
pH值对复合蛋白酶制剂酶解花生蛋白的效率影响较大,由图3可知,当pH值为7.5时,花生致敏蛋白消减率最高,Ara h1消减率为90.96%,Ara h2消减率为88.33%,此时仍处于碱性蛋白酶,中性蛋白酶与木瓜蛋白酶的最适pH值范围内,由于风味酶的主要作用在于改善花生仁浆的风味,且此pH值下风味酶的活性保持较好,故可选取7.5为最适酶解pH值。
2.2.3 酶解温度对花生蛋白致敏性的影响
酶解温度的选择与pH的选择类似,酶解温度对Ara h1及Ara h2消减率变化的影响如图4所示。
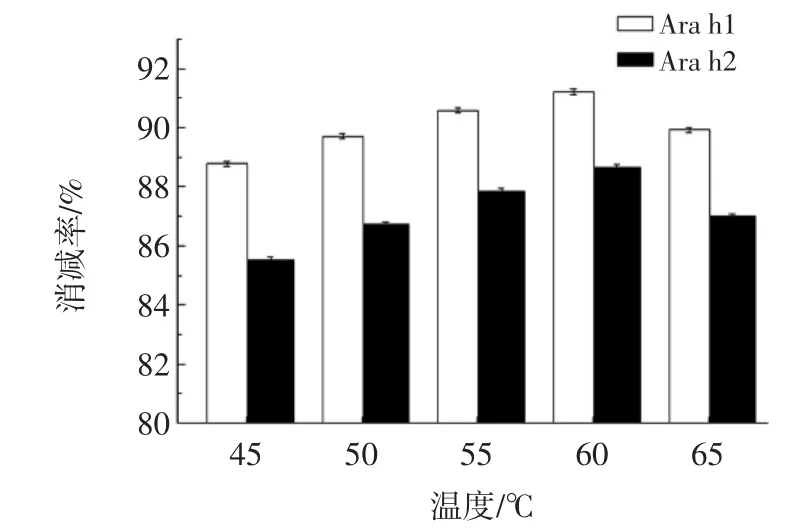
图4 酶解温度对花生蛋白的致敏性的影响Fig.4 Effect of the hydrolysis temperature on the reducing allergenic property of peanut protein
由图4可知,在60℃时复合蛋白酶制剂消减花生过敏原性效果最好,Ara h1消减率91.22%,Ara h2消减率88.67%。此温度下各种酶类仍能保持较高的活性状态,且当酶解温度较高时,有利于花生中油脂与食物蛋白的扩散,可以一定程度上加快酶解速度。这符合芦鑫等[16]的解释:最适酶解温度实际上是温度对酶活性和食物蛋白及油脂的扩散度影响。故确定最适酶解温度为60℃。
2.2.4 酶解时间对花生蛋白致敏性的影响
酶解时间对Ara h1及Ara h2消减率变化的影响结果如图5所示。
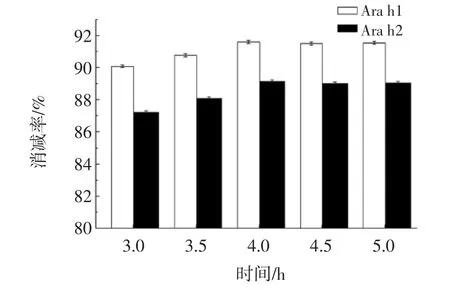
图5 酶解时间对花生蛋白致敏性的影响Fig.5 Effect of the hydrolysis time on the reducing allergenic property of peanut protein
由图5可知,酶解时间为4 h时,Ara h1消减率91.59%,Ara h2消减率89.15%,随着时间的继续增加,致敏蛋白消减率变化不是很大,考虑到时间成本,最适酶解时间为4 h。
2.3 复合蛋白酶制剂的酶解正交试验结果
根据单因素试验结果,选用酶解时间、pH值、酶用量以及酶解温度,以Ara h1和Ara h2的平均消减率为指标进行L9(34)正交试验。正交试验表及极差分析结果如表1所示。
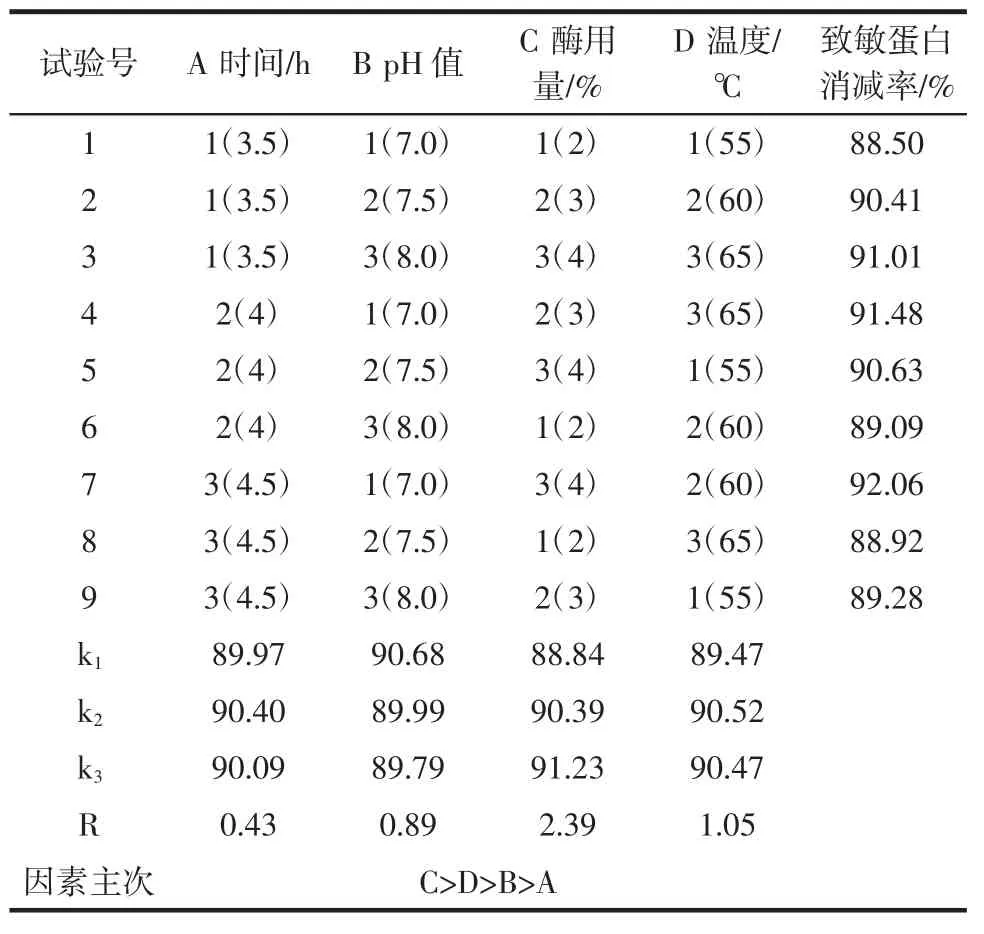
表1 复合蛋白酶制剂酶解正交试验及极差分析表Table 1 Orthogonal test and range analysis of enzymatic hydrolysis of compound enzyme
从正交试验验表得知9组试验中花生致敏蛋白消减率的较好方案为A3B1C3D2,由极差分析得出影响复合蛋白酶制剂酶解花生蛋白水解物致敏性的因素主次关系为C>D>B>A,即花生致敏蛋白消减率最佳条件组合为A2B1C3D2,与较好方案不一致,因此需进一步进行验证试验,试验结果如表2。
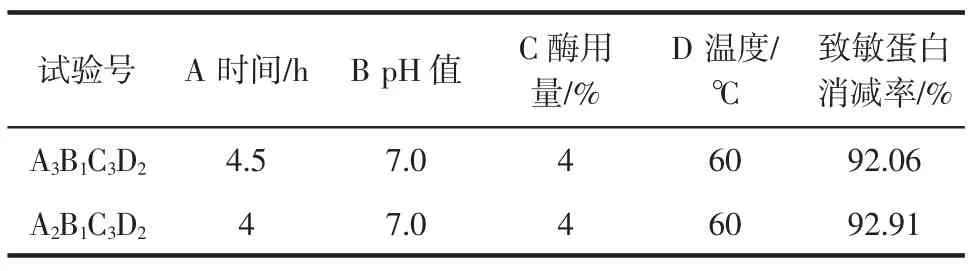
表2 复合蛋白酶制剂酶解验证试验Table 2 Complex enzyme preparation enzymatic verification test
由表2可知A2B1C3D2为复合蛋白酶制剂消减花生致敏性蛋白的最佳条件,在此条件下通过ELISA试验计算得到Ara h1消减率94.06%,Ara h2消减率91.75%。上述试验仅以花生致敏蛋白中最主要的两种Ara h1和Ara h2的消减率代表了花生致敏蛋白消减率,关于该种复合蛋白酶制剂对于其他非主要种类的致敏蛋白的消减率的测定需进一步的试验研究。
3 结论
得到一种复合蛋白酶制剂可有效地消减花生仁浆中Ara h1和Ara h2,各种酶的配比为,碱性蛋白酶∶中性蛋白酶∶木瓜蛋白酶∶风味酶的体积比为 2∶2∶1∶1。正交试验优化了复合蛋白酶制剂消减花生仁浆中Ara h1和Ara h2的水解条件:酶用量4%,酶解温度60℃,pH值7.0,酶解时间4 h。在该条件下处理所得的花生仁浆中的致敏蛋白Ara h1和Ara h2的平均消减率为92.91%
