雾化吸入抗NGF缓释微球抑制哮喘气道炎症的疗效探讨*
2018-10-31佘巍巍马礼兵林武洲赵海金
佘巍巍,马礼兵,罗 淼,林武洲,赵海金
(1.桂林医学院附属医院呼吸与危重症科/桂林医学院呼吸疾病研究所,广西桂林 541001;2.南方医科大学南方医院呼吸和危重症科/慢性气道疾病研究室,广州,510515)
神经生长因子(NGF)与过敏性和炎性疾病有关,在哮喘的病理生理学中起着重要的作用[1]。已有文献报道了抗NGF与支气管哮喘病理改变的关系,如网状基底膜的厚度、胶原蛋白厚度、气道壁厚度和NGF mRNA表达的关系[2-3]。然而,抗NGF在哮喘患者中的应用仍存在一定的困难。例如,关于抗NGF的具体机制及其药理作用尚不清楚。此外,抗NGF的短静脉半衰期,用药后的快速稀释和代谢,体内NGF抗体的中和作用都会影响其疗效。肺部因与外界相通且易于雾化吸入这一特殊的生理结构故常适合于医学上将其作为局部用药的给药部位,但对肺内雾化吸入缓释微球这一方法在肺部局部用药治疗疾病方面优越性,这些目前尚缺乏更多的报道[4]。因此,本研究采用免疫组织化学法观察雾化吸入抗NGF缓释微球(NGFM)对哮喘小鼠NGF表达的影响,并为哮喘的发病机制和治疗提供了新的实验数据。
1 材料与方法
1.1实验动物 雌性体健的8~10周龄BALB/c小鼠40只,由桂林医学院实验动物中心提供。
1.2仪器与试剂 牛血清清蛋白 (BSA,杭州四季青生物工程材料有限公司); 抗鼠NGF 抗体(美国Sigma);Masson染色试剂盒(福建迈新生物技术开发公司);羊抗鼠IgG、免疫组织化学染色(SABC)试剂盒及辣根过氧化物酶显色剂(武汉博士德生物工程有限公司);小鼠雾化吸入箱(自制)。
1.3方法
1.3.1抗NGFM的制备 用改进的高分子合金方法[5]制备抗NGFM。300 μg鼠抗-NGF抗体用0.5 mL含10 mg的BSA溶液混合。冷冻干燥条件:预冻温度50 ℃,以20 ℃/min的速率降温,其次将20 ℃孵化 3 h和20 ℃孵化12 h冷冻干燥处理后的冻干抗NGF粉均匀地分散在BSA矩阵中。将约300 mg的聚乳酸(PLA)、聚乳酸-羟基乙酸共聚物(PLGA)按质量比1∶3添加到一个试管中,将所制备的冻干抗NGF粉取出。然后将聚合物溶解在2 mL二氯甲烷形成的油相中,10 mL 2%的聚乙烯醇作为水相,水相加入油相,1 700 r/min 磁搅拌30 s,产生S/O/W型乳液,S/O/W型乳液转移至400 mL 10%氯化钠去离子水溶液中。室温下1 700 r/min 磁搅拌30 s。制备成256.7 mg抗NGFM,于4 ℃保存,用于后续实验。
1.3.2动物建模和分组 小鼠分为4组:对照组、哮喘组、抗NGF组和抗NGFM组,每组10只。除对照组外各组均于第 1、7天腹腔注射含卵清蛋白(OVA)的致敏液0.5 mL[含50 μg OVA和2 mg Al(OH)3混合液]腹腔注射致敏。然后抗NGF组:第15天起小鼠采用1% OVA约10 mL进行反复雾化吸入激发小鼠,每次雾化30 min,隔天1次,持续至第72天,并同时分别于以抗NGF抗体(4 mL/kg)腹腔内注射(隔天1次),观察小鼠症状,于最后一次腹腔注射抗NGF抗体后测定气道反应性。抗NGF微球组:于第15天开始小鼠采用1% 10 mL OVA进行反复雾化吸入激发小鼠,每次雾化30 min,隔天1次,持续至第72天,并同时分别于以抗NGFM雾化吸入治疗(每次雾化30 min,隔天1次)。对照组则参照相同的方案第1和7天腹腔注射磷酸盐缓冲液(PBS),第15天给予PBS雾化,每次30 min,隔天1次,持续至第72天。以上各组在第72天的24 h内处死小鼠,取肺组织作后续分析。
1.3.3肺功能测试 麻醉小鼠经腹腔注射10%水合氯醛。采用全身体积描记系统(美国Buxco电子有限公司)进行肺功能测试,先记录基线时的跨肺压、肺流量、潮气量等,随后记录吸入各组胺浓度后的(组胺雾化20 s以后)跨肺压、肺流量和潮气量等,计算出气道肺阻力和动态肺顺应性,气道反应性是用气道肺阻力和动态肺顺应性来表现。
1.3.4组织学检查 对支气管网状基底膜厚度的组织学检查,在切片距离200 μm分隔处的两个位置分别取出标体,在100 μm区间内取3点作为样本并记录其支气管黏膜网状基底膜厚度,以这3点样本的平均值做为网状基底膜厚度。用千分尺放大(×1 000)并从基底的支气管上皮下的网状层的外边缘厚度测量。使用计算机图像分析软件来测定平滑肌层、网状基底膜层厚度和气道壁的内外径。
1.3.5SABC免疫组织化学法检测NGF蛋白表达 将标本放入4%多聚甲醛固定,石蜡包埋,4 μm切片,采用SABA免疫组织化学法,一抗稀释比为1:50,显色后中性树胶封片,参照经典方法[8-9],记录NGF阳性反应区。
1.3.6病理染色 从右侧主支气管开口和从中、下支气管各取3个标本来进行活组织检查。经100 mg的苯巴比妥腹腔注射麻醉后,所有大鼠均行开胸手术。HE染色:肺组织5 μm石蜡切片,59 ℃烤箱熔蜡,二甲苯透明30 min,梯度乙醇脱水约10 min,苏木素染色约10 min,随后盐酸分化2 s,给予快速伊红染色,再梯度乙醇脱水,最后干燥行中性树胶并且封片。Massion 染色:肺组织5 μm石蜡切片,水洗后行苏木素染色,盐酸乙醇分化,1%酸性品红液染色,给予1%磷铝酸水溶液浸染,再行冰乙酸分化;然后给予苯胺蓝溶液染色,1%冰醋酸液进行分色,随后用95%乙醇、无水乙醇进行脱水;二甲苯透明,中性树胶进行封片。AB-PBS染色:肺组织5 μm石蜡切片,常规脱蜡至水,3%乙酸液洗2 min,加入1%阿利新兰醋酸液10~20 min,蒸馏水冲洗,0.5%过碘酸水溶液浸染5 min;然后蒸馏水冲洗,70%乙醇冲洗;Schiff液浸染15~30 min;流水冲洗10 min;苏木素淡染2~3 min,水洗;常规脱水、封片。观察左侧主支气管及其周围3个大血管的炎性细胞浸润程度,并得到平均值。采用光笔来描写平滑内外边界及气道基底膜的周长。检测基底膜的周长(BM)及平滑肌的面积(AM),并计算平滑肌的肌肉厚度为(μm)。

图1各组小鼠肺组织的病理图片(×400)
1.3.7RT-PCR检测 从活检组织中分离出总RNA,并反向转录为cDNA。 用RT-PCR检测NGF表达,以GAPDH作为内部控制。NGF正向引物5′-ATC CAC CCA CCC AGT CTT CCA CAT-3′, 反向引物5′-GGC AGC CTG TTT GTC GTC TGT TGT-3′;GAPDH正向引物5′-CCT CTG GAA AGC TGT GGC GT-3′,反向引物5′-TTG GAG GCC ATG TAG GCC AT-3′,反应条件:95 ℃变性5 min;95 ℃变性5 s,55 ℃退火5 s,72 ℃扩展15 s,40个循环。

2 结 果
2.1动物行为学及肺组织病理学 HE染色:哮喘组可见血管旁和呼吸道周围有许多的淋巴细胞、嗜酸性粒细胞等炎性细胞浸润,并且平滑肌层和黏膜下层增厚,气道的管腔明显狭窄;抗NGF组、抗NGFM组均较哮喘组气道重塑情况有明显减轻。Masson染色:哮喘组的胶原沉积多存在于气道上皮下和血管壁处,并有显著的增加现象,少量胶原沉积存在于肺泡间隔、小叶间及血管周围的结缔组织中;抗NGF组和抗NGFM组均较哮喘组有显著的减弱。AB-PAS染色:哮喘组可见AB-PAS阳性信号面积在气管上皮内有显著的增加,黏液杯状细胞增生。抗NGF组、抗NGFM组均较哮喘组黏液细胞增生减轻,见图1。在哮喘组,可见双侧鼻流鼻涕、呼吸急促和喘息。安静时,抗NGF组和抗NGFM组出现了轻微的症状。根据病理改变的程度,按严重程度依次为哮喘组>抗NGF组>抗NGFM组。
表1 NGF激发前、后小鼠平均气道阻力

组别n激发前激发后对照组100.18±0.0020.18±0.002哮喘组100.28±0.0010.37±0.031a抗NGF组100.25±0.0030.31±0.01ab抗NGFM组100.21±0.0020.24±0.02ac
a:P<0.05,与激发前比较;b:P<0.05,与哮喘组比较;c:P<0.05,与抗NGF组比较
2.2小鼠肺功能测试显示 NGF激发后在平均气道阻力方面,哮喘组>抗NGF组>抗NGFM组>对照组,差异均有统计学意义(P<0.05),见表1。在肺顺应性方面,对照组的动态肺顺应性值在激发前、后无明显差异。在NGF激发后对照组>抗NGFM组>抗NGF组>哮喘组,差异有统计学意义(P<0.05)。见表2。
表2 NGF激发前、后小鼠的平均动态肺顺应性
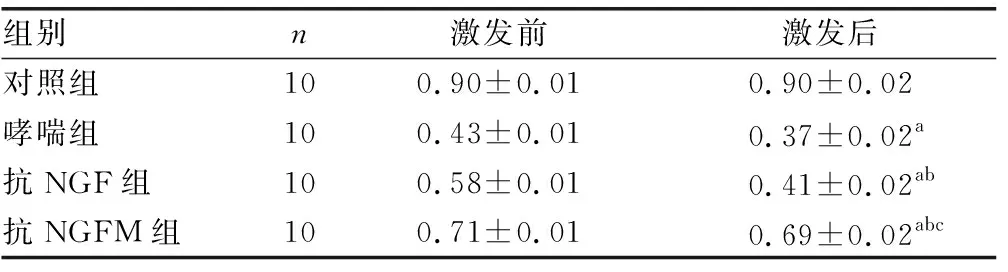
组别n激发前激发后对照组100.90±0.010.90±0.02哮喘组100.43±0.010.37±0.02a抗NGF组100.58±0.010.41±0.02ab抗NGFM组100.71±0.010.69±0.02abc
a:P<0.05,与激发前比较;b:P<0.05,与哮喘组比较;c:P<0.05,与抗NGF组比较
2.3网状基底膜厚度、胶原蛋白厚度及气道壁厚度 各组在小鼠肺组织网状基底膜厚度、胶原蛋白厚度及气道壁厚度比较可见抗NGFM组<抗NGF组<哮喘组,差异有统计学意义(P<0.05),见表3。

表3 网状基底膜厚度、胶原蛋白厚度、气道壁厚的比较
a:P<0.05,与对照组比较;b:P<0.05,与抗-NGF组比较;c:P<0.05,与哮喘组比较
2.4肺组织中NGF蛋白及mRNA的表达 表4显示了各组肺组织中NGF蛋白和NGF mRNA的平均灰度值。NGF蛋白及mRNA均为哮喘组>抗-NGF组>抗-NGFM组>对照组,两两比较差异有统计学意义(P<0.05)。

表4 4组小鼠的NGF蛋白表达与NGF mRNA的平均灰度值比较
a:P<0.05,与对照组比较;b:P<0.05,与哮喘组比较;c:P<0.05,抗NGF组比较
3 讨 论
最近的研究表明,抗NGF可能会拮抗过敏性哮喘的气道高反应性。哮喘可以诱导肺组织的NGF过度表达[3,6],NGF过度表达可能与哮喘发病机制中涉及的其他致病因素协同配合,诱发关键性肺损伤[2]。 NGF在哮喘[7]中起着“粘结”作用,合理的抗NGF调节可以有效地减少气道哮喘及肺组织的NGF过度表达[6],抑制气道重塑和炎症[3],从而延缓甚至逆转哮喘的进程。在本研究中,雾化吸入后的抗NGFM能附着在受损气道内的内皮外露神经末梢,导致神经末梢和神经递质释放的持续抑制,从而达到控制哮喘气道炎症的目的。
在肺功能测试中发现,气道流速的大小、气道阻力程度、动态肺顺应性值在抗NGFM组中均有明显抑制,提示抗NGFM可降低气道流速,改善气道阻力及动态顺应性,局部雾化吸入抗NGFM是较好的药物管理途径。本研究中在网状基底膜厚度、胶原厚度和气道壁厚度方面抗-NGFM和抗-NGF之间的差异明显,表明雾化吸入抗-NGFM可以显著抑制网状基底膜厚度、胶原蛋白沉积、哮喘气道炎症和气道壁厚度。抗NGF组与抗NGFM组之间的差异有统计学意义,提示腹腔内注射不能集中药物于肺内,可能会拮抗NGF在神经系统和其他器官的正常功能需要。
本研究显示NGF mRNA和NGF蛋白质在抗NGFM组中的表达明显低于抗NGF组,这提示与腹腔注射比较,雾化吸入治疗可更有效地减少NGF表达。基于以往的研究[3,8-9],抗NGF干预可拮抗气道高反应性和气道炎症,从而减少NGF的分泌,当抗NGF药物制成微球后,其对肺组织有亲和力,并选择性地将药物直接靶向相应部位。微球可以准确地递送到所需的部位,以连续或脉冲的方式释放活性蛋白,避免由于重复使用生物半衰期短的药物而给患者带来不便[10]。美国食品和药物管理局已批准微球配方作为人体的载体材料[11]。王世寿等[12]提出:肺部微球因载体材料的释药性能而具有缓释性,并因常用的材料有淀粉、聚乳酸等,具有生物可降解性、生物相容性和生物黏附性,故具有安全性,同时因微球在肺内局部作用故具有良好肺内靶向性,可提高药物的疗效。因此,如果抗NGFM可用于临床治疗哮喘,其可能会提供更好的治疗效果。然而,抗NGFM在人类身上的安全性和有效性还需要进一步研究。
总之,雾化吸入抗NGFM的治疗改善了哮喘小鼠肺的行为和病理变化,提示该药给予雾化吸入可能优于腹腔注射。这可能是因为雾化吸入给药可以增加局部血液的药物浓度并超过药物治疗的阈值浓度,此外,缓释微球是一种有效的控释制剂,能提高稳定性,降低机体损伤程度,具有良好的生物耐受性,使药物集中在靶区。这些特点可以改善药物治疗的疗效。
