RFA辅助椎体次全切除术治疗脊柱转移瘤手术效果及预后研究
2018-10-31赵芬芬
吴 军,赵芬芬,田 锋,关 涛,马 超,马 锋
(宁夏回族自治区人民医院:1.心内科;2.肾科,银川 750021)
晚期恶性肿瘤常存在骨转移,其中脊柱转移所占比达50.0%[1]。脊柱转移患者常伴有顽固性疼痛、神经压迫症状,且脊柱稳定性破坏,严重影响着患者生命健康。可行放化疗、免疫或激素治疗等姑息性治疗方案,但其无法实现对疼痛和脊柱稳定性的改善[2]。近年来,随着基础研究、影像学手段及外科手术技术发展,使外科手术治疗成为可能。椎体次全切除术因其创伤小、并发症少等优势,被证实对患者症状及生活质量等方面改善明显,但其无法达到杀灭肿瘤,存在着复发率高等局限性[3]。射频消融(RFA)是临床治疗肿瘤的新手段,研究显示,RFA对脊柱转移瘤患者疼痛缓解有效率达80.0%~90.0%,并能降低局部复发,延长生存期,但单独应用RFA无法重建脊柱稳定性,对神经功能障碍改善欠佳。因此,有研究就指出采用RFA联合椎体次全切除术治疗脊柱转移瘤,可实现同时改善患者疼痛、脊椎稳定性及神经功能等多种作用[4],但目前就两种方法联合是否可实现优势互补仍存争议。本研究就此展开比较,旨在为临床治疗提供指导。
1 资料与方法
1.1一般资料 选取本院2014年10月到2016年10月间收治的脊柱转移瘤患者84例,纳入标准[5]:(1)均符合脊椎转移瘤临床诊断标准,且经MRI/CT等影像学检查证实;(2)预计生存期大于或等于6个月;(3)均伴有神经功能障碍、疼痛等典型症状;(4)均满足本研究手术适应证;(5)均自愿参加本研究并签署知情同意书。排除标准:(1)原发性脊柱瘤患者;(2)合并严重的血液系统、免疫系统、内分泌系统或神经系统严重疾病患者;(3)合并其他脊柱骨折等其他脊柱疾病患者;(4)术后拒绝随访或随访资料不全者;(5)妊娠期或哺乳期妇女。采用随机数字表法将其分为对照组和观察组,每组42例。对照组患者男23例、女19例,年龄41~75岁,平均(55.02±6.25)岁,原发肿瘤:肺癌14例、乳腺癌11例、前列腺癌7例、甲状腺癌5例、肝癌4例、肾癌1例,共累及至61个椎体,包括T74例、T87例、T96例、T108例、T113例、T127例、L16例、L24例、L33例、L44例、L52例、S14例、S23例;观察组患者男24例、女18例,年龄40~76岁,平均(55.18±6.31)岁,原发肿瘤:肺癌13例、乳腺癌11例、前列腺癌8例、甲状腺癌5例、肝癌5例,共累及至62个椎体,包括T75例、T86例、T97例、T107例、T114例、T128例、L15例、L23例、L33例、L44例、L52例、S14例、S24例。两组患者在性别、年龄、原发肿瘤、病变阶段等一般资料比较,差异均无统计学意义(P>0.05),故具可比性。
1.2 方法
1.2.1对照组 患者术前接受CT及MRI检查确定受累椎体部位和数量、恶化程度、椎体完整性、椎弓根和椎板是否累及、脊髓受压情况等。患者全身麻醉后采取俯卧位,腹部悬空,以受累椎体为中心作纵行直切口,将锥旁肌分离,固定受累椎体上下1~2个椎体的锥弓,若累及椎弓根和椎板等附件,则先切除附件部分肿瘤,再根据脊髓受压情况进行选择性切除减压,后外侧减压可通过去除两侧椎体的上下关节突来达到目的,但要时刻注意出血量,若出血量过大也可进行单侧椎板切除进行减压,随后缓慢分离硬膜,分块清除其中的肿瘤压迫,以达到全方位的减压。若受累胸椎,可切除肋骨和结扎同侧神经根以便下一步切除,若受累腰椎则保留神经根。除此之外,切除受累椎体时还应切除对应的上下椎间盘,以帮助植骨融合。待所有病变椎体及受累部分切除后,将骨水泥加压注入切除部位中,边注入边观察其弥散情况,当骨水泥完全充盈切除部位后停止注入,一般注入量为4 mL左右,注入完毕等待骨水泥凝固后拔出骨穿针,用生理盐水冲洗手术区域,置入负压引流管,关闭手术切口。
1.2.2观察组 观察组在对照组的基础上联合RFA治疗,具体操作如下:实施单纯椎体次全切除术后,在C型臂X射线机下监视,采用11G或13G骨针经受累椎体的两侧锥弓根将UniBlate单极电极针(RITA1500X型)导入至病变区域。设置初始功率150 W,频率460 kHz,射频针温度85~105 ℃,根据受累椎体病变程度和区域设置消融范围,根据针尖裸露长度设置不同大小的消融灶。将电极针尖送入病灶中央后对受累椎体和病变灶进行消融,单点消融时间为5~15 min,消融过程中密切关注出血量、患者反应和生命体征的变化情况,根据实际情况调整射频针的位置,在无神经、血管的病灶区域消融范围可扩大至超过病灶边缘0.5~1.0 cm。充分消融后,对病灶区域部分进行加压骨水泥注入,方法同对照组相同。
1.3观察指标 (1)比较两组患者的手术时间、术中出血量及住院时间;(2)比较两组患者的渗漏(硬膜外渗漏、椎间孔渗漏、领椎间渗漏)、血管神经损伤、切口感染等并发症发生率;(3)术后随访6个月,比较两组患者手术前及手术后1、3、6个月的视觉模拟法(VAS)评分;(4)术后随访6个月,比较两组患者手术前及手术后6个月的脊髓损伤(Frankel)分级和美国东部肿瘤协作组(ECOG)分级改善程度;(5)术后随访1年,比较两组患者的复发率和病死率。
1.4评价标准 (1)VAS标准:0分为无痛,1~3分为轻度疼痛、可忍受、不影响睡眠,4~6分为中度疼痛、难以忍受、轻度影响睡眠,7~10分为重度疼痛、不能忍受、无法入睡或痛醒;(2)Frankel分级标准:A级表示受累椎体平面以下深、浅感觉均消失;B级表示受累椎体平面以下深、浅感觉均消失,但部分骶区感觉仍存在;C级表示受累椎体平面以下仅部分肌肉存在运动功能;D级表示受累椎体平面以下肌肉运动功能不完全,但可协助行走;E级表示深、浅感觉功能良好,肌肉功能完整,病理反射存在,大小便功能无障碍。(3)ECOG分级标准:0分为活动能力正常;1分为可自由活动,但不能从事重度活动;2分为生活能够自理,从事轻度活动吃力;3分为生活仅部分自理,需要长时间卧床或坐轮椅;4分为生活完全不能自理,卧床不起;5分为死亡。

2 结 果
2.1两组患者的手术时间、术中出血量及住院时间比较 观察组患者的手术时间、术中出血量及住院时间均明显低于对照组(P<0.01),见表1。
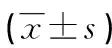
表1 两组患者的手术时间、术中出血量及住院时间比较
2.2两组患者的并发症发生率比较 观察组患者的硬膜外渗漏、椎间孔渗漏、领椎间渗漏等总渗漏率为2.38%,对照组患者的总渗漏率为19.04%,观察组明显低于对照组(χ2=6.10,P=0.01)。两组均无血管神经损伤与切口感染发生。两组患者手术骨水泥渗漏率,见表2。

表2 两组患者手术骨水泥渗漏率比较[n(%)]
2.3两组患者手术前、后各时间点的VAS评分比较 两组患者手术前的VAS评分比较差异无统计学意义(P>0.05),术后1、3、6个月,两组患者的VAS评分均明显低于术前(P<0.01),其中术后1、3个月,观察组患者的VAS评分明显低于对照组(P<0.01),术后6个月,两组患者的VAS评分差异无统计学意义(P>0.05),见表3。
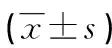
表3 两组患者手术前、后各时间点的VAS评分比较
a:P<0.05,与术前比较
2.4两组患者手术前后的Frankel和ECOG分级改善程度比较 两组患者手术前的Frankel和ECOG分级差异无统计学意义(P>0.05);手术后6个月,观察组患者和对照组患者的Frankel和ECOG分级均平均改善1级,且组间比较差异无统计学意义(P>0.05),见表4、5。
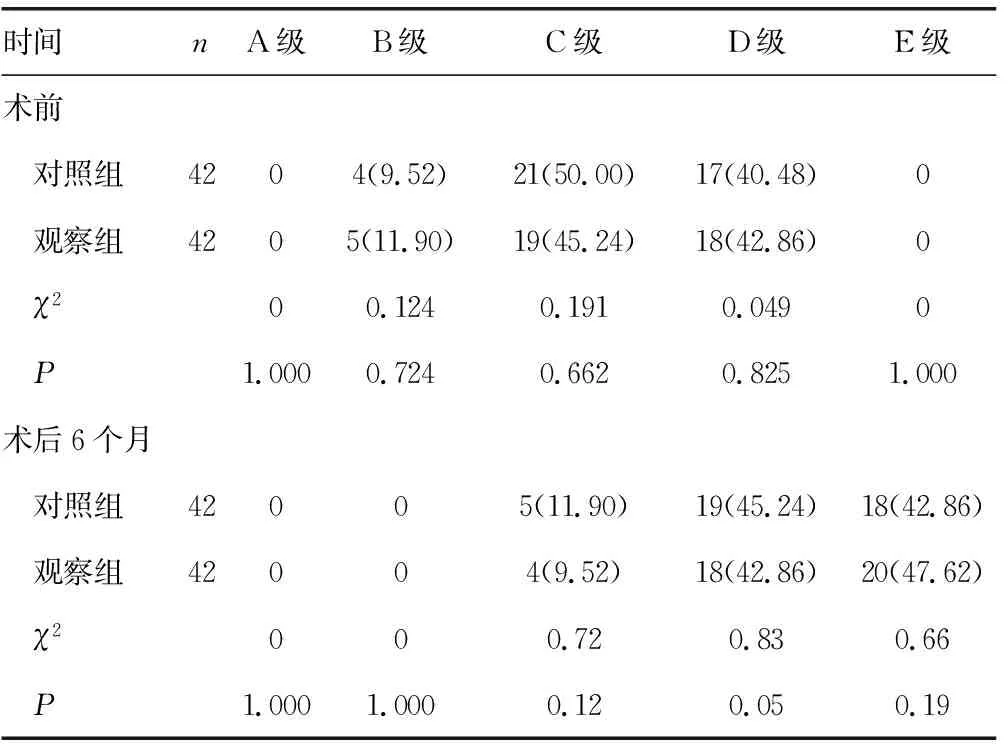
表4 两组患者手术前后的Frankel分级改善程度比较[n(%)]

表5 两组患者手术前后的ECOG分级改善程度比较[n(%)]
2.5两组患者的复发率和病死率比较 术后随访1年结果显示,观察组患者的复发率为16.67%(7例),对照组患者的复发率为64.29%(27例),观察组患者的复发率明显低于对照组(χ2=11.83,P=0.00),观察组与对照组患者的病死率[16.67%(7例)vs. 11.90%(5例)]比较差异无统计学意义(P>0.05)。
3 讨 论
脊柱是恶性肿瘤转移高发部位,常通过淋巴、血行途径转移,可导致患者顽固性疼痛、脊柱失稳、神经压迫等并发症,严重影响患者生活质量及生命健康。研究证实[6],解除神经压迫、恢复脊柱稳定性及缓解疼痛是治疗脊柱转移瘤的关键,而既往所采用的放化疗、肿瘤抑制法、激素、镇痛等姑息性治疗方案,整体疗效欠佳。脊柱转移瘤诱发疼痛产生的机制,包括脊柱稳定性降低,导致脊髓机械性压迫刺激疼痛,肿瘤细胞浸润及细胞因子刺激,引起脊柱周围神经化学性疼痛,因此针对病因治疗,对改善脊柱转移瘤疼痛至关重要[7]。外科手术可有效恢复脊柱稳定性,解除脊髓压迫,对脊柱转移瘤疼痛改善效果明显。
近年来随着脊柱外科技术发展完善,多种新型术式在脊柱转移瘤中得到应用,其中全椎体切除术和椎体次全切除术开展最为广泛,其中前者可有效根除椎体肿瘤,但对机体创伤较大,且术后并发症多[8],而后者创伤性低,手术时间、术中出血量及术后并发症明显降低,且能解除脊髓神经压迫,缓解机体疼痛感,但因未能有效根除肿瘤,术后复发率相对较高[9]。本研究结果同样显示,单纯椎体次全切除术术后1年患者的复发率达64.29%,与目前报道基本一致,因此需配合其他治疗方案。RFA是一种治疗恶性肿瘤的新型微创技术,其原理为利用450~500 kHz射频电极产生等离子震荡波,通过高热达到杀死局部肿瘤细胞的目的,同时电极经影像系统引导,可精确控制肿瘤消融范围和温度,使肿瘤周围血管电凝止血反应带,阻断肿瘤血供及降低术中出血量,且精确控制消融范围又可避免脊髓热损伤[10]。国内外文献报道[11],在椎体次全切除术前行RFA治疗,能首先起到杀死肿瘤细胞,破坏椎旁及椎内静脉丛,随后经椎体次全切除术清除肿瘤病灶,解除脊髓神经压迫,使肿瘤清除更为彻底,从而降低术后复发和骨水泥渗漏风险。本研究结果显示,观察组患者的手术时间、术中出血量、住院时间明显低于对照组,同时硬膜外渗漏、椎间孔渗漏、领椎间渗漏等并发症发生率明显低于对照组,术后随访1年显示,观察组患者的复发率明显低于对照组,其原因与RFA产生的肿瘤组织止血带,以及对肿瘤细胞定向杀灭作用有关。同时两组患者的术后6个月随访显示,Frankel和ECOG分级改善几乎全部达到1级,术后1年病死率无明显差异,证实椎体次全切除术对脊髓和神经受压及脊髓功能改善效果明显,与目前报道基本一致[12]。同时本研究结果显示,观察组患者术后VAS评分较对照组明显降低,表明RFA能更好改善患者疼痛,其原因与RFA对骨膜、骨皮质及肿瘤组织内末梢神经产热损坏,降低痛觉敏感度,同时肿瘤细胞坏死又可刺激肿瘤坏死因子和白细胞介素释放,降低破骨细胞活性,减轻炎性反应和化学性疼痛[13]。
综上所述,RFA辅助椎体次全切除术治疗脊柱转移瘤,可减少手术时间及出血量,缓解患者疼痛感,促进Frankel和ECOG分级恢复,且术后并发症发生率低,值得在临床推广。
