加拿大阿萨巴斯卡地区Mildred泥炭柱脂类化合物的组成特征
2018-10-31何大双黄海平侯读杰张鹏辉
何大双,黄海平,侯读杰,张鹏辉
(1.中国地质科学院 地球物理地球化学勘查研究所,河北 廊坊 065000;2.中国地质大学(北京) 能源学院, 北京 100083;3.卡尔加里大学 地球科学学院,艾伯塔省 卡尔加里 T2N 1N4)
0 引 言
泥炭是在沼泽环境下由死亡后未完全分解的植物体逐步堆积而形成的,在堆积过程中其生物源的输入和转化体现在泥炭有机质分子组成上。这些来源于生物有机体的分子具有一定的稳定性,虽受成岩、成土等地质作用的影响,但基本保持了原始母源先质的骨架结构,能够较为准确地提供古植被演替和古气候变化的信息,是越来越被重视的地质信息载体[1-2]。近几十年来,英国、欧洲和北美一些国家的地学、生物学、生态学和生物化学学者都十分重视泥炭沼泽有机地球化学的研究,Chamber等[3]、Charman等[4]用泥炭记录的地质信息来指示其沉积时期的生态因子和环境条件,例如泥炭的腐殖化度、植物残体、有壳变形虫、生物标志化合物、同位素及孢粉等及其与古植被、古气候环境之间的相互联系;Serebrennikova等[5]研究了西西伯利亚泥炭中有机质的组成,不同种类的成炭植物其脂类分子化合物分布存在差异,且与区域气候变化也有关系。近年来我国也加强了以泥炭为信息载体的生物环境变迁等方面的研究工作,如黄咸雨、谢树成等[2,6]论述了神龙大九湖泥炭脂类分子化合物分布和来源及其与环境气候的关系,建立了泥炭分子古气候和古水文指标体系;段毅[7]对甘南沼泽沉积脂类生物标志化合物的组成特征及来源进行了探讨;杨桂芳等[8]研究了天目山泥炭类脂物记录的微生物特征及其与植被演替的相关性;Liu 等[9]鉴别了德国北部泥炭中广泛分布的支链甘油二烷基甘油四醚化合物(GDGTs)的极性前驱物并探讨其地球化学指示意义。目前,国内报道的泥炭有机地球化学的研究多是集中在某一类或者某几类脂类化合物的基础上,关于泥炭沉积有机质中正构烷烃、正烷酮、正烷醛、正烷醇、脂肪酸、甾类、萜类化合物等精细研究的相关报道不多。本文通过对加拿大阿尔伯塔东北部现代泥炭沉积区泥炭脂类化合物地球化学特征进行研究,运用分子化石这样一个有效工具充实该区泥炭记录的生物植被信息,为后续进一步研究泥炭生态系统古植被演替及其对气候环境变化的响应特征提供理论依据,同时也为丰富我国泥炭有机地球化学基础理论内容,为泥炭脂类生物标记化合物的应用研究提供基础资料。
1 样品和实验
1.1 取样位置
研究区位于加拿大阿尔伯塔省东北部阿萨巴斯卡泥炭沼泽地区,地理位置为北纬56° 55′50.4″, 西经111° 28′ 30.3″。阿尔伯塔省东北部储有丰富的水资源,年降水量较南部多,从省城埃德蒙顿至北而上,属于杨木森林和草原地带,最北部是各种植被森林区,气候深受大陆性北极气候影响。阿尔伯塔省东北部Mildred泥炭地属于雨养型泥炭,植被的发育主要靠大气降水作为主要的水源和营养源。研究区采用荷兰Wardennar泥炭取样器对泥炭柱进行取样,泥炭柱厚度为48.0 cm,每1.0~1.5 cm进行切割,取得样品共37个,随后将样品密封并冷藏处理,待测。
1.2 实验方法
泥炭样品风干后进行研磨并过筛子(50目),除去样品中肉眼可分辨的、大的树枝和根茎类,收集混和均匀的、粒径小于0.3 mm的样品(小于5 g)用于抽提。抽提方法上,调研了近10年来泥炭有机质提取的实验方法[10-17],其中用到较多的是索氏抽提、加速溶剂抽提ASE(Accelerated Solvent Extraction)和超声抽提,通过对比这3种实验方法的优缺点,发现索氏抽提会导致抽提物受热,蜡质组分损失;加速溶剂抽提ASE能有效地节省时间并除去抽提液中的颗粒物质,但其GC-MS质谱图中存在较多污染峰且谱图显示异常,可信度不高;最后采用实验结果相对最佳的超声抽提方法提取泥炭有机质,抽提溶液为二氯甲烷(DCM)和甲醇(MeOH)的混合溶液(DCM: MeOH=90∶10,v/v);将溶有泥炭有机质的溶液在超声器中萃取30 min之后静置24 h,然后用玻璃棉和无水硫酸铜过滤,之后进行抽提;连续超声抽提3次直至抽提物无色。将抽提液蒸馏浓缩,浓缩后的样品移至量筒(10 ml)内,体积为aml,保证量筒内的溶液体积a小于或等于10 ml,取该溶液1 ml干燥后称重m1,得到抽提样品中溶解有机质的质量为a×m1。根据得到的有机质质量决定所加标样的浓度,一般有机质质量小于50 mg,所加标样为2 μl;大于50~100 mg,加标样5 μl,依次类推。在样品中添加内标物,混合均匀,取其1 ml抽提液移至进样小瓶进行GC-MS实验,剩余样品封样保存。值得注意的是,常温抽提过程中一些细颗粒物质能渗过玻璃棉,尤其是泥炭柱下部的样品,这样会导致一些细粒物质渗流入锥形烧瓶中,对后面定量分析造成影响。为了除去溶液中的细颗粒物,采用高速台式离心机(Centrifuge),将溶有样品的溶液移至离心管,然后将离心管置于台式离心机中进行离心运动,颗粒物质会沉降于离心管底部,离心管上部为较纯净的抽提溶液。GC-MS实验分析采用美国安捷伦色谱-质谱联用仪(Agilent 7890A-GC/5975C-MSD),色谱柱为HP-5熔融石英毛细管柱 (30 m×0.25 mm×0.25 μm),进样口温度为300 ℃,柱起始温度50 ℃,保持5 min,以4 ℃/min 升温至220 ℃,以2 ℃/min 升至320 ℃,保持 25 min;载气为氦气,流速为1 ml/min,扫描方式为全扫描和选择离子扫描。化合物的鉴定依据保留时间、GC-MS质谱数据库和质谱解析。通过各组分与内标峰的面积比,对目标组分进行定量。直链烷烃的浓度(μg/g)根据内标角鲨烷计算得到,甾、萜类极性化合物的浓度根据标样d4-C30胆甾烷计算得到。
2 结果与讨论
2.1 正构烷烃
正构烷烃主要以键能高的碳-碳键相连,在一定程度上能保持其原有的结构特征,相对含氧分子化石(酸和醇)而言, 正构烷烃是最不易遭受沉积后改造作用的一类分子化石,具有较高的稳定性,广泛应用于泥炭有机地球化学的研究中[10]。泥炭正构烷烃的分布一般呈明显的长链奇碳优势,分布于C20-C35之间,且主峰碳为C27、C29或C31,表明成炭植物以高等植物为主;当泥炭中藓类植物居多时,主峰碳则以C23或C25为主,部分苔藓植物也会出现C31主峰正构烷烃特征。由于不同生物体合成的正构烷烃链长不同,根据其分布特征,可以推测有机质来源,并判断低等植物、水生生物、藻类或高等植物对有机质的贡献大小[10-12]。
Mildred泥炭柱中正构烷烃分布于C17-C35之间,后峰型为主,具明显的奇碳优势,低碳数分子含量较低,以高分子量正构烷烃占主导(图1),主体体现的是高等植物来源的有机质分布特征,细菌、藻类等低等生物的贡献不明显。剖面上部(地表~ -3.93 cm),正构烷烃以C25为主峰,C27为次主峰,随着深度增加至-18.15 cm,C25或C31均表现出明显的主峰碳优势,随后C31含量显著增加,至剖面底部(-41.81~-48.02 cm),C27为主峰正构烷烃。碳优势指数CPI (Carbon Preference Index=(ΣC23-31(odd)+ΣC25-33(odd))/2×ΣC24-32(even))值范围为2.04~14.03,由上至下整体呈降低趋势;剖面上部表现出明显的奇偶优势,随着深度的增加,奇偶优势程度降低。CPI值在泥炭剖面中随深度发生变化可能与微生物贡献有关[8]。Huang等[13]对英国丘陵地区不同类型的现代土壤中CPI值研究表明,土壤剖面上部10~20 cm 处CPI值偏高,而35~45 cm CPI值降低到4~6,这可能是由于土壤中微生物活动与化学降解作用活跃的结果。Mildred泥炭柱中CPI值的明显降低可能是由深部微生物降解作用的增强导致,植物来源的脂类有机质经微生物改造后,奇偶优势变得不明显。

图1 Mildred泥炭柱正构烷烃分布(m/z 85 质量色谱图)及其主峰碳分布Fig.1 Mass chromatograms (m/z 85) and dominant carbon number of n-alkanes in the Mildred peat profile
文献中常用到的指示物源的正构烷烃代用指标包括:C23/C31和C23/C29正构烷烃指示苔藓类植物和高等植物的输入程度,Paq((C23+C25)/(C23+C25+C29+C31))一般用于区分潮湿环境下的水生植物或藓类植物与干旱条件下的陆源高等植物的输入差异[14],Pwax((C27+C29+C31)/(C23+C25+C27+C29+C31))和ACL(Average Chain Length=23×C23+25×C25+…+33×C33/(C23+C25+…+C33))多用于对比具有长链分子化合物的高等植物与具中-短链分子的水生植物或苔藓类植物的输入差异[12,14]。Magnan等[15]对Mildred泥炭地植物化石剖面研究表明,阿萨巴斯卡泥炭沼泽地区现今Sphagnumsect.Acutifolia泥炭藓类大范围发育,以锈色泥炭藓(S.fuscum)为主,而锈色泥炭藓呈现C25或者C31主峰正构烷烃分布特征。本文中首次提出了C23/(C27+C31)正构烷烃这一代用指标,避免混淆高等植物中的高分子量烃类与锈色泥炭藓中高碳数烃类,能够有效区分泥炭藓类和陆源高等植物的输入差异。
本文根据以下4个方面可以判断Mildred泥炭柱成炭植物的输入类型:(1)Mildred植物化石资料中,泥炭柱上部成炭植物多为锈色泥炭藓,剖面中部木质碎屑和木本植物相对含量最高,底部莎草科草本植物含量增加,存在少量的木本植物类;(2)根据正构烷烃参数分布特征将Mildred剖面分为三段,即M1、M2和M3,其中M1代表地表至-17 cm段,M2代表-17 cm至-42 cm段,M3代表-41 cm至底部(图2)。C23/(C27+C31)与C23/C29比值分布十分相似,随深度先减小后增大,M1中C23/(C27+C31)和C23/C29值较大,分别介于0.11~0.72和0.38~1.8之间,-17cm以下,两个比值由小逐渐增大,分别分布于0.02~0.38和0.03~0.9之间,剖面上部和中下部呈现出明显不同的分布特征;(3)正构烷烃的主峰碳分布具有显著的分段性,M1中主峰正构烷烃为C25或C31,与锈色泥炭藓对应;M2中正构烷烃C31占主导,其次是C27和C29;M3中优势正构烷烃为C27;(4)实验过程中,样品过筛子发现,M1中的样品多为苔藓类植物,样品干燥后水分损失可达到93%;-17 cm以下的样品主要是木质碎屑、根系或木炭,研磨后细颗粒物较多,M2和M3中样品水分损失为45.1%~88%。综上所述,Mildred剖面上部M1中成炭植物以锈色泥炭藓为主,而M2和M3以木本植物为主。

图2 Mildred泥炭柱正构烷烃参数分布Fig.2 Distributions of n-alkane proxies in the Mildred peat profile
泥炭藓属Sphagnumsect.Acutifolia是现今Mildred泥炭区主要的成炭植物[15],其中锈色泥炭藓分布广泛,数量较多,其次是尖叶泥炭藓。锈色泥炭藓正构烷烃多以C25为主峰,且多发育于气候干燥条件下。根据地化分析,Mildred剖面上部锈色泥炭藓的富集使得正构烷烃以C25为主峰,而C31主峰分布是由于尖叶泥炭藓的富集。剖面中下部M2和M3中根丝、木质碎屑、莎草科、杜鹃花科(叶)、黑云杉等为主要的成炭植物。M3中正构烷烃主峰碳由C31变为C27,可能归因于莎草科的含量增多。莎草科中存在以C31为主峰正构烷烃的植物类型,如Eriphorumangustifolium、Carexpetitiana或Cladoniaspp.,也存在以C27为主峰正构烷烃的植株类型,如Carexbigelowii、Betulaspp.、Larixsibirica等[16-17],故M3中莎草科类植物的增加可能导致正构烷烃主峰碳由C31向C27转变。将上述结论与该地区的植物化石资料进行对比,植物化石的分布与脂类化合物揭示的物源输入的结论是相吻合的。
2.2 正烷酮
正烷酮是一类具有重要生源和环境意义的生物标志物,也是泥炭中重点研究的一类化合物类型。正烷酮广泛存在于海相和湖相沉积物、泥炭、土壤等有机体中[18-19]。本文中正烷酮指的是直链烷基-2-酮,英文名为n-alkan-2-one或者ketone,为了与正构烷烃区分开,本文用Kn代表不同碳数的正烷酮。一般在陆生和水生环境中,高等植物、苔藓类和浮游植物等贡献主峰碳为K25或K27的正烷酮类;而细菌和藻类等生物主要贡献以K22以下短链为主的正烷酮化合物[20-21]。
Mildred泥炭柱正烷酮的分布与正构烷烃相似,分布在K21至K33之间,呈单峰-后峰型分布,以高碳数链烷烃为主,具有明显的奇碳优势,主峰碳多为K27。-18.15~-24.42 cm及-27.32 cm处的样品正烷酮以K29为主峰,-40.7~-41.81 cm段以K25为主峰(图3)。剖面底部检测到的正烷酮丰度明显降低。正烷酮碳优势指数CPI-ket值介于1.88~7.01之间,且随深度呈明显降低的趋势。由于正烷酮的来源不单一,植物输入和微生物作用都可以形成正烷酮,CPI-ket的垂向变化指示其可能与微生物活动有关。
正烷酮参数K27/(K29+K31)和ACL-ket能很好地表征物源输入差异[22](图4)。M1中K27/(K29+K31)值区间为1.05~1.84,K27占优势,与泥炭藓植物中K27的优势分布是相对应的,说明M1中有机质主要是泥炭藓贡献的;M2中K27/(K29+K31)值分布在0.39~1.22之间,M3中分布于0.99~2.22之间,呈现明显的分段性,这是由于植被输入差异导致;M2中陆源高等植物输入显著,导致K27/(K29+K31)比值显著降低,而M3中由于莎草科类植物的大量聚集,木本类植物降低,使得K27/(K29+K31)值逐渐增大。正烷酮的平均链长ACL-ket与K27/(K29+K31)表现出的特征是一致的,M1中ACK-ket值较低(26.63~27.62),且随深度呈降低趋势;M2中ACL-ket值分布于27.26~28.22之间,值相对较高,与ACL正构烷烃一样体现的是高等植物输入特征;M3中该比值逐渐降低,主要受莎草科植物输入的影响。微生物作用也可能影响K27/(K29+K31)和ACL-ket的分布,特别是在剖面的下段,微生物作用也会导致ACL-ket值的降低。

图3 Mildred泥炭柱正烷酮分布(m/z 59 质量色谱图)及其主峰碳分布Fig.3 Mass chromatograms (m/z 59) and dominant carbon number of n-alkan-2-ones in the Mildred peat profile

图4 Mildred泥炭柱正烷酮参数K27/(K29+K31)和平均链长ACL-ket分布Fig.4 Distributions of n-alkan-2-one proxies of K27/(K29+K31) and ACL-ket in the Mildred peat profile
结合前人的研究成果[20-22],Mildred泥炭柱正烷酮的来源体现在以下三个方面:正构烷烃的微生物氧化作用是形成相应正烷酮的主要路径;泥炭藓等成炭植物的输入对正烷酮的富集有一定程度的贡献,主要体现在泥炭柱的上段;脂肪酸的微生物β-氧化和脱羧基作用也是形成正烷酮的有效路径,但其成因机制仍需进一步深入研究。
2.3 正烷醇
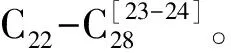
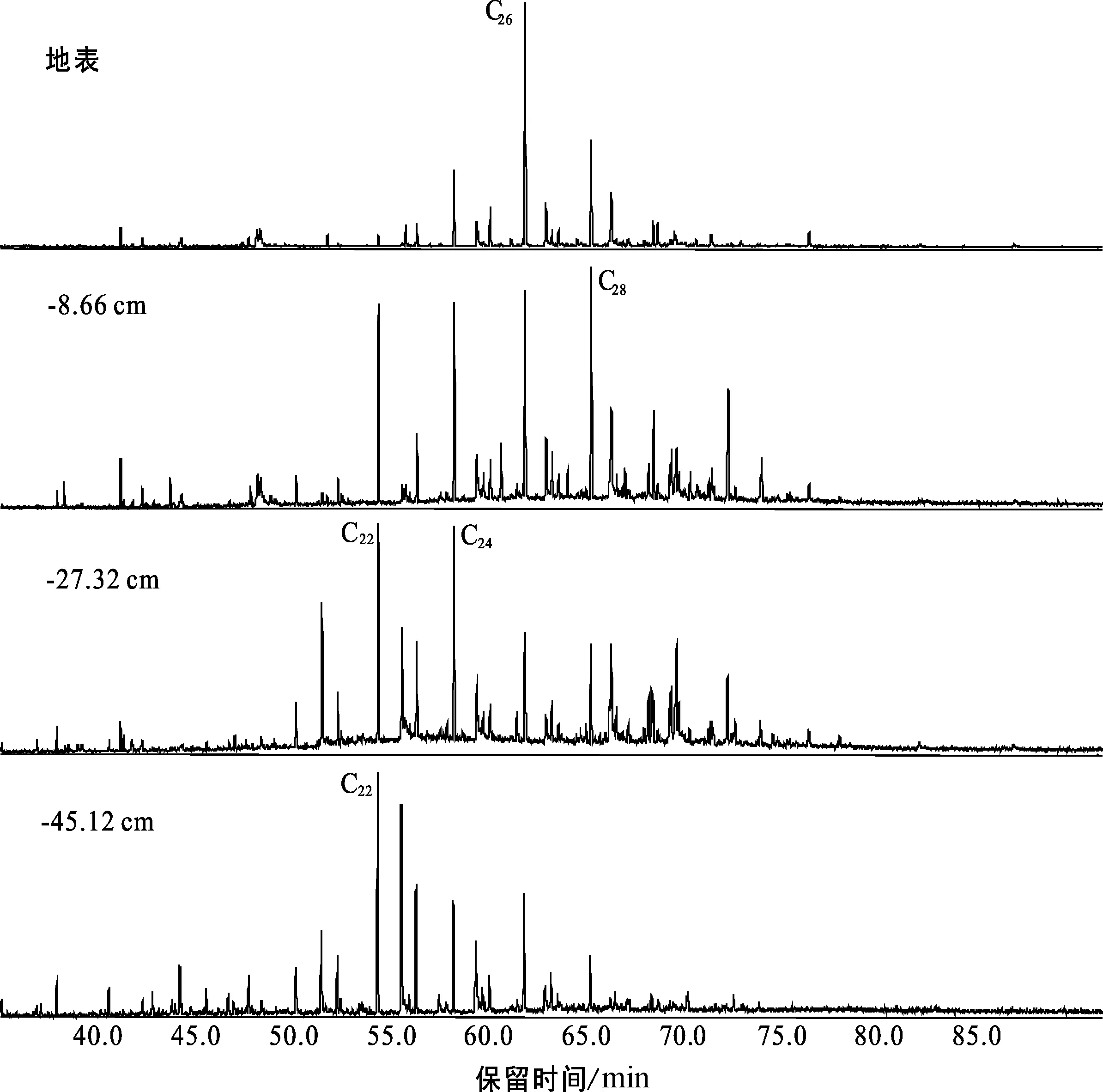
图5 Mildred泥炭柱正烷醛分布(m/z 82质量色谱图)Fig.5 Mass chromatograms of n-alkanals in the Mildred peat profile (m/z 82)
离Mildred泥炭地南向数十公里的McMurray泥炭地中检测到了丰度较高的正烷醇类化合物(m/z 75),而Mildred泥炭柱中基本检测不到或含量很低难于检测。McMurray正烷醇分布于C22-C28,偶碳优势明显,主峰碳为C26或C28,高碳数的正烷醇可能来源于陆生植物和浮游水生植物[24]。正烷醇是脂类化合物的一类组成部分,分析泥炭脂类化合物组成特征时应当考虑其中。
2.4 正烷醛
研究区泥炭样品中还检测出了正烷醛类化合物,这一类化合物在文献中少有研究,由m/z 82特征碎片离子检测。正烷醛的分布范围在C20-C32之间(图5),主峰碳为C26或C28,剖面底部样品呈C22或C24优势分布,明显的偶碳优势,长链正烷醛占主导,与McMurray泥炭地正烷醇的分布具有一定的相似性,正烷醛类化合物的分布同样指示其与高等植物或藓类植物有关系[25]。
长链正烷醛在许多常见的沉积环境中都可能见到,高等植物中正烷醛可能形成于从脂肪酸转化为脂肪醇的生物合成作用的中间产物,并可积累成为表皮蜡成分[25],这类化合物很容易发生成岩蚀变作用,推测只有在保存条件较好的情况下才能检测到[12],这可以解释剖面上部泥炭样品中正烷醛化合物遭受微生物活动较弱,保存条件相对较好,故检测到的浓度高于底部。Mildred剖面下部的样品正烷醛浓度降低,指示其在成岩作用过程中可能遭受微生物降解[25-26]。目前关于正烷醛的研究成果有限,根据其分布特征可初步判断主要是植物来源,也可能由正构烷烃或其他功能团的分子化合物转化而来,这方面的研究还需进一步深入。
2.5 脂肪酸和脂肪酸甲酯
脂肪酸在海洋、土壤、湖泊、泥炭中均有存在,是构成生物体细胞的主要成分之一[27]。脂肪酸的结构具多样性,同时也具有高度的生物专一性,不同的生物具有不同的脂肪酸结构,一般高分子量的正构脂肪酸具有偶碳优势,沉积物中脂肪酸多半保存了生物体中的某些分布特征,因此在判断沉积物中有机质的来源时,脂肪酸发挥了重要的作用[28]。和烃类组分一样,脂肪酸分布型式及其主峰碳在指示物源方面也有重要意义:一般以细菌源为主的脂肪酸分布在C8-Cll范围,主峰碳为C9,在色谱图上以独立的峰群出现;脂肪酸C12、C14、C16存在所有生物体中,包括藻类、细菌、真菌和高等植物等生物体;高含量的短链饱和脂肪酸C12-C20认为是来源于浮游生物和细菌;链长度在24以上的长链脂肪酸指示高等植物输入,长链脂肪酸C26、C28等是陆生植物树叶蜡、花、孢子等的主要化合物;中链脂肪酸C22、C24是沉水或水生植物的标志化合物[28]。

图6 Mildred泥炭地脂肪酸分布(m/z 73质量色谱图)Fig.6 Mass chromatograms of n-fatty acids in the Mildred peatland (m/z 73)
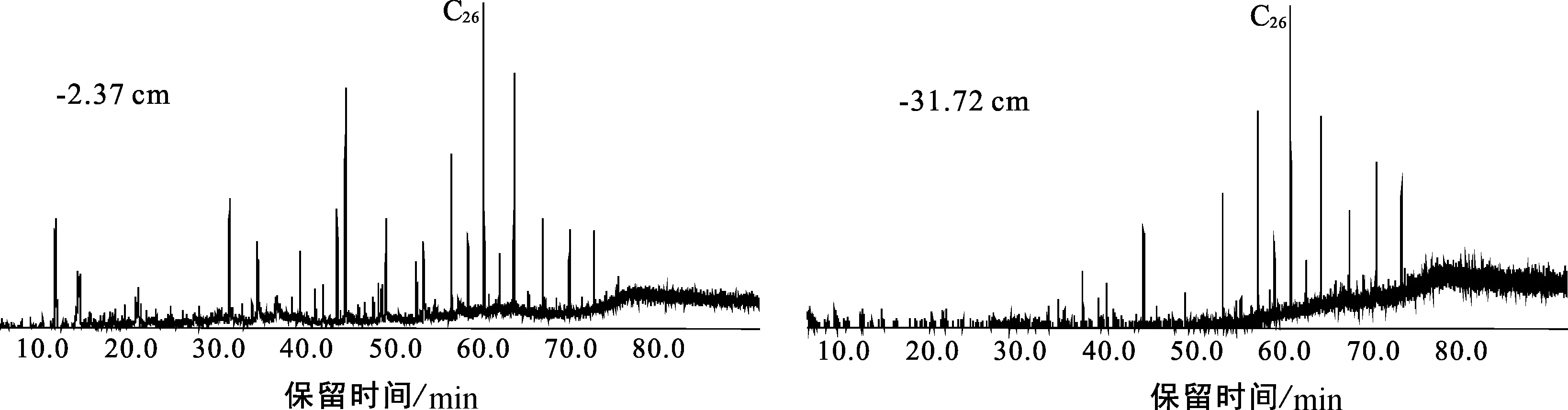
图7 Mildred泥炭地脂肪酸甲酯分布(m/z 74质量色谱图)Fig.7 Mass chromatograms of n-fatty acid,methyl ester in the Mildred peatland (m/z 74)
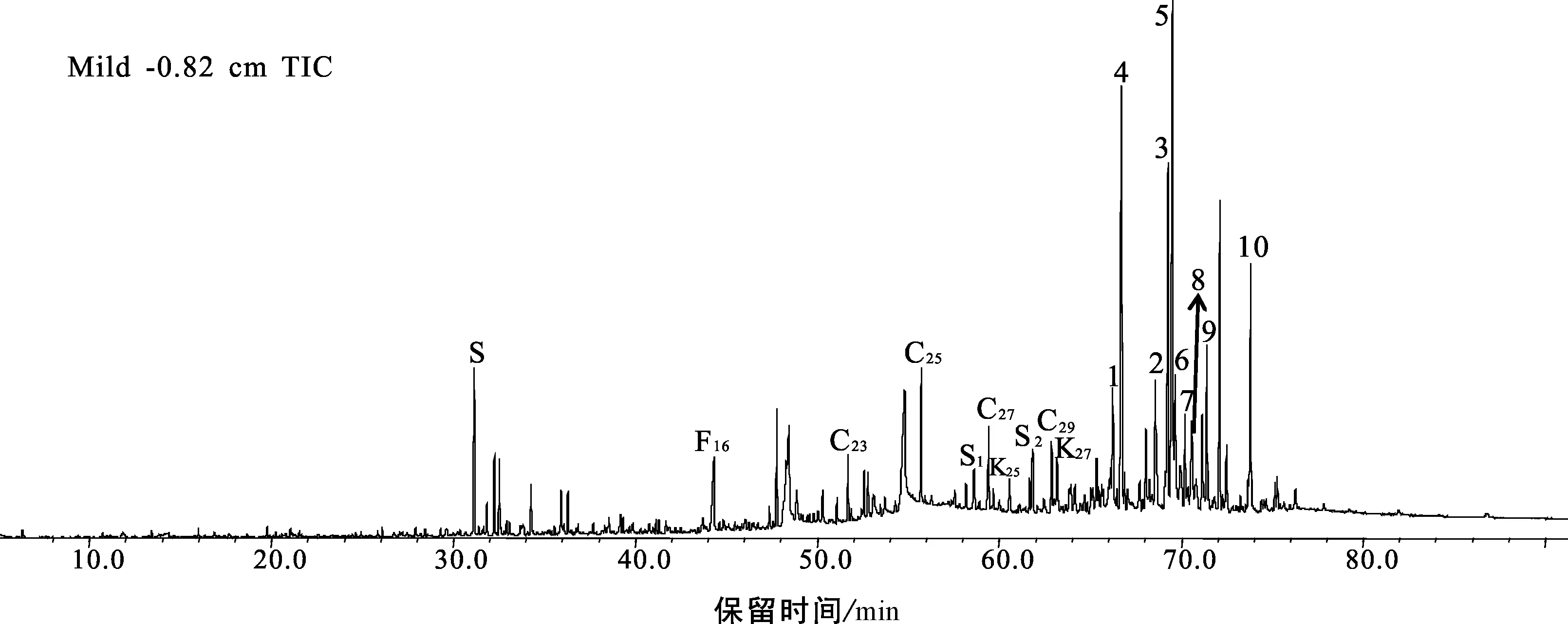
Mildred泥炭柱检测到的脂肪酸范围为C12-C22,以C16为主峰(图6),剖面下段脂肪酸化合物的识别度降低,含量很低,但仍能鉴别有脂肪酸化合物存在。由于本次实验样品没有进行衍生化,仅检测到短链的脂肪酸( 脂肪酸是可溶有机质的重要组成部分,在生物体中脂肪酸往往与醇、醛等其他的类脂化合物形成酯(或角质蜡)类化合物[27,29]。本文通过m/z 74特征碎片离子检测到了脂肪酸甲酯类化合物。Mildred整个剖面都能检测到脂肪酸甲酯,主要分布于C20-C34之间(图7),多呈单峰型分布,C26为主峰碳,部分样品呈C24主峰碳优势,偶碳优势明显,短链脂肪酸甲酯含量很少。 妥进才等[29]研究认为沉积物中正构烷烃化合物是由脂肪酸脱羧反应后形成的;沉积物中的游离脂肪酸和烃源岩干酪根中的结合脂肪酸均可以成为地质体中正构烷烃化合物的母质来源。沉积有机质中脂肪酸甲酯与正构烷烃的形成有关,脂肪酸甲酯经水解作用形成脂肪酸,然后脱羧基形成相应的正构烷烃[27,30]。生物体中不存在纯粹的长链脂肪酸甲酯化合物,说明样品中检出的脂肪酸甲酯来源于高等植物的可能性较小。因此,可初步判断样品中的脂肪酸甲酯类化合物是沉积早期生物地球化学作用的产物[30]。 泥炭样品的总离子流图中(图8),甾、萜类极性化合物检测丰度较高,明显高于直链无环类化合物,其中γ-谷甾醇、α-生育酚等极性化合物检测值最高。从整个泥炭柱剖面来看,TIC图均呈现相似的后峰型分布模式,C27-C32碳数范围的极性化合物占主导;剖面下部-40 cm以下的样品,C18-C20碳数的化合物含量逐渐增加,呈中-后峰型分布模式。剖面下部由于不同成炭植物的输入,影响了脂类化合物的分布,有机质成岩作用或其他复杂的蚀变作用也可能导致有机质差异分布。这些不常见极性化合物的研究成果有限,本文根据它们的分子地球化学剖面特征,初步探讨可鉴别的甾、萜类极性化合物的来源及其与不同成炭植物之间的关系。 图8 Mildred泥炭样品(-0.82 cm)总离子流图(TIC)及极性化合物鉴别Fig.8 Diagram of total ion chromatogram and the identification of polar compounds in the Mildred peatland(Sample: -0.82 cm)S.标样D30 PD;S1.标样角鲨烷;S2.标样d4-胆甾烷;F16.C16-脂肪酸;C23.C23-正构烷烃;K25.K25-正烷酮;编号1.菜油甾醇;2.豆甾醇;3.D-弗瑞德齐墩果-14-烯-3-酮;4.α-生育酚;5.γ-谷甾醇;6.弗瑞德-3-酮;7.齐墩果烯-12-烯-3-酮;8.α-香树脂醇;9.羊毛甾醇醋酸酯;10.胆甾烷醇 萜类化合物是广泛存在于植物体内的天然有机化合物,包括分子式为异戊二烯单位倍数的烃类及其含氧衍生物,这些含氧衍生物可以是醇、醛、酮、羧酸、酯等。泥炭样品中检测到的高丰度的萜类化合物包括:单环单萜类的β-水芹烯,倍半萜类的衣兰油烯和杜松醇,三环二萜类的脱氢枞酸甲酯,五环三萜酮类的D-弗瑞德齐墩果-14-烯-3-酮、齐墩果-14-烯-3-酮和弗瑞德-3-酮,五环三萜醇类的α-香树脂醇和β-香树脂醇,五环三萜烯类的齐墩果-13(18)-烯,以及具类异戊烯侧链的α-、β-、γ-生育酚(也叫维生素E)等。典型的萜类化合物的质谱图和分子构型如图9所示。 生育酚系列是泥炭样品中检测到的最丰富的萜类化合物,包括α-、β-、γ-生育酚,它们的浓度分别为0.92~234.76 μg/g、0.02~8.67 μg/g、0.25~39.08 μg/g,β-生育酚的浓度最小,三者的浓度分布模式相似,均随深度增加而减小(图10),最大值分布在剖面的上部即M1区域。生育酚系列广泛存在于各种植物体中,来源不具体。M1中生育酚十分富集,而M1又是泥炭藓分布集中的区域,说明生育酚与泥炭藓类植物可能存在某种联系[31]。 γ-内酯(γ-lactone,C21H40O2)是一种主要的有机化合物和中间体(图9),在香料香精和医药领域应用很广。同一分子中既含有羟基,又含有羧基,二者脱水后结合形成的物质即称为内酯。样品中检测到的γ-内酯化合物的浓度介于0~8.41 μg/g之间,随深度逐渐降低。Rontani等[31]在泥炭分子化合物中也检测到了生育酚和γ-内酯,并认为γ-内酯是生育酚自氧化作用的产物。图10中样品的γ-内酯和生育酚分布模式十分相似,推测γ-内酯可能是生育酚的自氧化作用的产物。γ-内酯/生育酚的比值为0.02~0.17,该值随深度增加而增大,剖面顶部值最小,底部出现最大值。γ-内酯/生育酚比值的垂向变化趋势表明随着深度增加,生育酚自氧化作用增强,γ-内酯的相对含量增加,使得γ-内酯/生育酚比值增大。 图10 Mildred泥炭柱生育酚(α-、β-、γ-)和γ-内酯浓度分布、γ-内酯/生育酚比值分布Fig.10 Distributions of α-, β-, γ-tocopherol and γ-lactone, and the γ-lactone/tocopherol ratio in the Mildred peat profile 图11 Mildred泥炭柱五环三萜类化合物浓度分布Fig.11 Distributions of representative pentacyclic triterpenoids in the Mildred peat profile 图11中萜类化合物的浓度均分布在0~20 μg/g,其中β-香树脂醇浓度最低,最大值仅为2.2 μg/g,这些化合物在泥炭地学领域的应用在我国少有报道。齐墩果-12-烯-3-酮、α-香树脂醇和齐墩果-13(18)-烯来自陆源高等植物;五环三萜烷中奥利烷、羽扇烷等被认为是被子来源的生物标志物;五环三萜烯类可能来源于被子植物,齐墩果-13(18)-烯可能由生物化学作用转化形成齐墩果-12-烯-3-酮(C30H48O),从而向着更加稳定的奥利烷转化;三环二萜类中脱氢枞酸甲酯(C21H30O2)被认为是来源于高等植物树脂[6,32-35]。上述化合物的浓度均随着深度降低,除了植物的类型会对化合物浓度分布造成影响,这些不饱和萜类化合物在泥炭腐殖化过程中,也会受到微生物的改造作用;随着深度增加,微生物活动与化学降解作用增强,使得萜类化合物的浓度随着深度呈现明显的降低趋势。 图10和图11可以得出,多数萜类化合物具有相似的分布特征,均随着深度增加,化合物含量降低;剖面上部的萜类化合物受成岩改造作用较弱,浓度呈现高值,而上部M1又是泥炭藓富集的区域,故剖面上部萜类化合物富集可能与泥炭藓类植物有关,陆源高等植物的输入也会影响萜类化合物的分布,由于目前可鉴别的萜类化合物缺乏专属性,可初步判断Mildred泥炭柱中多数萜类化合物的来源与泥炭藓类植物是存在联系的。 图13 Mildred泥炭柱甾类化合物浓度分布Fig.13 Distributions of representative steroids in the Mildred peat profile 甾类化合物广泛存在于各种生物体中,几乎所有的生物都能生物合成甾类化合物。γ-谷甾醇、豆甾酮、羊毛甾醇、羽扇醇、菜油甾醇、α-香树脂醇、麦角甾醇等都是高等植物中含量较丰富的化合物,尤其是α-香树脂醇等是木本植物化合物的典型代表[7,36]。泥炭样品中检测到的甾类化合物多为C28、C29和C30甾醇,典型的甾类化合物的质谱图和分子构型如图12所示。样品中基本没有检测到C27甾醇,一般C27甾醇可能起源于细菌,而C28和C29甾醇来自高等植物,甾醇的分布也代表了陆源高等植物输入特征[36]。甾酮的成因是不确定的,研究认为[36-38],甾酮是由甾醇经微生物氧化而形成,一些甾酮也可以直接来源于植物体。γ-谷甾醇、菜油甾醇、豆甾酮等甾类化合物的来源广泛,没有专属性,本文利用泥炭柱甾类化合物的分布特征,判断其与成炭植物输入的关系。 图13中γ-谷甾醇、菜油甾醇、豆甾-4-烯-3-酮和豆甾-3,5,22-三烯浓度分布相似,但它们与深度并没有呈现出很好的相关性,其中,γ-谷甾醇、菜油甾醇和豆甾-3,5,22-三烯随深度先增大后减小,γ-谷甾醇浓度最大值出现在-24.42 cm处。豆甾-4-烯-3-酮随深度逐渐降低,但中间区域的数据点分布并不连续。从上述4个甾类化合物的浓度分布看出,中间区域的甾类浓度偏高,上部泥炭藓富集的区域γ-谷甾醇、菜油甾醇和豆甾-3,5,22-三烯浓度偏低,而豆甾-4-烯-3-酮浓度相对较高,剖面-17 cm以下陆源高等植物富集,故可推测γ-谷甾醇、菜油甾醇和豆甾-3,5,22-三烯能够有效指示陆源高等植物输入。豆甾-4-烯-3-酮甾酮的来源相对复杂,可能来源泥炭藓或高等植物,也可能与微生物活动有关[38]。 (1)Mildred泥炭柱中检测到了正构烷烃、正烷酮、正烷醛、正烷醇、脂肪酸和脂肪酸甲酯、甾类、萜类极性化合物7大类化合物类型,它们均以高碳数链烷烃为主,具明显的奇碳或偶碳优势,可鉴别的甾、萜类极性化合物分布呈现显著的优势。 (2)泥炭柱沉积有机质主要来源于原地堆积的高等植物,苔藓类、水生植物对泥炭有机质也有一定程度的贡献。泥炭柱植物输入具有分段性,下段(-42~-48 cm)木本植物类繁盛,草本植物如莎草科开始富集;中段(-18~-41 cm)成炭植物以木本植物为主;上段(地表至-17 cm)锈色泥炭藓大量发育。 (3)极性化合物中,γ-内酯被认为是生育酚自氧化作用的产物,丰度高的倍半萜、单萜、五环三萜酮、五环三萜醇和五环三萜烯等化合物与泥炭藓植物和高等植物均存在联系;C28和C29甾类化合物的优势分布代表了陆源高等植物输入,其中,γ-谷甾醇、菜油甾醇和豆甾-3,5,22-三烯是指示高等植物输入的标志化合物。2.6 萜类化合物
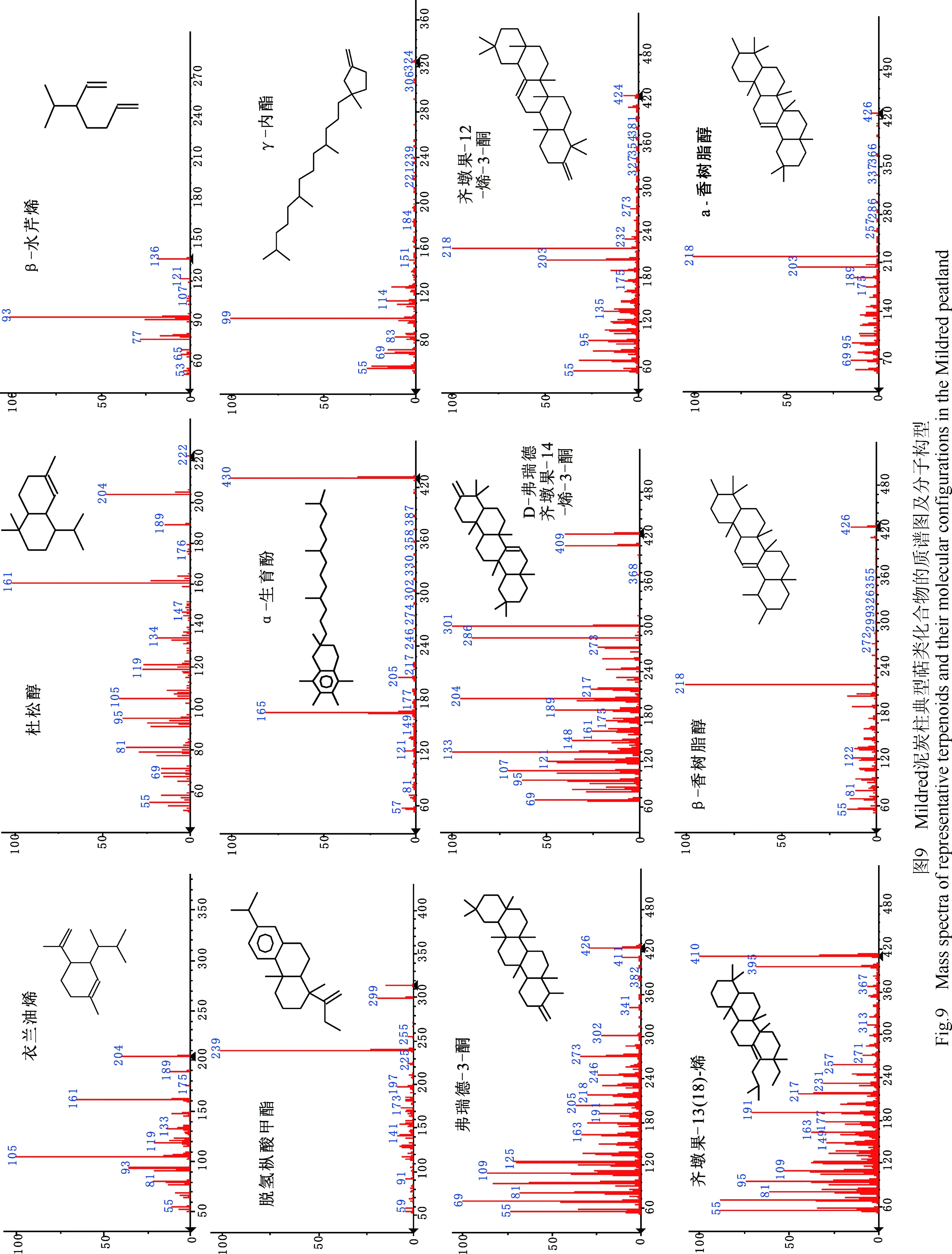
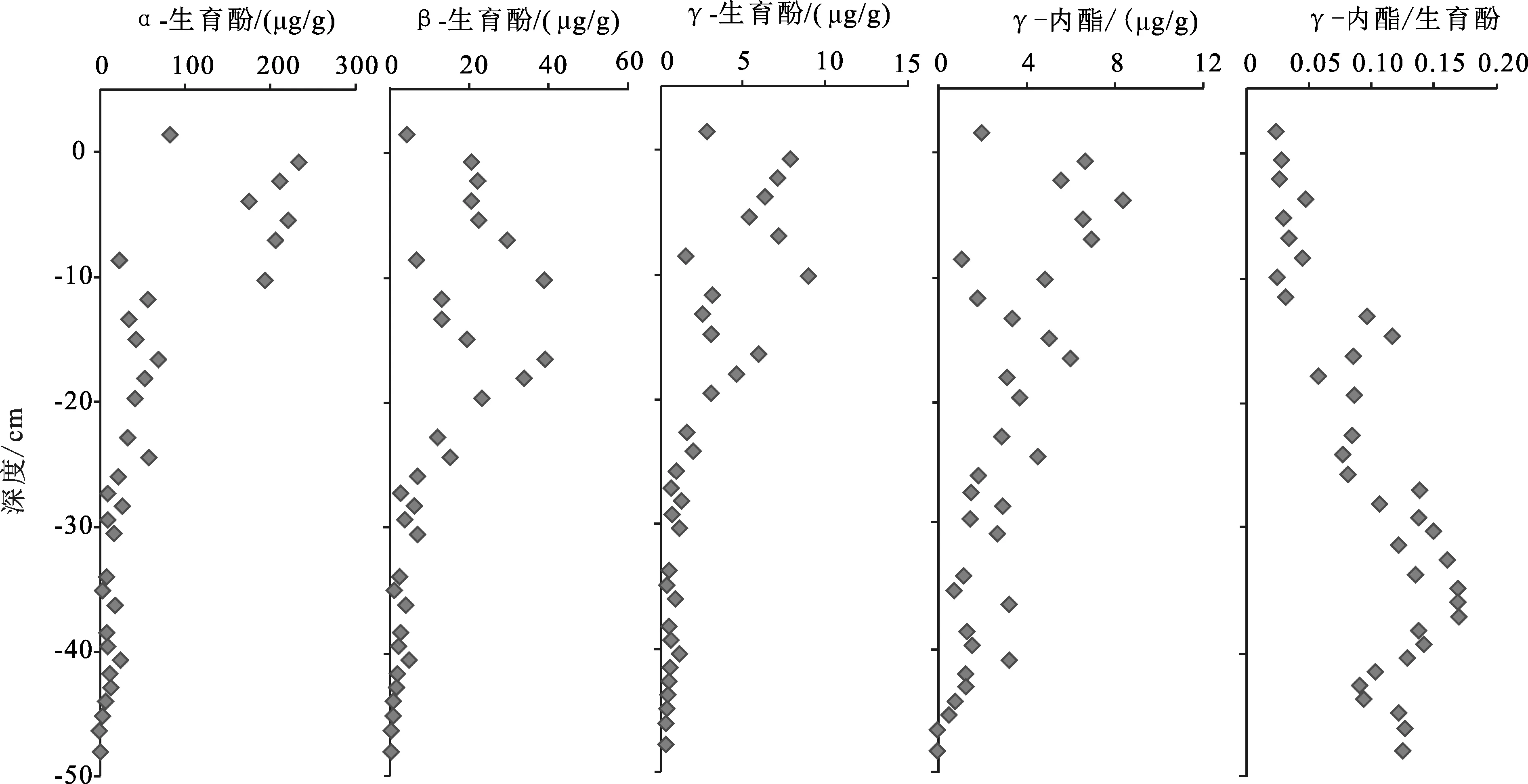

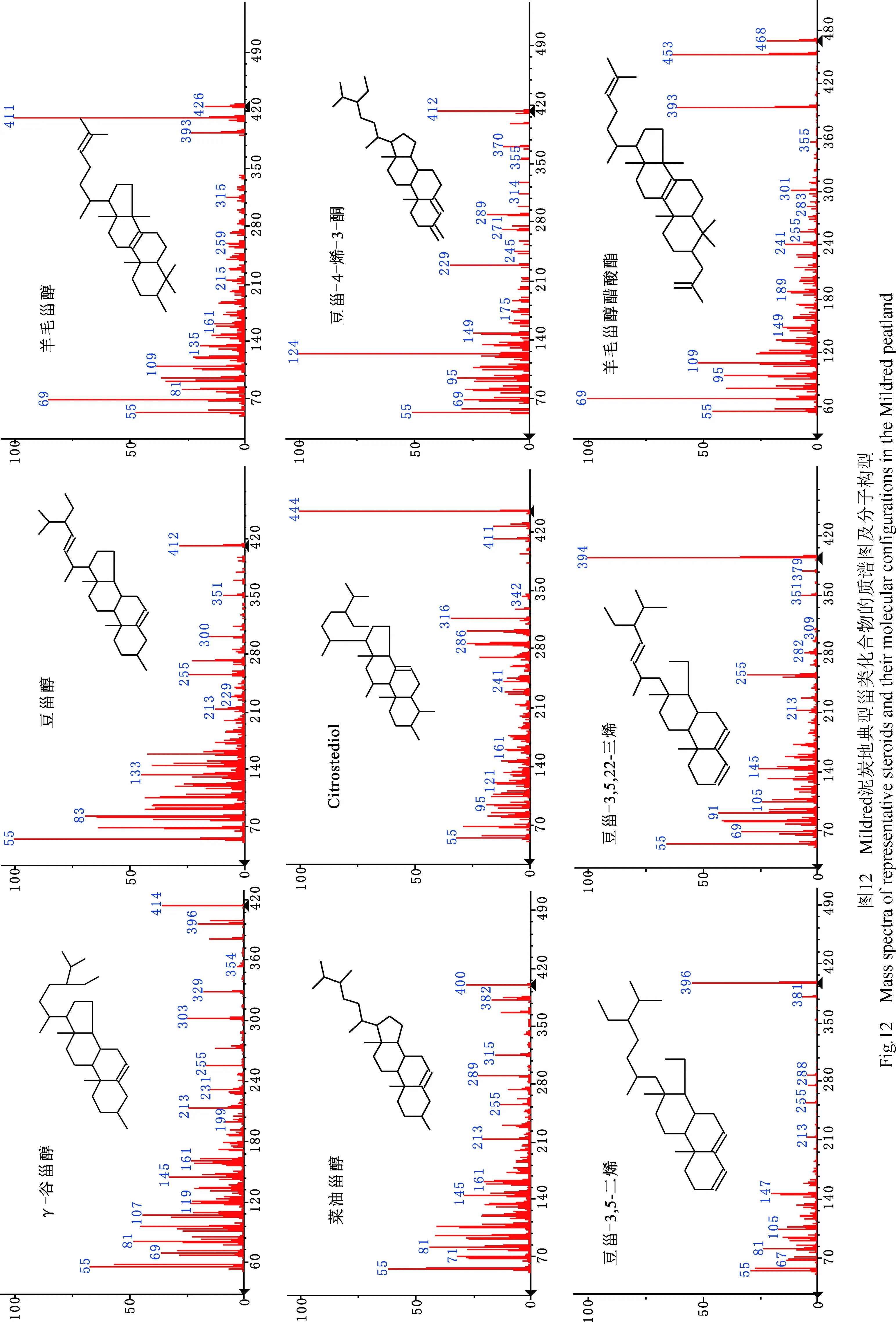
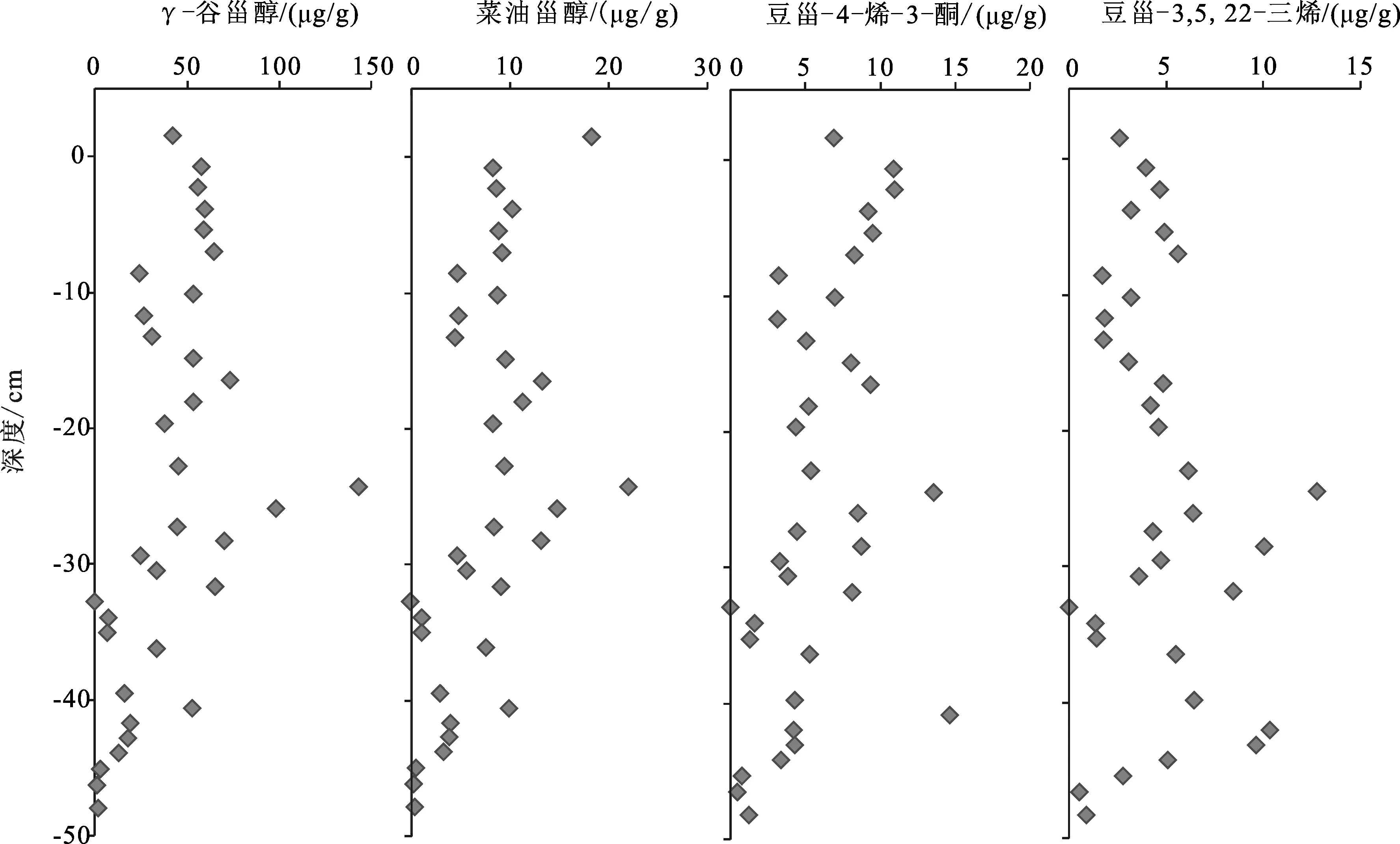
2.7 甾类化合物
3 结 论
