长链非编码RNA DOCK9-AS2对甲状腺乳头状癌细胞增殖和迁移的影响
2018-10-30吴丛珊童厚超蔡晶昇沈美萍
吴丛珊,斯 岩,童厚超,庄 茜,蔡晶昇,沈美萍
(1. 南京医科大学第一附属医院甲状腺外科,江苏南京 210029;2. 南京医科大学第三附属医院普外科,江苏南京 210000)
临床上甲状腺癌最常见的类型为甲状腺乳头状癌(papillary thyroid carcinoma, PTC),占甲状腺癌的80%~90%,而且甲状腺癌的发病率日益攀升,成为头颈部肿瘤的常发病症[1-3]。长链非编码RNAs(long non-coding RNAs, lncRNAs)的一级结构由200多个核苷酸残基组成,过去常常被认为没有生物学功能,仅作为聚合酶转录的副产物而存在。近年来,越来越多的研究发现其在染色质修饰、转录、表观遗传等生理活动中发挥重要作用,且广泛参与肿瘤的病理过程[4]。研究发现,lncRNAs表达异常与肿瘤的增殖、侵袭转移和预后密切相关[5]。DOCK9-AS2是一种新发现的LncRNA,目前有关DOCK9-AS2在PTC内的表达变化和机制尚不明确。本研究拟检测DOCK9-AS2的表达并进行CCK8和划痕实验,分析DOCK9-AS2在PTC细胞增殖、迁移等过程中发挥的作用。
1 材料与方法
1.1一般资料将2016年6月-2017年6月南京医科大学第一附属医院甲状腺外科收治的PTC患者62例作为研究对象,其中男性16例、女性46例,年龄31~67岁,平均(44.27±5.14)岁,其中<45岁38例,>45岁24例;肿瘤直径为(12.56±5.45)mm;伴有和不伴有颈部淋巴结转移者分别为21例和41例。所有病例进行手术治疗,均行甲状腺癌手术切除,术后病理确诊为PTC。切除的所有癌组织标本立刻置于液氮中,在―80 ℃冰箱内保存备用,为PTC组标本;术中同时留取甲状腺癌旁正常甲状腺组织为癌旁对照组标本。排除有甲状腺手术史、哺乳期妇女、术前接受过放疗或化疗者、心肺肝肾严重疾病患者、其他恶性肿瘤者。两组的一般资料如性别、年龄等具有可比性。本研究经医院伦理委员会批准,患者均签订知情同意书。
1.2实时荧光定量PCR(qRT-PCR)检测DOCK9-AS2mRNA表达Trizol试剂提取PTC组及癌旁对照组总RNA,用紫外分光光度仪测定RNA的浓度和纯度。根据试剂盒说明书将总RNA逆转录成cDNA。选取A260 nm/A280 nm在1.8~2.2的样品用于后续实验。根据SYBR Green说明书,采用10 μL RT-PCR总反应体系(SYBR Master Mix 5 μL、Primer1 0.2 μL、Primer2 0.2 μL、cDNA模板1 μL,加ddH2O至10 μL);扩增条件为95 ℃,持续3 min:95 ℃,变性5 s,60 ℃,退火30 s,循环次数为40。以GAPDH为内参基因,基因引物序列为:DOCK9-AS2上游5′-CGCCCAAATACCCAGAGGTT-3′,下游5′-TTA-CGCTTCAGGCCAGTGTT-3′;GADPH上游5′-CAGGAGGCATTGCTGATGAT-3′,下游5′-GAA-GGCTGGGGCTCATTT-3′。计算2-△CT以判定mRNA相对表达。重复3次,取平均值。并分析PTC组织中DOCK9-AS2的表达变化与临床病理的关系。
1.3细胞培养人PTC癌细胞株(中国科学院上海细胞库)和正常甲状腺细胞 (ATCC,美国),培养于含100 mL/L胎牛血清(Gibco公司,美国),1%青霉素-链霉素(南京碧云天公司)的DMEM高糖培养基(Gibco公司,美国)中,置于37 ℃、50 mL/L CO2饱和湿度条件下培养,于对数生长期开始实验。
1.4siRNA转染按照说明书用转染试剂Lipofectamine 3000(Invitrogen公司,美国)转染DOCK9-AS2-NC和DOCK9-AS2-siRNAs(上海吉玛公司)于PTC癌细胞中。转染前12 h将细胞以3×105/孔接种于6孔板中。每孔转染时,先将50 pmol DOCK9-AS2-siRNA与4 mol/L Lipo-fectamine 3000分别加至125 mol/L Opti-MEM (Gihco公司,美国)中,5 min后轻轻混合,室温孵育5 min后加到各个孔中,DOCK9-AS2-NC作为对照。在培养箱中培养48 h。DOCK9-AS2-Si的序列:正向5′-GCCCAAAUACCCAGAGGUUTT-3′,反向5′-AACCUCUGGGUA-UUUGGGCTT-3′;DOCK9-AS2-NC的序列:正向5′-UUCUCCGAACGUGUCACGUTT-3′,反向5′-ACGUGACACGUUCGGAG AATT-3′。
1.5CCK-8实验检测细胞增殖变化将1.4项中各组细胞转染后48 h时,消化重悬,调整细胞密度为1×104/mL,取100 μL细胞悬液接种于96孔板,在板周围一圈的孔内加入100 μL的PBS作为调零组,剩余孔板第2排到第7排的每排左侧5孔分别加入100 μL的阴性对照组细胞悬液,右侧5孔分别加入100 μL的DOCK9-AS2-siRNA组细胞悬液,共有6排细胞,即6组细胞。从种板第2天开始,待细胞贴壁后每天取1组细胞(即96孔板第2排到第7排,共有6组),每孔加入5 mg/mL的CCK-8 20 μL。常规培养2 h后,用酶标仪检测450 nm处的吸光度,连续检测5 d,重复3次。
1.6划痕实验测定BCPAP细胞的迁移能力取出1.4项中转染培养24 h的细胞,取出1.4中转染培养24 h的细胞,接种于6孔板,待细胞贴壁长满后,用200 μL的无菌移液枪头在6孔板底部呈“一”字型划痕(作为0 h),再于培养板底用标签笔在培养板底随机标记5个观察点;加入PBS冲洗后,加入新鲜不含FBS的DMEM培养基,放入培养箱内培养24 h;光学显微镜下观察划痕愈合情况,采用Quantity One软件对划痕面积进行分析,实验重复3次。
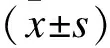
2 结 果
2.1PTC组织中DOCK9-AS2的表达上调PTC组、癌旁对照组的DOCK9-AS2的mRNA相对表达量分别为0.009 7±0.004 4、0.002 6±0.001 0,差异有统计学意义(P<0.05,图1)。

图1甲状腺乳头状癌和癌旁组织中DOCK9-AS2mRNA的表达
Fig.1 mRNA expression of DOCK9-AS2 in PTC tissues and adjacent tissues
T:甲状腺乳头状癌组织;N:甲状腺癌旁组织。
2.2PTC组织中DOCK9-AS2的表达与临床病理的关系统计分析结果显示,PTC癌组织中DOCK9-AS2的表达与有无淋巴结转移、腺外侵犯有关(P<0.05),与其他病理参数无关(P>0.05,表1)。
2.3BCPAP细胞株增殖与迁移情况通过siRNAs瞬时转染甲状腺乳头状癌细胞BCPAP,48 h进行RT-PCR检测的结果显示,干扰组DOCK9-AS2表达明显下降(图2A);CCK8增殖实验结果显示,相比于阴性对照组,干扰组细胞活力显著减弱(图2B)。细胞划痕实验检测结果显示,干扰DOCK9-AS2后,BCPAP细胞的迁移能力显著下降(图3)。
表1DOCK9-AS2的表达与甲状腺乳头状癌患者临床病理特征的关系
Tab.1 Correlation between DOCK9-AS2 expression and clinicopathological characteristics of PTC patients

病理特征n低表达高表达P性别 男211110 女4123180.865年龄(岁) ≤45432518 >45199100.633多灶性 是1679 否4627190.534微小癌 是22139 否4021190.757腺外侵犯 是18216 否4432120.010淋巴结转移 是32725 否30273<0.001

图2RT-PCR检测si-RNA转染后BCPAP细胞中DOCK9-AS2的表达及CCK-8检测BCPAP细胞增殖变化
Fig.2 DOCK9-AS2 mRNA expression of BCPAP cells after transinfected si-RNA detected by RT-PCR and BCPAP cell proliferation ability detected by CCK-8

图3划痕实验测定BCPAP细胞的迁移情况(A)和比较(B)
Fig.3 The migration of BCPAP cells (A) detected by wound healing assay and the comparison (B)
3 讨 论
近年来,甲状腺癌发病率逐年递增,并且呈年轻化趋势[6]。淋巴结是甲状腺癌复发和转移最主要的器官,其淋巴结转移发生率为5%~20%[7-8]。PTC是最常见的甲状腺癌类型。根据研究报道,30%~70%的PTC患者会出现颈部淋巴结转移,且其预后相对较差[9-11]。然而,在临床实践中,对PTC的原发灶、转移灶及复发灶进行检测主要采用的细针穿剌术,其穿刺报告中显示为“不确定性”的有三成左右[12]。而其他常用方法如超声、CT、FDG-PET/CT等,不仅费用昂贵,而且精确度不高[13-14]。由于目前分子标记物已被广泛用于多种疾病的临床诊断和预后判断过程[15]。因此,本研究探索了长链非编码RNA DOCK9-AS2是否与PTC的增殖转移有关。
人们过去一直认为,在哺乳动物基因组当中,超过90%的基因无编码功能,这些基因是没有作用的。但是随着人类基因组计划的完成,这些非编码RNA被证实在细胞的生命活动中发挥着重要的调控功能[4]。相关研究表明,哺乳动物中有90%的非编码 RNAs(ncRNA),它们不作为翻译的模板,编码相应的蛋白质。ncRNA有2种类型,即lncRNA和miRNA,其异常表达往往对肿瘤的发生发展起促进作用[16]。DOCK9基因位于染色体13q32,编码230 ku的DOCK9蛋白。DOCK9蛋白属于DOCK-D家族成员之一,具有GTP/GDP交换因子活性,能够特异性地激活G蛋白CDC42,参与细胞内信号转导网络。DOCK9-AS2是DOCK9反义非编码RNA,同样在肿瘤的发生发展中有重要作用。但目前相关的研究很少,仅有1篇报道证明其与子宫内膜癌的预后有关[17]。
本研究分析62例PTC的临床组织标本发现,DOCK9-AS2在PTC中高表达。根据临床病理参数分析结果,发现DOCK9-AS2的表达仅与淋巴结转移及腺外侵犯有关。CCK-8和划痕实验结果表明,DOCK9-AS2高表达对PTC中BCPAP细胞的增殖和转移过程起明显的促进作用。以上结果提示,DOCK9-AS2对PTC具有促癌作用,并为其提供了有效的理论依据。
综上所述,lncRNA DOCK9-AS2或许能成为PTC治疗和预后判断的新靶点,但其分子水平上的作用机制仍有待进一步的探索与证实。
