基于蛋白质组学技术探讨小鼠心脏缺血再灌注损伤早期膜蛋白的变化特点
2018-10-30尤宏钊李玉琳乔博康王绿娅陈博雅
尤宏钊 李玉琳 乔博康 王绿娅 陈博雅 智 莹 杜 杰
随着经皮冠状动脉介入治疗技术(percutaneous coronary intervention,PCI)在急性心肌梗死(acute myocardial infarction, AMI)中的广泛应用,缺血再灌注损伤(ischemia /reperfusion, I/R)已经成为了患者血运重建过程后最常见的不良事件[1]。目前认为在急性心肌梗死患者血运重建后早期(3d内)是心肌细胞缺血再灌注损伤的重要时间节点[2]。在此期间,炎症反应和微循环障碍将会造成心肌细胞的进一步凋亡[3]。近些年,研究发现膜蛋白作为蛋白质的重要组成部分,与心脏缺血再灌注损伤早期的病理变化密切相关[4]。因此,探究早期膜蛋白谱的变化对于研究病理机制和筛选潜在的治疗靶点具有重要的意义。但目前对于损伤早期心脏组织膜蛋白变化仍缺乏相关研究[5]。蛋白质组学(proteomics)是研究某一类型组织中所有蛋白质组成及其功能。传统的蛋白质组学研究常采用双向凝胶电泳图谱分析(2-dimensional polyacrylamide gel electrophoresis,2D-PAGE)[6],但是可鉴定的蛋白质数量少且不能精确的定量分析。新近报道的同位素标记相对和绝对定量(iTRAQ)技术,不仅可以鉴定更多的蛋白质种类,还可以对蛋白质进行高通量的定量分析并已应用于心血管研究[7]。本项研究采用iTRAQ技术对I/R早期心脏组织膜蛋白的表达水平进行了定量分析,结合生物信息学,对I/R早期差异表达的膜蛋白所涉及的生物学进程进行了分析并探讨了所涉及的信号通路。
材料与方法
1.动物选择及分组 健康雄性,C57小鼠,15只,体质量18~20g,由北京安贞医院动物实验中心提供。所有小鼠术前均禁食6h。本实验利用随机数字表法将15只小鼠分为三组(n=5):分别为对照组(Sham组),缺血再灌注1d组(I/R 1d组),缺血再灌注1d组(I/R 3d组)。
2.材料及试剂 Q-Exactive质谱仪和Easy nLC1000纳升级液相色谱仪购自Thermo Finnigan(美国)。膜蛋白纯化试剂盒、蛋白浓度测定试剂盒购自ThermoFisher(美国)。胰蛋白酶、SiTRAQ-plex标记试剂盒及缓冲液购自Applied Biosystems(美国)。
3. 心肌缺血再灌注损伤模型的制备 动物模型具体过程如本研究室前文所述[8]。造成心肌缺血后30 min后松开结扎线,分别恢复血流24h和72h。心肌缺血再灌注损伤在体动物模型的制作以心电图显示ST段抬高、QRS波变高变宽和心肌颜色由正常颜色变苍白再变成暗色表示结扎成功实验过程中动物处置方法符合动物伦理学标准。死亡动物随时补充。
4.小鼠心脏组织的制备及膜蛋白纯化 各组取3只小鼠,Sham组取称重时刻,I/R组于I/R后1d和3d取小鼠左心室结扎线以下组织,用液氮迅速冰冻并放入-80℃冰箱保存。膜蛋白纯化按照ThermoFisher试剂盒说明书进行,并按照前人研究所述进行验证[9]。
5.酶解及肽段定量标记 各取200μg样品,分别加入DTT至终浓度为100mM,沸水浴5min,冷却至室温。加入200μL UA buffer(8M Urea,150mM TrisHCl pH8.0)混匀,转入10kd超滤离心管,之后进行梯度离心。各组样品肽段分别取约100μg,按照AB公司试剂盒:iTRAQ Reagent-8plex Multiplex Kit(AB SCIEX)说明书进行标记。
6.质谱分析 质谱分析原始数据用软件Proteome Discoverer1.4进行查库鉴定及定量分析。采集的质谱数据用Proteome Discoverer 1.4(version1.4.0.288, Thermo Fisher Scientific)进行分析,数据库为uniprot mouse complete proteome database (Release 2013_06)合并常见污染库。采用Sequest HT检索, 检索的肽段和谱图匹配(PSM)采用Percolator算法进行过滤,q值<1%(1%的FDR)。检索后的肽段利用严格的最大简约原则合并成蛋白。
7.生物信息学分析 为了减少物种之间蛋白质的异质性,所有差异蛋白均首先利用Uniprot比对了人和小鼠中表达量的差异(www.uniprot.org),并经过TMHMM 2.0对差异蛋白的跨膜结构进行了预测(http://www.cbs.dtu.dk/services/TMHMM/)。使用AgriGO进行gene ontology(GO)注释和富集分析。 GO项目描述了蛋白质在三个领域中的作用:生物过程,细胞成分和分子功能。 在注释和注解增加之后,在“Kyoto Encyclopedia of Genes and Genomes”(KEGG,http://www.genome.p/kegg/)中依次将酶映射到注释序列和代谢途径[10]。
8.统计学方法 采用 SPSS 21.0软件分析数据。体重等正态计量资料以均数±标准差表示, 两组间比较采用t检验; 蛋白质表达量等偏态计量资料以中位数和四分位数间距表示,组间比较采用秩和检验。计数资料以率或构成比表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义
结 果
1. 缺血再灌注损伤造模及膜蛋白纯化的结果 结扎小鼠前降支后,利用心电图显示ST段抬高、QRS波变高变宽表示造模成功。首先利用蛋白质印迹分析检测膜蛋白提取液的纯度,发现细胞膜标记(Na +/ K+ATP酶)在膜蛋白溶液的水平远高于细胞质蛋白的组织。相反,膜蛋白溶液中的细胞质的标记(GAPDH)均低于再灌注损伤和正常心脏组织的细胞质蛋白(图1)。 这些结果表明膜蛋白成功纯化。
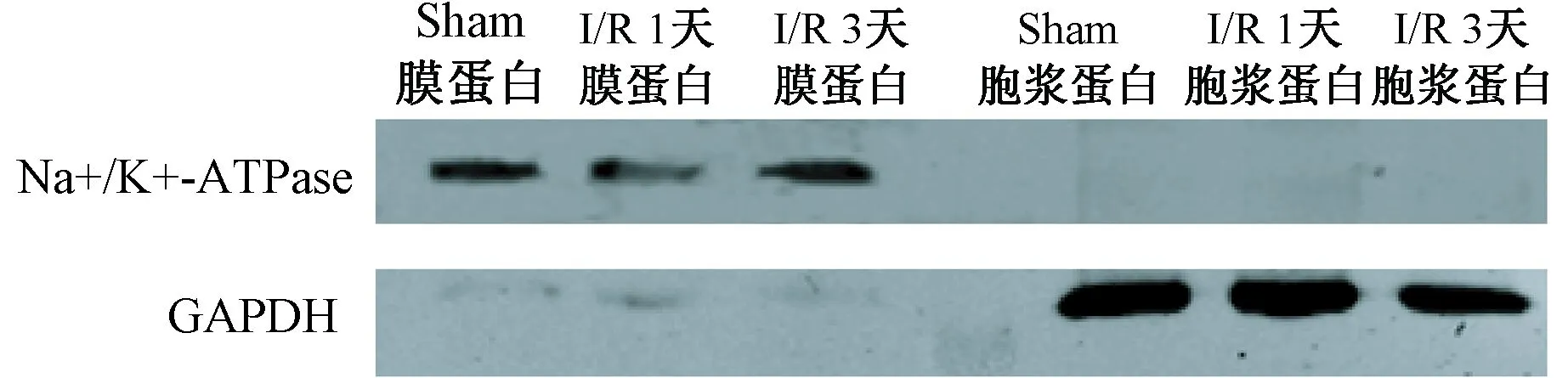
图1 膜蛋白纯化的鉴定
2. 蛋白质的鉴定和定量结果 基于iTRAQ的定量蛋白质组学,本研究揭示了缺血再灌注损伤过程中早期差异表达的膜蛋白。利用质谱技术,一共鉴定了23 872种独特的肽,对应于2 224种蛋白质。其中,预测跨膜域后共鉴定到901个具有跨膜结构的蛋白。比较不同时间点的膜蛋白定量结果,在I/R 1d后/Sham组共鉴定到有895个膜蛋白。在I/R 后3d与/I/R后1d组中鉴定到897个膜蛋白。
3. 缺血再灌注损伤早期不同阶段膜蛋白表达谱 为了进一步筛选具有差异的膜蛋白,我们定义两组之间差异倍数>1.5或者<0.67为差异蛋白,同时还应满足所选择肽链>1、置信区间>95%[11]。在鉴定到的蛋白中,I-R 1d / Sham组共有211个蛋白上调,有217个蛋白下调;在I/R 3d / I/R 1天组中有205个是上调蛋白,222个是下调蛋白。进一步取差异蛋白的交集,我们发现了两种膜蛋白的表达谱:154种蛋白在I/R早期1d和3d均持续升高;200种蛋白在I/R早期1d和3d均持续降低,但没有蛋白在I-R 1d和3d呈现相反的趋势(图2)。
4. 差异蛋白的生物信息学分析和涉及的信号通路 为了更好地研究差异蛋白地总体趋势和功能学分类,我们采用Gene Ontology(GO)对不同阶段差异表达的全部501个蛋白进行了富集分析。差异蛋白的GO分析被分为了生物过程(BP)、细胞组成(CC)和分子功能(MF)三部分组成,主要结果呈现在图3。

图2 缺血再灌注损伤差异蛋白的分布
在生物过程中,I/R后1d与Sham相比,差异表达的膜蛋白中主要涉及氧化应激,能量代谢、电子传递链(图3A);I/R后3d与I/R后1d相比,差异表达的膜蛋白中主要涉及氧化还原、能量代谢途径以及电子传递链(图3B)。在细胞成分上,由于进行了膜蛋白纯化,差异表达的蛋白主要集中在膜结构、细胞外泌体和线粒体等具有细胞膜结构的细胞成分(图3C,D)。在分子功能上,I/R后1d与Sham相比,差异表达的膜蛋白中主要涉及离子结合,核苷酸结合和通道蛋白(图3E)。I/R后3d与I/R后1d相比,差异表达的膜蛋白中差异表达的膜蛋白中主要涉及离子结合,骨架蛋白和转运蛋白(图3F)。离子结合包括了阳离子结合、金属离子结合等。
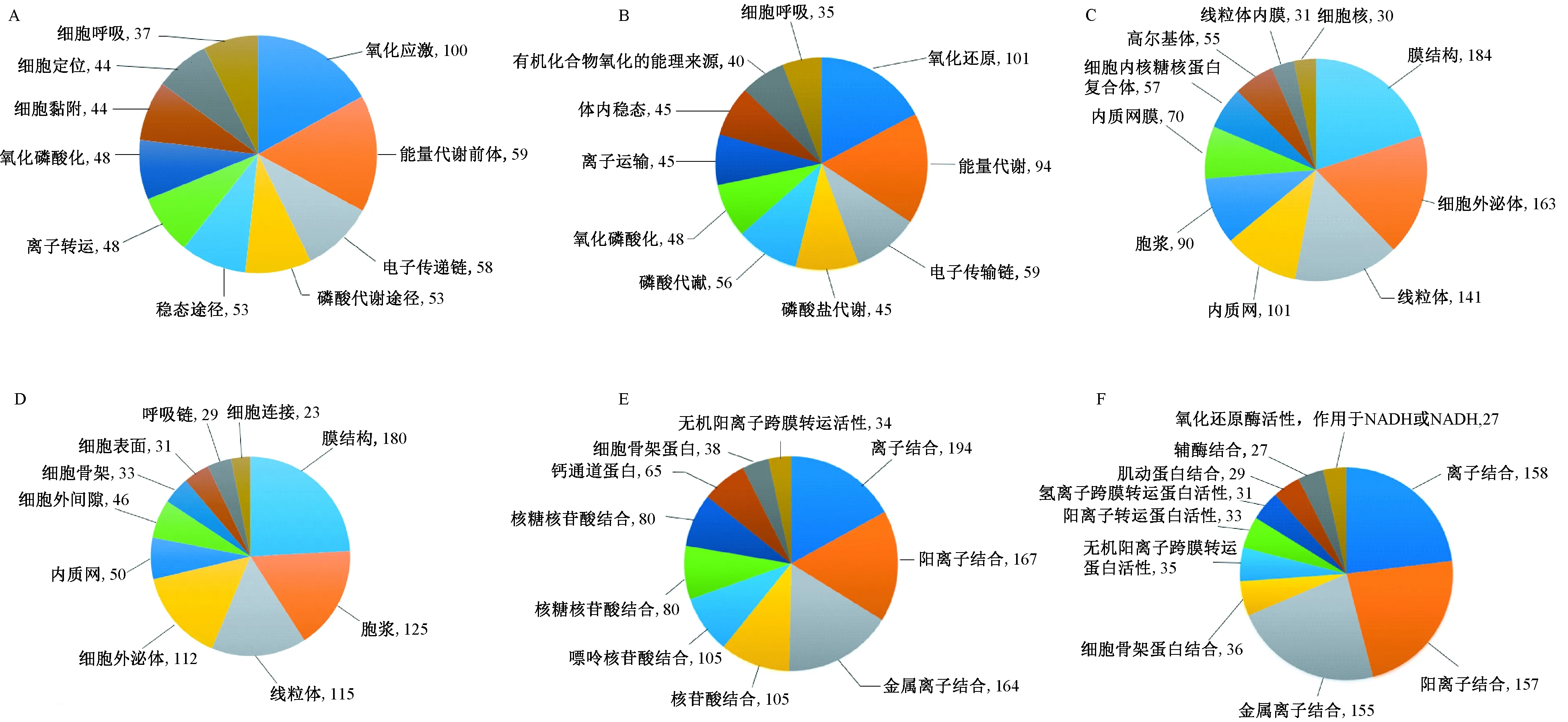
图3 缺血再灌注损伤早期差异表达膜蛋白的生物信息学分析 A:I/R1天的生物进程分析;B:I/R3天的生物进程分析; C:I/R1天的细胞成分预测;D:I/R3天的细胞成分预测;E:I/R1天的分子功能预测;F:I/R3天的分子功能预测
5. 差异蛋白所涉及信号通路的探究 为了探究差异膜蛋白所涉及的信号通路,我们采用KEGG分析对差异蛋白进行了鉴定。I/R后1d和3d的心脏组织膜蛋白主要涉及信号通路主要是氧化磷酸化、糖代谢、脂代谢心肌收缩。

图4 缺血再灌注损伤早期差异表达膜蛋白的通路 A:I/R 1d的信号通路分析;B:I/R 3d的信号通路分析
讨 论
缺血再灌注损伤是急性心肌梗死患者最常见的不良事件。了解心肌缺血再灌注过程中的蛋白质合成与调控对研究疾病的发病机制和治疗靶点具有重要的意义。有关缺血再灌注损伤的研究多数集中于探究差异表达蛋白质在疾病中起到的作用,很少有研究关注早期蛋白谱的变化。以前的研究表明,缺血再灌注损伤早期是损伤发生的关键阶段。在这个阶段,心肌细胞凋亡和微循环障碍作为缺血再灌损伤早期的重要病理特征同时发生[12-13]。其中,膜蛋白都起到了重要的作用[14]。为了更好的理解缺血再灌注损伤早期所涉及的膜蛋白变化,我们基于iTRAQ首次定量检测了I/R早期差异表达的膜蛋白, 结合生物信息学和公共数据库,描绘了差异膜蛋白谱,也发现其中主要涉及的病理过程是氧化应激和能量代谢。
1.膜蛋白和氧化应激 以前的研究已经发现,氧化应激是缺血再灌注损伤早期的重要病理生理过程[15]。膜蛋白作为重要的信号受体,不仅可通过激活下游通路调节调控病理过程,此外部分细胞膜降解产物具有很强的炎性趋化作用,使微循环中的白细胞大量增加,加重了微循环障碍。S1PR1作为信号分子受体,激活后可以减少心肌心肌细胞的氧自由基的形成,从而达到抗氧化的作用[16]。TLR3是TLR样受体中重要的成员,主要分布在细胞的内涵体上。其他TLRs信号转导通路不同,TLR3识别配体后通过含有TRIF结构域的转接蛋白参与调控了I-R损伤后细胞的氧化应激[17]。除了细胞表面的膜蛋白以外,线粒体的膜蛋白也被认为与缺血再灌注损伤有关。例如Ca2+摄取蛋白1(mitochondrial calcium uptake 1,MICU1)是线粒体的内膜蛋白,可以调节Ca2+转运,防止线粒体内出现Ca2+超载发生。氧化应激可引起MICU1变构,使钙离子内流增加,造成钙超载,从而可导致并促进细胞的不可逆性损伤[18]。尽管目前减少氧化应激带来的心肌损伤已经作为治疗心脏缺血再灌注损伤的重要干预手段,但是新型药物的临床治疗效果欠佳[19],更有针对性的治疗靶点有待发现。既往的蛋白芯片研究对于发现新的治疗靶点所提供的研究价值有限,而本项研究的结果为寻找新的分子靶标提供了更为直接的组学依据。
2.膜蛋白和能量代谢 能量代谢是心脏缺血再灌注损伤的始动因素。相关研究发现能量代谢障碍发生后心肌细胞的基因结构及表达均受到影响,且心肌细胞内ATP水平与心肌细胞的凋亡、坏死密切相关[20]。由于再灌注损伤期间,线粒体的结构、功能因缺血遭到严重破坏,不能进行有效的有氧氧化产能,导致恢复再灌注的相当一段时间内能量来源仍然主要依靠糖酵解。我们的实验结果表明再灌注早期,与三羧酸循环相关的膜蛋白表达下调,但氧化磷酸化的膜蛋白表达量却增强,这点与前人的研究相一致。GLUT4不仅参与糖代谢、脂肪酸代谢,在缺血再灌注损伤中也起到重要作用。脂肪酸的转运、贮存和利用都有赖于膜蛋白的参与[21-22]。前人的研究发现,心肌细胞脂肪酸氧化向糖酵解转变,而使得心肌内脂质的聚集和利用减少[23],这也解释了我们的结果中第1天和第3天脂代谢整体水平持续下降的原因。另外,氧自由基引起的过氧化反应对膜磷脂造成了损伤,造成线粒体的电子传递链也受到了影响。前人研究认为虽然再灌注损伤后电子传递链整体的表达水平是上升的,但是复合物I-III的结构却出现了损伤[24]。我们的结果从蛋白水平印证了前人的结果,但是电子传递链各复合体作用于缺血再灌注损伤的机制,仍有待于进一步的研究,特别是蛋白质绝对定量的结果。
我们的研究首次利用相对定量的方法,探究了与正常心脏相比,I/R 1d后和3d膜蛋白的差异,并结合生物信息学,对差异膜蛋白进行了GO分析和通路分析,为探究膜蛋白在缺血再灌注损伤早期的作用及寻找潜在的治疗靶点提供了可靠的组学结果。尽管如此,本项研究仍存在两点局限,一是iTRAQ实验过程中大量共洗脱肽段对定量准确性有一定影响,同时由于缺少内标,差异蛋白的鉴定是相对定量的结果,对于每一种差异蛋白仍需要进一步绝对定量的结果。二是尽管我们对于每一个差异蛋白也用公共数据库进行了比对人和鼠之间的差异,但仍不能完全消除可能受不同物种间异质性的影响。
综上所述,定量蛋白质组学技术可有效地用于组织蛋白鉴定和相对定量,利于更好地了解膜蛋白与心脏缺血再灌注损伤早期病理变化的关系。本项研究的结果为探究缺血再灌注损伤早期心脏组织膜蛋白所涉及的病理过程和潜在的治疗靶点提供了新的观点和证据。
