COPD模型大鼠TGF-β1/Smads通路炎性蛋白的改变
2018-10-29李风森
金 晶, 王 晶, 郑 茜, 李风森,5
(新疆医科大学1中医学院, 乌鲁木齐 830011; 2第一附属医院中医内科, 乌鲁木齐 830054;3新疆维吾尔自治区呼吸病研究重点实验室, 乌鲁木齐 830000; 新疆医科大学4第二附属医院中医科, 乌鲁木齐 830054;5附属中医医院肺病科, 乌鲁木齐 830000)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)作为以不完全可逆气流受限为主要表现的气道炎症病变,香烟烟雾等有害气体和(或)颗粒是公认的危险因素之一[1],长期香烟烟雾和其他刺激性气体的吸入造成呼吸道局部及肺实质中性粒细胞、巨噬细胞、上皮细胞及活化的T细胞积聚,炎症因子释放增多,造成气道高反应性及气道重塑[2]。转化生长因子-β1(transforming growth factor-β1, TGF-β1)广泛参与气道重塑及气道炎症反应,Smad2和Smad3 是受体调节型Smads 蛋白,是重要的TGF-β受体胞内激酶的底物,磷酸化后可穿越胞膜,对细胞外基质合成、创伤修复和免疫功能等起到重要调节作用[3]。本研究通过烟雾暴露(CS)结合脂多糖(LPS)气管内滴注的方法建立COPD状态大鼠模型,观察在烟雾刺激状态下引起的慢性炎症肺组织中TGF-β1/Smads信号通路中相关炎性因子mRNA表达,旨在深入探讨此通路激活的重要作用,为气道炎症性疾病,特别是COPD的防治提供新的思路和方向。
1 资料和方法
1.1实验动物及分组经新疆医科大学动物伦理委员会的许可,实验操作和[动物生产许可证号:SCXK(新)2011-0004,实验单位使用许可证号SCXK(新)2011-0001]。实验流程均遵守《实验动物管理条例》。20只SPF级8周龄的雄性Wistar大鼠,饲养环境模拟自然昼夜条件,温度(21±2)℃,湿度40%~50%,自由饮水,正常饮食,体质量(200±50)g。按照随机化原则分为:对照组(n=10)和模型组(n=10)2组。所有的大鼠于实验结束后处死,取肺组织,用于Western blot及RT-PCR分析;取外周血,收集血清,用于酶联免疫吸附实验(ELISA)。
1.2试剂脂多糖(LPS,Sigma公司,批号:L-2880),雪莲过滤嘴香烟(新疆卷烟厂,烤烟型,焦油量13 mg、烟气烟碱量1.1 mg和烟气一氧化碳量13 mg),TGF-β1、白细胞介素-10(IL-10)和白细胞介素-17(IL-17) ELISA 试剂盒(武汉基因美生物科技有限公司,批号:JYM0636Ra、JYM0480Ra、JYM0646Ra);Smad2/3和Smad7抗体Platinum SYBR Green qPCR SuperMix-UDG试剂盒(Invitrogen公司,批号:C11733-038),Trizol试剂(Invitrogen公司,批号:15596-026),M-MLV First-Strand Synthesis Kit反转录试剂盒(Invitrogen公司,批号:C28025-032),引物由乌鲁木齐鑫泽宝信生物技术有限公司合成。RIPA裂解液(Biosharp,批号:Bl504A),PVDF膜(Millipore公司,批号:K1BA3015K),BCA蛋白定量试剂盒(Thermo公司,批号:0G191848)。
1.3仪器动物中心动物烟熏箱(自制),大小:60 cm×50 cm×40 cm,Wistar大鼠全身暴露型肺功能测量仪(PLY3211,Buxco Electronics公司),电子显微镜(U-CMAD3 Olympus公司) ,全波长酶标仪(Multiskan GO Thermo公司),全自动图像分析系统(GX51型 Olympus公司),深孔PCR 仪(C1000 Thermal cycler BIO-RAD公司) ,电泳装置(PowerPac Basic Bio-Rad公司) 。
1.4COPD动物模型的建立及评价方法采用CS+LPS气管内滴注的方法制备大鼠COPD模型[4],方法如下:模型组大鼠置于动物烟熏箱进行烟熏(烟雾浓度保持在450~500 bpm,持续30 min,间隔3 h烟熏1次,每12小时更换烟盒1次),并气管内滴注LPS 0.2 mg/kg,每日1次,持续12 w。分别于第1天及第84天,称取模型组大鼠体质量,采用Wistar大鼠肺功能检测仪检测以下指标:吸气峰流速、呼气峰流量和每分钟通气量,指标下降程度超过30%即为COPD模型成功。
1.5病理标本的制作各组大鼠肺组织(左),于肺矢状面最大周径处取材,剪成面积为1.5 cm2左右的小块,浸入2 mL 4%多聚甲醛溶液中固定,PBS缓冲液洗涤2次,浸泡于PBS缓冲液中至少24 h后使用甲醛固定、石蜡包埋,切成3~4 μm大小用于HE染色。
1.6RT-PCR检测各鼠肺组织(右)100 mg左右,依据Trizol试剂说明书提取组织总RNA,PCR试剂盒反转录合成cDNA并扩增目的基因,反应总体系为25 μL。PCR产物经1.2%琼脂糖凝胶电泳确定其完整性,拍照并读取灰度值,分析IL-10、TGF-β1、Smad2、Smad3及Smad7 mRNA转录水平变化情况,见表1。

表1 IL-17、TGF-β1、Smad2、Smad3及Smad7引物序列表
1.7Westernblot检测各组大鼠肺组织(右)100 mg左右,使用液氮研磨,收集肺组织粉末,加蛋白抽提缓冲液500 μL,离心取上清液。将此样品加入4×SDS 上样缓冲液,100℃、3~5 min,孵育1~2 min,12 000 r/min离心1~2 min,-80℃保存待用。采用水浴式电印迹将凝胶中的蛋白电转移至硝酸纤维素滤膜(NC膜)上。将膜置于封闭液中过夜,加入一抗,室温缓慢摇动2 h洗膜,加入二抗,室温缓慢摇动1 h洗膜。而后细胞色素氧化酶二氨基联苯胺(DAB)显色、拍照分析,用奥德赛蛋白凝胶成像仪测定各条带的平均光密度值(A值),待测蛋白质表达量与β-actin 表达量。
1.8ELISA检测各组大鼠外周血3 mL,3000 r/min离心10 min,取血清保存于EP管,保存于-80℃冰箱,根据试剂盒说明书步骤操作,设置 450 nm波长的酶标仪上机检测。

2 结果
2.1大鼠肺组织形态学观察对照组肺包膜光滑,镜下肺组织支气管结构完整。管腔规则内外径未见明显炎性渗出(图1a、图1b);COPD模型组:肺整体外观苍白,镜下显示大量炎症细胞浸润特征,肺泡结构紊乱,支气管组织结构消失,支气管黏膜模糊混乱,支气管管腔变窄提示痉挛状态(图1c、图1d)。
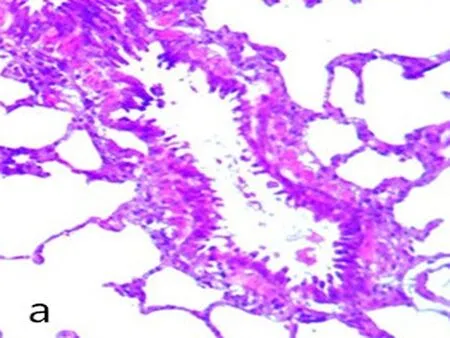
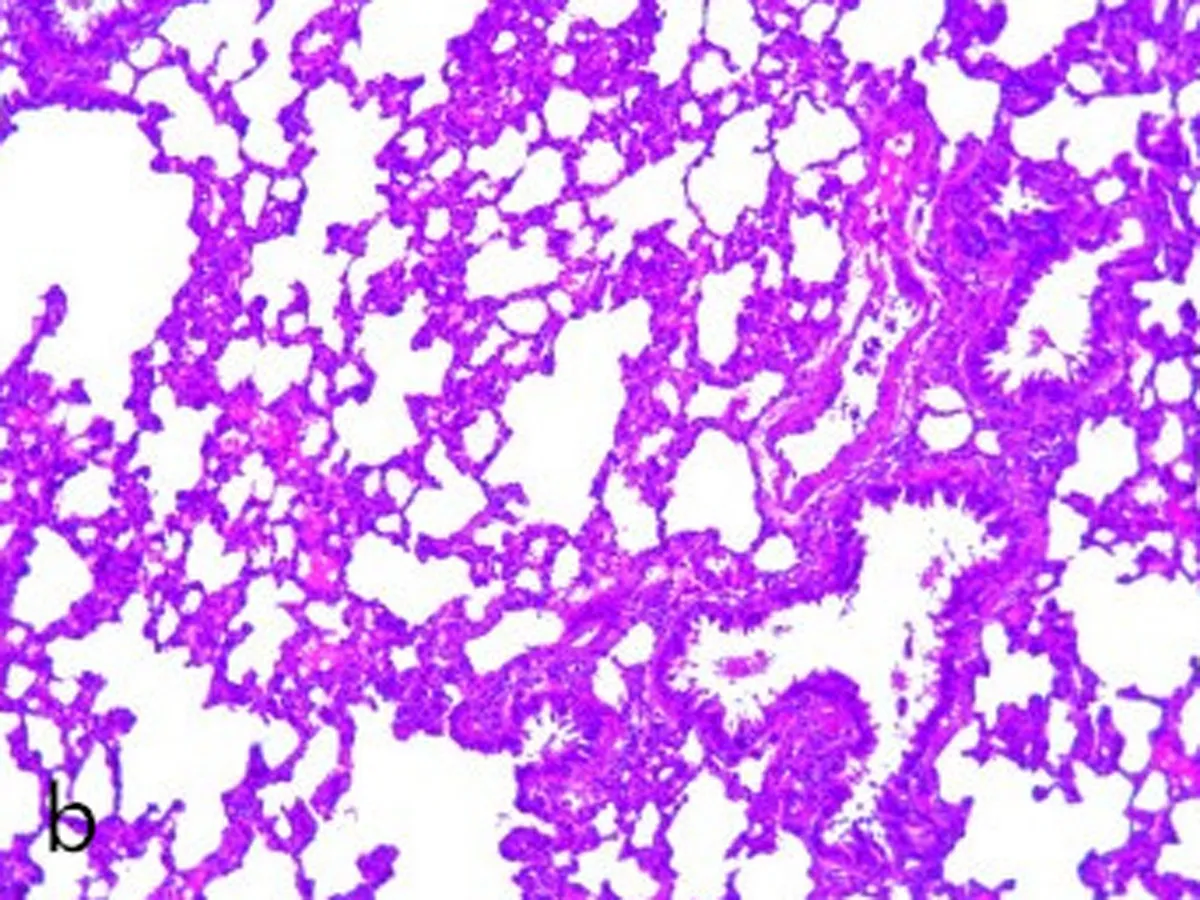
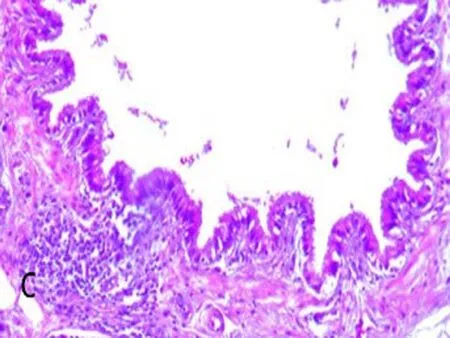
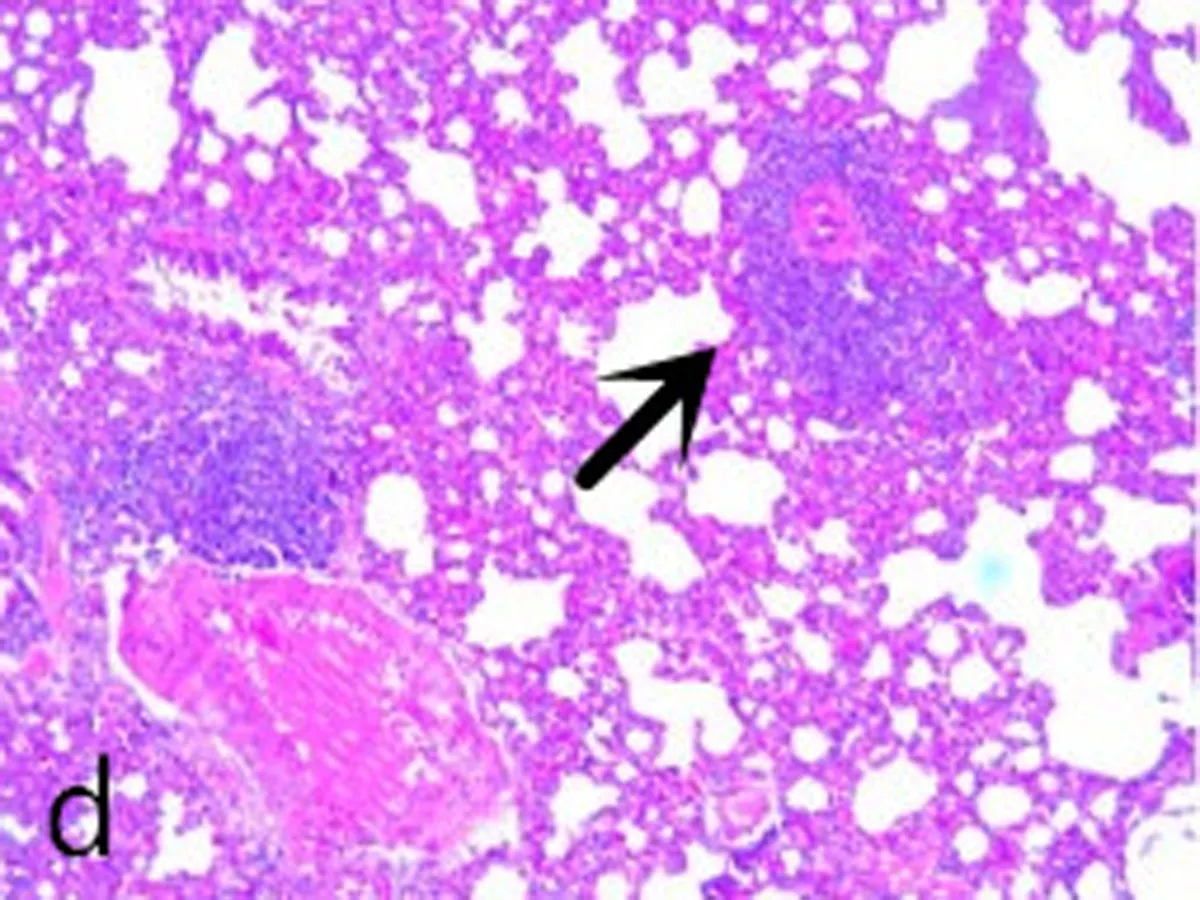
a、b: 对照组; c、d: 模型组; 箭头所示为COPD状态下,模型组大鼠肺组织主支气管气道上皮结构紊乱和消失,形态不规则和破裂,炎性细胞浸润,同时伴有支气管狭窄。
图12组大鼠肺组织病理图(HE×400)
2.22组RT-PCR定量检测结果比较与对照组比较,模型组Smad2/3 mRNA表达降低,差异有统计学意义(P<0.05),Smad7、IL-10及TGF-β1 mRNA表达均升高,差异有统计学意义(P<0.05),见表1。
2.32组Westernblot检测结果比较与对照组相比较,模型组p-Smad2/3蛋白磷酸化表达降低,差异有统计学意义(P<0.05),p-Smad7及TGF-β1 蛋白磷酸化表达均升高,差异有统计学意义(P<0.05),见图2及表2。

表1 2组大鼠肺组织IL-10、TGF-β1、Smad2/3及Smad7 mRNA水平的比较
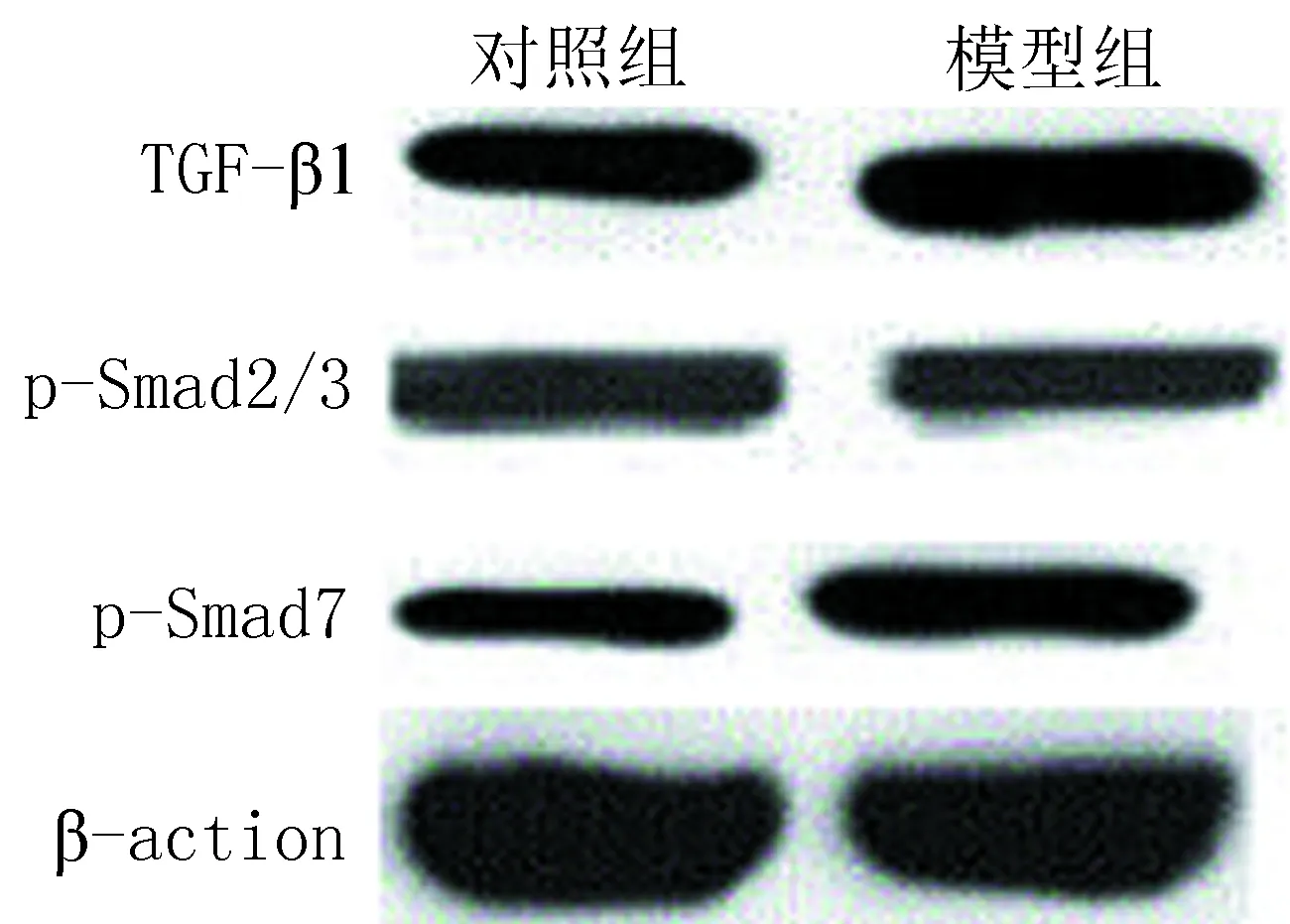
图2 2组大鼠肺组织中TGF-β1、p-Smad2/3和p-Smad7 蛋白磷酸化图

分组TGF-β1p-Smad2/3p-Smad7对照组0.74±0.270.65±0.240.95±0.18模型组2.95±1.020.20±0.370.23±0.10t值-8.5887.3479.657P值<0.001<0.001<0.001
2.4两组ELISA测定结果比较与对照组比较,模型组外周血中IL-10及TGF-β1蛋白水平升高,IL-17蛋白水平下降,差异有统计学意义(P<0.05),见表3。

表3 2组大鼠外周血IL-10、Smad2/3及Smad7蛋白水平的比较
3 讨论
COPD患者气道高反应性状态及气道重塑的发生、发展与多个炎性信号途径的激活与抑制密切相关。TGF-β1来源于肺气道上皮细胞,在COPD 患者肺组织上皮细胞、成纤维细胞和巨噬细胞等多种细胞中均发现 TGF-β1的高表达,以自分泌或旁分泌的方式通过激活其受体Smad2和Smad3,调节免疫应答、细胞增殖与分化、组织修复,对细胞外基质合成、创伤修复和免疫功能等起到调节作用[5-6]。Smad 蛋白在细胞质和细胞核间所进行的磷酸化转运过程可对 TGF-β信号通路进行动态调控,是TGF-β受体作用的直接底物,其中Smad2、Smad3和Smad7不仅参与了TGF-β的信号转导,同时参与COPD的气道重塑过程[7]。Smad2/3是TGF-β信号下传的第一个信号分子,Smad 蛋白转录复合物通过转移到细胞核与不同的Smad结合原件(smad-binding elements,SBE)、DNA 转录因子、转录共激活剂或共抑制剂结合,正性或者负性调控靶基因的表达[8],TGF-β诱导产生Smad7,与TGF-β水平呈正相关,和胞内激活的TGF-β受体结合后抑制反馈环[9]。Gao 等[10]发现在呼吸道合胞病毒(RSV)致支气管炎模型大鼠中IL-17、IL-23、IL-10及TGF-β水平均有升高。IL-17/IL-10失衡可能参与COPD发作时的T细胞免疫反应[11-12]。Thl7细胞的主要效应因子是IL-17,后者通过调节中性粒细胞发挥致炎效应;IL-10来源于Th2和部分Treg,能抑制Th1细胞应答及合成细胞因子,抑制巨噬细胞的抗原提呈功能及合成细胞因子,促淋巴细胞增殖、分化及抗体产生。
本次研究结果显示,与对照组比较,COPD模型组大鼠肺组织呈现出典型的气道炎症和肺气肿的病理特征,表现为局限于肺组织和散布于全身的系统性炎症反应。Smad2和Smad3 mRNA表达下降,IL-10、TGF-β1及Smad7 mRNA表达升高,p-Smad2和p-Smad3蛋白磷酸化水平下降,TGF-β1及p-Smad7蛋白磷酸化水平升高,与上述相关文献报道趋势一致。外周血中IL-17蛋白水平下降,IL-10蛋白水平上升;进一步证实,烟雾联合理化刺激能够加强体内炎症水平的升高,使气道炎性因子表达的增强,导致肺组织主支气管及终末支气管管壁增厚,气流受限,通气功能减弱。进一步证明Smad蛋白有转录激活与抑制的双重作用,在Smad2和Smad3基因表达减弱的情况下,Smad7基因表达增强,释放大量TGF-β1,并与其受体结合,磷酸化激活p-Smad2/3,使TGF-β/Smads通路激活,促进组织外TGF-β1、IL-10及IL-17炎症因子释放增加,使中性粒细胞趋化聚集于气道,使气道平滑肌细胞活化,促进炎症细胞浸润,形成正反馈,加重炎症反应对气道上皮的破坏。
综上所述,烟熏联合LPS气管内滴注方法能够有效活化COPD模型大鼠肺组织中TGF-β1和Smads蛋白表达,不同程度地上调炎症因子(IL-17、IL-10)表达,使TGF-β1/Smads通路处于激活状态。
