地佐辛对大鼠皮层星形胶质细胞的影响*
2018-10-29王永宏孙双春延育强崔晓刚
王永宏 孙双春 延育强 崔晓刚 王 瑞*
地佐辛(dezocine)是一种新型的镇痛药,是κ受体激动剂,也是μ受体拮抗剂[1]。地佐辛是苯吗啡烷类衍生物,不良反应低,无明显依赖性。目前,对地佐辛的药理机制尚未完全明确。星形胶质细胞属于神经胶质细胞的一种,具有神经元保护的功能、为神经元提供营养和代谢的保证,并且参与突触的形成[2]。
麻醉药对于神经元的影响与星形胶质细胞有着密切的关系[3-4]。本研究通过检测大鼠皮层星形胶质细胞中胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)表达,探讨地佐辛对大鼠皮层星形胶质细胞的影响。
1 材料与方法
1.1 实验动物
选取SD大鼠的乳鼠(出生0~1 d)10只,无任何颈部或头部淤血,大鼠乳鼠均购自福建医科大学实验动物中心,使用许可证号:SCXK(闽)2017-0002。
1.2 仪器与试剂
(1)仪器设备。Olympus BX5lTRF型荧光显微镜(日本Olympus公司);ELX-808IU型酶标仪(美国Bio-Tek公司);ALLEGRA X-12型离心机(美国Beckman公司);3111型二氧化碳培养箱(美国Thermo/Forma公司)。
(2)试剂。一抗GFAP(上海古朵生物科技有限公司);驴抗兔IgG二抗(武汉艾美捷科技有限公司);牛血清白蛋白试剂(北京百奥莱博科技有限公司);DAPI染剂(上海如吉生物科技发展有限公司)。
1.3 实验方法
1.3.1 大鼠皮层星形胶质细胞原代培养
选取SD大鼠的乳鼠,将其固定后,使用酒精在手术区皮肤处消毒,超净工作台中迅速地将乳鼠脑袋剥离,并置于事先配好的磷酸盐缓冲液(phosphate buffer solution,PBS)中,pH=7.4。使用镊子提取皮层,分离血管膜后置于PBS中,加入胰酶1 ml,于37 ℃培养箱中静置消化15 min后加入2 ml的完全培养基终止消化。以3500 r/min离心15 min,离心后调整细胞密度为5×105/cm2,在培养箱中培养。每两日换液1次。培养9 d后摇床中过夜(180 r/m,37 ℃),15 h后收集离心沉淀。
1.3.2 比色法检测细胞活性
配制5 mg/ml的四甲基偶氮唑(methyl thiazolyl tetrazolium,MTT)比色试剂储存溶液待用,于-20 ℃保存。将SD大鼠的乳鼠皮层星形胶质细胞接种于24孔板中,每孔加入40 μl的MTT溶液于400 μl完全培养基中,培养箱中孵育3 h。每孔加入100 μl的Formanzan溶解液,恒温摇床上培养1 h(120 r/min,37 ℃)。使用酶标仪测定吸光度(595 nm)。
1.3.3 免疫荧光法检测GFAP表达
石蜡切片经二甲苯脱蜡、梯度酒精水化,微波修复2次,将切片使用3%牛血清白蛋白(BSA)封闭1 h处理,然后分别滴加1∶50一抗GFAP,PBS冲洗3次后,滴加生物素标记的驴抗兔IgG二抗工作液,室温孵育30 min,PBS冲洗3次。用二氨基联苯胺(diaminobenzidine,DAB)显色处理,自来水冲洗,用4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)复染液复染;防蜕变水性封片剂封片。使用Olympus BX5lTRF荧光显微镜,将样片置于400倍镜下观察[5]。
1.3.4 细胞划痕实验
取经灭菌处理的玻片置于培养皿内,将星形胶质细胞种于玻片上,培养24 h后使用枪头轻轻的在玻片上快速划一条划痕,每个时间点光学显微镜观察拍照。
1.4 统计学方法
采用SPSS 19.0软件进行数据分析,计量资料采用均数±标准差(±s)表示,多组间比较使用方差分析,两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 各组星形胶质细胞活性比较
对照组细胞活性光密度(optical density,OD)值明显高于低剂量组、中剂量组和高剂量组;高剂量组细胞活性OD值明显低于低剂量组和中剂量组,对照组细胞活性OD值与其他3组比较,其差异有统计学意义(F=12.144,P<0.05),见表1。
表1 各组星形胶质细胞活性OD值比较(±s)
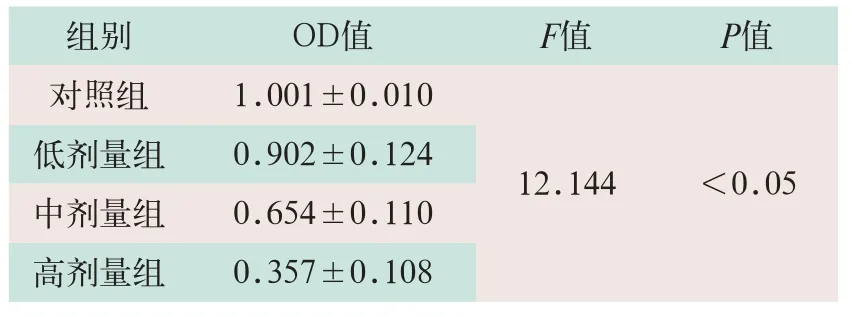
表1 各组星形胶质细胞活性OD值比较(±s)
低剂量组 0.902±0.124中剂量组 0.654±0.110高剂量组 0.357±0.108组别 OD值 F值 P值对照组 1.001±0.010 12.144 <0.05
2.2 各组GFAP荧光强度比较
对照组GFAP荧光强度明显高于低剂量组、中剂量组和高剂量组;高剂量组GFAP荧光强度明显低于低剂量组和中剂量组,对照组GFAP荧光强度与其他3组比较,其差异有统计学意义(F=84.645,P<0.05),见表2,如图1所示。
表2 各组GFAP荧光强度比较(±s)

表2 各组GFAP荧光强度比较(±s)
低剂量组 15.241±1.503中剂量组 10.528±1.311高剂量组 5.249±0.977组别 荧光强度 F值 P值对照组 18.122±1.241 84.645 <0.05

图1 GFAP免疫荧光染色图
2.3 各组细胞迁移情况比较
对照组迁移细胞数明显高于低剂量组、中剂量组和高剂量组;高剂量组迁移细胞数明显低于低剂量组和中剂量组,对照组迁移细胞数与其他3组比较,其差异有统计学意义(F=110.467,P<0.05),见表3,如图2所示。
表3 各组迁移细胞数比较(±s)

表3 各组迁移细胞数比较(±s)
低剂量组 23.36±3.8中剂量组 13.41±4.10高剂量组 3.20±1.03组别 迁移细胞数(个) F值 P值对照组 30.24±3.55 110.467 <0.05
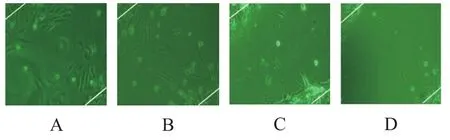
图2 各组细胞迁移图
3 讨论
神经性疼痛(neuropathic pain,NPP)指的是由躯体感觉神经系统的损伤或疾病而直接造成的疼痛[6]。NPP疼痛表现为自发性疼痛、痛觉过敏、异常疼痛和感觉异常等。临床调查显示,NPP患病率约为3.3%~8.2%[7]。NPP发病机制复杂,目前尚未完全明确,病因包括从物理、化学损伤到代谢性复合性神经病变。因此针对NPP临床上缺乏有效的治疗手段,在对NPP机制进行研究时,主要构建动物模型。星形胶质细胞属于神经胶质细胞的一种,主要具有神经元保护的功能。目前,星形胶质细胞和神经元的关系已成为神经生物学中的热点。神经元是主要调节大脑功能的细胞,可以释放多种递质等影响突触活动[8]。有研究显示,星形胶质细胞参与神经系统内兴奋性神经递质和抑制性神经递质的活性调节[9]。近年来,越来越多的研究证实,胶质细胞与NPP存在相关性。王伍超等[10]研究认为,神经胶质细胞迅速活化后,主导的神经炎症和神经免疫反应,在NPP发生和维持中发挥重要作用。神经损伤后,外周至中枢的胶质细胞活化释放许多细胞因子及炎性因子,促进了NPP。因此,调控胶质细胞功能可能是研究NPP的一个新方向。
地佐辛是阿片受体混合激动-拈抗剂,是κ受体激动剂,也是μ受体拮抗剂,具有镇痛作用,同时又拮抗μ受体,因此成瘾性较小,呼吸抑制作用较弱。地佐辛在人体内吸收,且分布迅速,因此地佐辛镇痛起效快、镇痛时间持久[11]。临床上地佐辛广泛应用于全麻诱导、术后镇痛、超前镇痛等[12]。Welch等[13]研究发现,建立坐骨神经慢性压迫性损伤大鼠模型,并给予一定剂量的吗啡后,可以显著降低大鼠术后的机械性缩足反射阈值。因此,推测地佐辛可能也具有类似的作用,但是地佐辛对于星形胶质细胞活性及迁移有无影响尚有待进一步研究。
GFAP是胶质细胞的标志性蛋白和主要的骨架成分[14]。研究显示,GFAP是星形胶质细胞合成必要的骨架蛋白,并且仅存在于星形胶质细胞的胞体中[15-16]。GFAP可反映星形胶质细胞活化的状态,因此可利用GFAP的特异性抗体来检测星形胶质细胞。本研究通过提取SD大鼠皮层星形胶质细胞进行原代培养,并给予不同剂量的地佐辛,检测GFAP表达和细胞迁移情况,探讨地佐辛对大鼠皮层星形胶质细胞的影响,为临床治疗NPP提供理论依据。GFAP表达上调的程度代表星形胶质细胞增生活跃程度,本研究结果显示,对照组细胞活性OD值、GFAP荧光强度值和迁移细胞数明显高于低剂量组、中剂量组和高剂量组;表明地佐辛可抑制大鼠皮层星形胶质细胞GFAP的表达、并抑制星形胶质细胞的发育,还可抑制大鼠皮层星形胶质细胞活性及迁移。同时,随着地佐辛剂量的增加,细胞活性OD值、GFAP荧光强度值和迁移细胞数显著降低;其结果表明,佐辛发挥镇痛作用可能与抑制星形胶质细胞的活化有密切关联。因此本研究推测,地佐辛发挥镇痛作用的同时,也可以抑制脊髓星形胶质细胞的活化。
地佐辛可抑制大鼠皮层星形胶质细胞活性及迁移,下调GFAP的表达,但是NPP的发病机制复杂,值得进一步探索地佐辛在治疗NPP的作用及其机制。
