和厚朴酚对神经病理性疼痛小鼠背根神经节TTX-R钠电流的影响
2018-10-29张诗嘉黄云盛安琪刘文涛张广钦
张诗嘉 黄云 盛安琪 刘文涛 张广钦
神经病理性疼痛(neuropathic pain)是临床常见的疾病,严重影响人们的身体健康, 国际疼痛研究协会把其定义为由躯体感觉神经系统的损伤或疾病而直接造成的疼痛。外周感觉神经通过DRG上的细胞体通过感觉神经元通路与中枢神经相连。因此, DRG神经在感觉刺激如疼痛传递到中枢神经系统过程在起着关键作用[1]。虽然多种因素都可导致神经病理性疼痛, 其发病机制并不十分清楚, 但钠通道被认为在疼痛中发挥着重要作用[2]。电压门控钠通道(VGSCs)分为河豚毒素敏感型(TTX-S)和TTX-R两种类型, 主要调控外周轴突损伤和炎症诱导的神经元异常兴奋。实验研究发现, 在小的DRG细胞主要表达TTX-R钠通道, 而在大的DRG细胞上主要表达TTX-S钠通道[3,4]。厚朴作为传统中药, 临床可用于多种疾病。Hon作为厚朴中提取的一种主要活性成分, 也发挥多种生理活性和药理作用[5,6]。近年有研究报道, Hon可以有效缓解福尔马林诱导的炎症疼痛, 且不会产生运动和认知方面的副作用[7]。此外, Hon明显降低谷氨酸受体激动剂引起小鼠热痛过敏和舔爪反应[8]。这些结果揭示了Hon在治疗炎症疼痛方面的治疗潜力, 但对神经病理性疼痛的研究未见报道。本研究在CCI病理性疼痛模型上, 观察Hon对TTX-R钠通道的影响, 从而探讨Hon可能的镇痛机制, 为探索Hon临床应用提供理论依据, 报告如下。
1 材料与方法
1.1 动物 昆明种小鼠, 雌雄不限, 体重18~22 g(南京青龙山动物中心提供, 实验动物生产许可证号:SYXK(苏)2017-0001)。
1.2 仪器 膜片钳放大器(EPC-10, HEKA, Germany);微电极拉制仪(P-97, Sutter, USA);微电极抛光仪(MF-900, Micro Forge)。
1.3 试剂和溶液的配制 台式液(mM):NaCl 137, CaCl21,MgSO4·6H2O 1.2, KCl 5.4, NaH2PO40.33, HEPES 10, 葡萄糖10, 用 NaOH 调 pH 至 7.4。电极内液 (mM):CsCl 140, MgSO4·6H2O2, HEPES 10, EGTA 5, ATP-Na2·3H2O 2, CaCl22, 用CsOH调pH至7.2。细胞外液(mM):NaCl 137, MgSO4·6H2O 1.2, KCl 5.4, NaH2PO40.33, HEPES 10, 葡萄糖 10, CaCl21,Nifedipine 0.005, 用NaOH 调pH至7.4。Hon溶液的配制:药物用于DMSO中配成10 mM母液, 使用时稀释所需浓度。
1.4 方法
1.4.1 CCI模型制备 有文献报道[9], 小鼠予4%水合氯醛(0.3 ml/10 g)腹腔麻醉, 分离左侧坐骨神经, 用5-0羊肠线松弛结扎形成压迫, 结扎共四道, 间隔1 mm, 共约5 mm, 使神经外膜轻度凹陷, 但不阻断血供, 缝合皮肤。
1.4.2 机械学痛阈测定(Von Frey Hairs法) 在安静状态下,室温保持23~25℃, 将小鼠置于透明的网格笼中, 以纤维丝尖部刺激小鼠足底, 从小逐渐增压至小鼠缩足, 每次测量间隔3 min, 此最大压力即为机械性刺激缩足反射阈值。术后每天测定, 7 d后基础阈值下降>40% , 即为造模成功。
1.4.3 DRG细胞分离 参考文献[10], 小鼠麻醉, 分离脊椎放入冷的台式液中, 分别从L4~6椎间孔中分离出DRG, 修剪后放入含胶原酶Ⅱ1 mg/ml台式液中37℃消化 1 h, 然后反复吹打, 台式液冲洗3遍, 过滤, 分离的单个细胞保存台式液中。
1.4.4 膜片钳记录 细胞加入装有细胞外液的细胞皿中,待细胞贴壁后, 使玻璃微电极与细胞形成高阻封接(>1 MΩ),破膜形成全细胞模式。应用膜片钳放大器记录钠电流。拉制的玻璃微电极充满电极内液后阻抗为3~5 MΩ, 数据低通滤波3 kHz, 采样10 Hz, 串联电阻补偿(>70%), Pulse软件完成对刺激参数的控制和数据的采集。实验温度保持在23~25℃。
1.5 统计学方法 采用SPSS22.0统计学软件进行数据统计分析。计量资料以均数±标准差()表示, 采用t检验;计数资料以率(%)表示, 采用χ2检验。P<0.05表示差异具有统计学意义。
2 结果
2.1 CCI小鼠机械痛阈值的变化 用测痛包测量小鼠机械痛阈值。CCI手术后从第5天开始, 小鼠机械痛阈值明显下降, 10 d后逐渐达到稳定, 14 d后, 疼痛阈值从(1.1±0.1)g下降到(0.4±0.1)g, 下降62.0 %, 表明CCI模型成功。见图1。
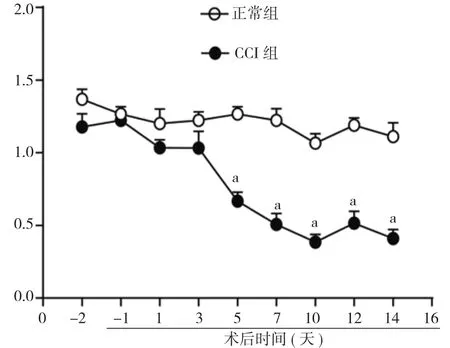
图1 CCI模型机械痛阈值的变化
2.2 Hon对CCI小鼠DRG TTX-R钠电流的影响 为了记录TTX-R钠电流, 实验选用<30 m DRG细胞, 0.5 M TTX加入细胞外液阻断TTX-S钠电流。钳制电压保持在70 mV, 细胞从50 mV开始去极化至70 mV, 每次增加5 mV, 脉冲持续200 ms,激活TTX-R钠电流。在正常DRG细胞上, 观察了Hon 的量效曲线。Hon 1100 M浓度范围内浓度依赖性抑制TTX-R钠电流, IC50 为28.1 M。在图2中应用30 M Hon。
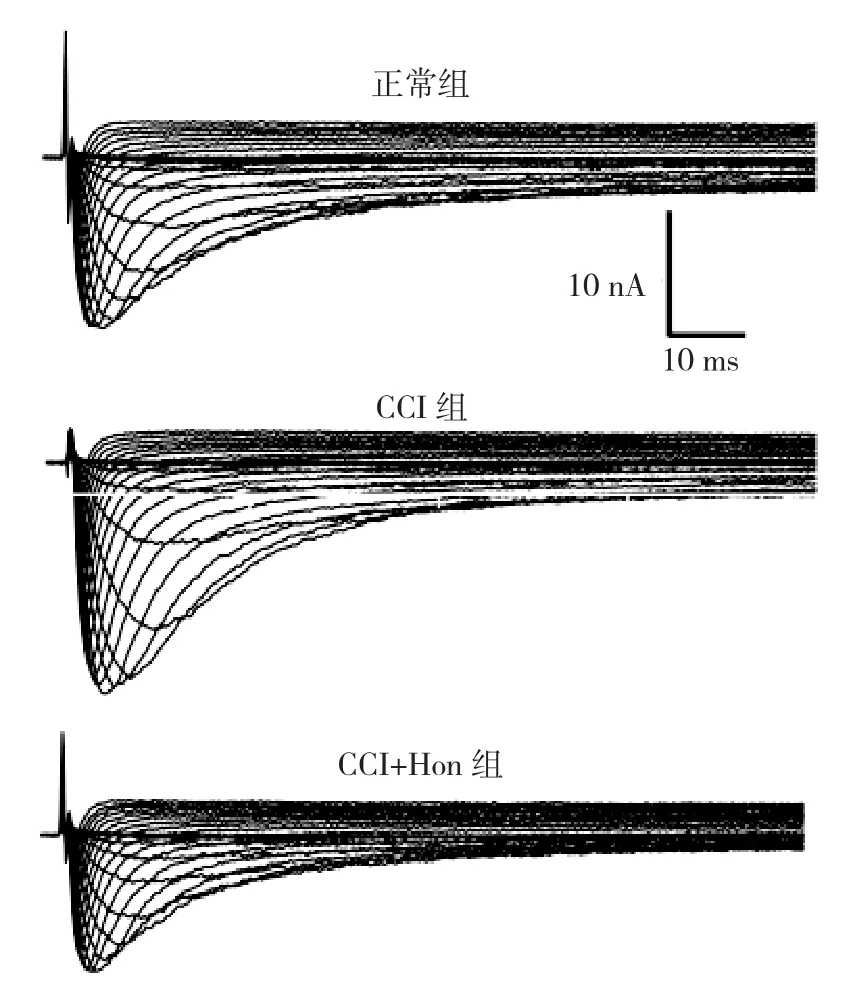
图2 正常组、CCI组和CCI给予30 M Hon后TTX-R钠电流原始图
在CCI模型上TTX-R钠电流明显增加, Hon 30 μM能较好的阻断TTX-R钠电流。电流-电压(I-V)关系显示见图3,与正常组比较, CCI模型组使TTX-R钠电流的最大激活电压从正常组5 mV左移至5 mV, 最大激活电流密度由(45.3±5.1) pA/pF增加至(57.7±5.9) pA/pF(P<0.05, n=10), 反转电位大约从+70.9 mV左移至+47.3 mV(P<0.05)。应用Hon后, 使CCI小鼠TTX-R钠电流最大激活电压恢复至0 mV, 最大激活电流密度减小到(27.9±4.9) pA/pF(与CCI组比较, P<0.05,n=10), 反转电位左移至+43.1 mV(与CCI组比较, P>0.05)。
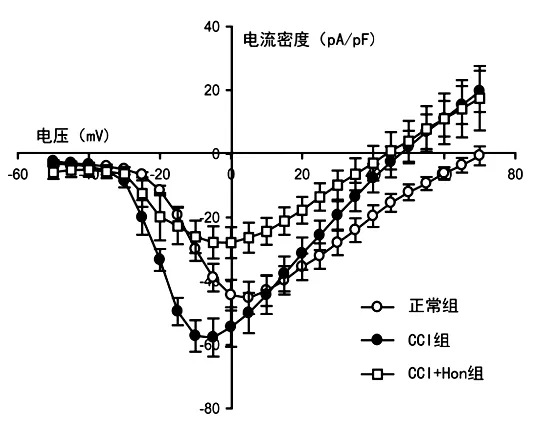
图3 Hon 对CCI小鼠DRG TTX-R钠电流I-V关系的影响
2.3 Hon对CCI小鼠DRG TTX-R钠电流激活曲线的影响 稳态激活曲线从I-V曲线数据获得。钠电流激活曲线用Boltzmann 方程拟合: G/Gmax = 1/{1+exp[(V1/2-V)/k]}, G是电导, Gmax是最大电导, V是测试电压, V1/2是半激活电压,k是斜率因子。G=I/(V-Vrev), I是钠电流, Vrev为反转电位。正常组TTX-R钠电流激活曲线的V1/2为(12.1±0.7) mV,k为(5.8±0.4)。与正常组比, CCI组使TTX-R钠电流的稳态激活曲线明显左移, V1/2为(16.9±2.1)mV(P<0.05, n=10),k为(5.2±1.1)(P>0.05);Hon使CCI小鼠TTX-R钠电流的稳态激活曲线明显右移, 趋向正常方向, V1/2和k分别为(12.4±2.6) mV 和 (8.05±1.0)(P<0.05, n=10)。见图 4。

图4 Hon 对CCI小鼠DRG TTX-R钠电流激活曲线的影响
2.4 Hon对CCI小鼠DRG TTX-R钠电流失活曲线的影响 采用双脉冲刺激, 细胞钳制在70 mV, 先给予200 ms, 从90 mV去极化至+20 mV, 每次增加10 mV的条件脉冲, 然后再给予一个100 ms去极化至+5 mV的测试脉冲。应用Boltzmann方程对TTX-R钠电流失活曲线进行拟合:I/I=1/{1+exp[(V-V1/2)/k]}, 其中I和Imax分别为电流和最大电流, V为条件脉冲电压, V1/2为半失活电压, k为斜率因子。正常组TTX-R钠电流的V1/2和k分别为(28.3±3.1) mV, k为(12.8±1.0)(n=9)。与正常组比, CCI组失活曲线无明显影响, V1/2和k分别为(29.6±2.9)mV和(15.6±2.5)(均P>0.05, n=9)。Hon能使CCI小鼠TTX-R钠电流的失活曲线明显左移, V1/2和k分别为(38.5±3.20) mV和(10.8±1.9)(均P<0.05, n=8)。见图5。

图5 Hon 对CCI小鼠DRG TTX-R钠电流失活曲线的影响
3 讨论
实验结果显示, 在CCI模型小鼠DRG细胞上TTX-R钠电流明显增加, 这将有助于产生较大疼痛刺激的兴奋性, 使疼痛幅度增加。此外, 最大激活电压向左偏移约10 mV, 激活曲线左移约4.8 mV, 但不影响失活曲线, 这显示疼痛兴奋性在较低的电压就可激发, 更利于疼痛信号的产生和传导。Hon能使CCI小鼠DRG细胞TTX-R钠电流明显减少, 从而降低刺激兴奋性, 抑制疼痛幅度。Hon使最大激活电压恢复到正常的0 mV左右, 通道的激活恢复趋向正常状态, 但失活曲线较CCI组向左偏移约4.5 mV, 使通道更易于关闭, 有利于阻止疼痛的产生和传导。所以, Hon对CCI诱导的神经病理性疼痛有明显的抑制作用。
神经病理性疼痛发病机制并不十分清楚, 临床常用的非甾体类镇痛药物治疗效果较差, 副作用较多。钠通道作为治疗疼痛的一个新靶点近来越来越受到重视[2,11]。在DRG神经细胞上, TTX-R钠通道主要包括Nav1.8和Nav1.9, Nav1.8在角叉菜胶诱导的炎症疼痛模型上其mRNA表达和电流均增加, 这将引起炎症性痛觉过敏[12]。选择性阻断Nav1.8可缓解慢性炎症疼痛和神经病理性疼痛[13]。Nav1.9在疼痛中的作用较复杂, 在大鼠炎症模型上, DRG神经元Nav1.9表达显著上升[14]。敲除Nav1.9将导致炎症痛机制的改变[15,16]。目前认为Nav1.9参与炎症痛[17], 对神经病理性疼痛有待进一步研究。本实验显示Hon对TTX-R钠电流有抑制作用,是否对两种亚型具有选择性有待下一步探讨。
一些传统的钠通道阻断剂如局部麻醉药、抗心律失常药等都显示了较好疼痛作用。因此开发具备镇痛作用的作用强,副作用少, 选择性强的钠通道阻断剂显示出较好的前景。由于Hon具有免疫调节作用, 因此, 其对炎性疼痛的镇痛效果可能与这有关。近来报道, Hon具有明显的镇痛作用[7,8], 其能够抑制谷氨酸, P物质和PGE2诱导的疼痛反应, 但对神经病理性疼痛作用仍需深入研究。本实验首次发现Hon在CCI模型上对TTX-R钠电流有明显抑制作用, 这为开发Hon作为治疗镇痛新药尤其治疗神经病理性疼痛的药物提供了可靠的理论依据。
