肺炎支原体铁吸收调节蛋白(Fur)的生物信息学分析
2018-10-26唐愈菲
唐愈菲
(1.邵阳学院 医学检验学院,湖南 邵阳,422000; 2.邵阳学院 分子生物学诊断重点实验室,湖南 邵阳,422000)
肺炎支原体是在1944年首次分离并培养的一种柔膜纲、支原体科微生物。Mp经常感染婴幼儿以及老年人等体弱患者。它是引发社区获得性肺炎的主要致病微生物之一。现在发现肺炎支原体感染还可能导致脑炎、心肌炎、肾炎以及溶血性贫血等多种并发症[1-2]。由于有许多无症状或症状较轻的肺炎支原体患者,他们经常极少去寻求治疗,导致肺炎支原体的患病率普遍被低估。支原体是目前已知最小的能够自我复制的生命形式,但是对支原体的致病机制并没有完全研究清楚。
铁元素是细菌细胞内一种非常重要的过渡金属,它参与了病原菌的DNA合成、RNA合成、电子传递以及运输氧等多种生理及生化过程,是病原菌生长和致病过程中必不可少的一种金属元素。但是如果细菌内铁离子浓度过高,会引起病原菌内的氧化失调,对病原菌造成损伤。细菌能够感知铁离子的含量,并改变一系列基因的表达来维持体内铁离子的平衡。实验证实铁吸收调节蛋白参与了调控细菌体内铁离子的浓度,此外Fur蛋白还参与了病原菌的致病作用[3]。由于支原体的基因数量极少,限制了它从环境中获得营养需求的功能[4]。到目前为止还不知道支原体是通过何种机制从环境中获得铁离子,本研究通过生物信息学分析肺炎支原体Fur蛋白的各种生物学性质,为研究Fur蛋白在肺炎支原体中的功能提供基础。
1 材料与方法
1.1 实验材料
Fur蛋白的序列从NCBI中获得(GenBank:BAV20560.1)。
1.2 研究方法
Fur蛋白的结构域使用NCBI在线软件分析;Fur蛋白的物理化学性质使用Protparam软件分析;Fur蛋白的亲水性和疏水性使用ProtScale预测(Kyte—Doolittle模型)[5];使用SignalP 4.1软件预测Fur蛋白是否含有信号肽[6];使用PSORT软件预测Fur蛋白的定位[7];Fur蛋白的二级结构使用Sopma软件进行预测[8];Fur蛋白的三级结构使用Swiss-model软件进行预测[9];Fur蛋白的B细胞表位使用Abcpred软件进行预测[10]。
2 结果
2.1 肺炎支原体Fur蛋白的结构域
采用NCBI中数据库分析肺炎支原体Fur蛋白的保守结构域,使用Blast搜索得到的结果如图1,发现目的蛋白具有Fur蛋白结构域,还具有DNA结合位点,证实目的蛋白是一个Fur蛋白。
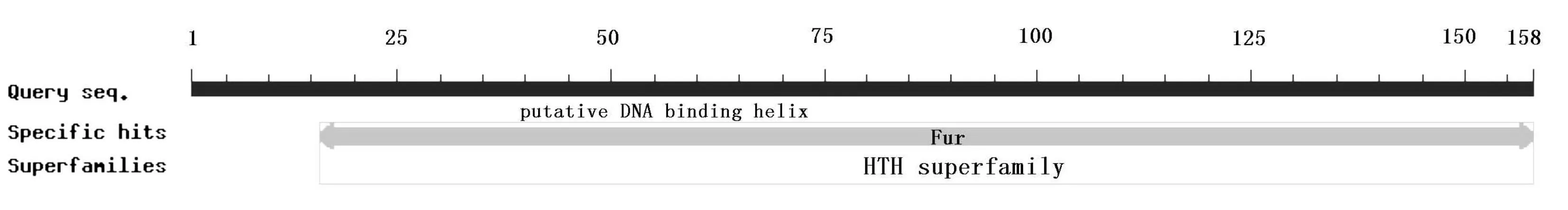
图1 肺炎支原体Fur蛋白的保守结构域分析Fig.1 Conservative domain analysis of Fur protein of MP
利用Protparam分析Fur蛋白的理化性质,结果可知它的理论分子量为18.9kDa,理论pI值是9.02。它的不稳定系数为30.66,比阈值40小,因此为比较稳定蛋白。平均亲水性系数为-0.561,故Fur蛋白为亲水性蛋白。
2.2 分析肺炎支原体Fur蛋白的亲疏水性
采用ProtScale软件中的Kyte—Doolittle算法预测Fur蛋白的亲疏水性质。预测结果如图2所示,其中得分为负值的为亲水性区域,正值部分是疏水性区域。其中37-44,72-89,129-132,145-152位氨基酸可能为疏水性区域,其他部分的氨基酸为亲水性区域,Fur蛋白总体呈亲水性,与Protparam软件的分析结果一致。
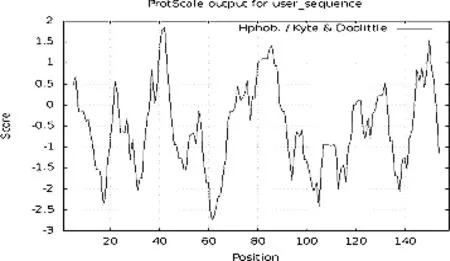
图2 使用ProtScale预测肺炎支原体Fur蛋白的亲疏水性Fig.2 Hydrophilic and hydrophobic prediction of MP Fur protein
2.3 Fur蛋白的定位
通过SignalP 4.1软件预测得知肺炎支原体Fur蛋白无信号肽,可能定位在支原体的细胞质(见图3),与使用PSORT软件预测的结果相符合,定位在细胞质。

图3 使用SignalP 4.1软件预测发现肺炎支原体Fur蛋白无信号肽Fig.3 The signal peptide prediction of MP Fur protein
2.4 肺炎支原体 Fur蛋白二级结构预测
使用Sopma软件预测肺炎支原体Fur蛋白的二级结构,预测发现Fur蛋白的α螺旋含量最高,占47.5%,无规卷曲占36.7%,β片层占12.7%(见图4)。

图4 利用Sopma软件预测肺炎支原体Fur蛋白的二级结构Fig.4 The secondary structure of MP Fur protein was analyzed by Sopma
2.5 肺炎支原体Fur蛋白三级结构预测
使用Swiss-model软件模拟Fur蛋白的三级结构,发现支原体的Fur蛋白与链球菌的Fur蛋白(PDB:4lmy.1.B)具有非常类似的结构,用链球菌的Fur蛋白为模板进行模拟,得到肺炎支原体的结构如图5所示,由两个Fur蛋白组成的同源二聚体。
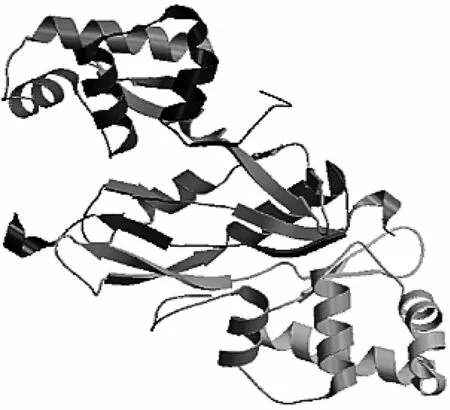
图5 利用Swiss-model软件预测肺炎支原体Fur蛋白的三级结构Fig.5 The 3D structure of MP Fur protein was constructed by Swiss-model
2.6 预测肺炎支原体Fur蛋白的B细胞表位
利用Abcpred在线软件预测肺炎支原体Fur的B细胞表位,其中得分为0.70以上的为可能的B细胞表位,预测结果发现Fur蛋白可能的B表位有8条多肽(见表1),证明Fur具有非常好的免疫原性。

3 讨论
临床上肺炎支原体感染导致的肺炎患者越来越多,目前发现肺炎支原体能从多个方面对宿主造成损伤。目前已有实验证实肺炎支原体使用粘附素蛋白与宿主粘膜上皮细胞发生相互作用,直接破坏宿主细胞。肺炎支原体的CARDS毒素在致病过程中起重要功能,研究证实ADP-核糖基化活性与它的N端有关,它的C端具有空泡活性和受体结合功能[11]。肺炎支原体能够引起宿主的免疫功能混乱从而致病。调查发现临床分离得到的肺炎支原体耐药率也不断升高,治疗肺炎支原体感染变得愈发困难[1-2]。肺炎支原体致病的前提是能够在患者体内获得足够多的营养物质,但是肺炎支原体调控获取铁元素的机制尚无研究。
铁是细菌体内重要的金属元素之一,在细菌的生长,代谢和致病中都起到极为重要功能。病原菌在进化过程中形成了多种铁摄取系统。可是如果铁含量过高,会通过Fenton反应导致细菌细胞内活性氧物质含量增高,从而破坏细菌的DNA、蛋白质等大分子物质,会引发对细菌的毒性。故必须严格调控病原菌细胞内铁平衡。研究证实病原菌是通过Fur蛋白控制铁的含量。Fur是广泛存在在细菌内的一种负向调控因子,当细菌体内铁元素过多时候,Fur蛋白与铁结合,抑制细菌摄入铁元素。当细菌体内铁元素含量过低时,Fur与铁解离,从而开始摄入大量的铁元素[3]。Fur蛋白需要Fe2+作为共同的辅助因子,所以可以使用Fe2+来控制Fur蛋白的活性。Fur蛋白通过调控过氧化氢酶和超氧化物歧化酶等多种酶物质的表达来抵抗氧化胁迫,Fur能够调控多种毒力蛋白的表达和糖代谢等多种生理生化途径[3,12-13]。此外,Fur蛋白可以控制病原菌中锌和锰等重金属的摄取[3]。肺炎支原体的基因组中具有一个Fur蛋白,在前期的研究中克隆获得了肺炎支原体Fur蛋白,并通过基因工程的方法纯化得到了Fur蛋白,但是它的生物学特性并不完全清楚[14]。文中使用生物信息学方法分析了肺炎支原体Fur蛋白的分子量、定位、亲疏水性、二级结构和三级结构等生物学特性,发现肺炎支原体Fur蛋白与链球菌的Fur蛋白结构非常类似,故预测它与链球菌Fur蛋白具有类似的功能,能够上调抗氧化蛋白的表达,起抗氧化功能[15]。应进一步使用基因敲除等方法,将肺炎支原体中的Fur蛋白敲除,检测突变株肺炎支原体在氧化应激下的生长情况,进一步研究Fur蛋白在肺炎支原体中的功能。
