微泡菌ALW1褐藻胶裂解酶AlgL14的表达及信息学分析
2018-10-26吴利洋梁梅芳肖安风姜泽东朱艳冰
吴利洋,梁梅芳,倪 辉,2,3,4,肖安风,2,3,4,姜泽东,2,3,4,朱艳冰,2,3,4
(1.集美大学食品与生物工程学院,福建 厦门 361021;2.福建省食品微生物与酶工程重点实验室,福建 厦门 361021;3.厦门市食品与生物工程技术研究中心,福建 厦门 361021;4.厦门市南方海洋研究中心经济海藻资源化利用与深加工重点实验室,福建 厦门 361021)
0 引言
褐藻胶是一种阴离子酸性直链多糖,它主要来源于褐藻类植物的细胞壁,是由β-D-甘露糖醛酸(M)和α-L-古罗糖醛酸(G)通过β-1,4糖苷键连接构成的线性高分子聚合物[1]。褐藻胶来源广泛,因为其具有增稠性、稳定性、凝胶性和螯合金属离子等特点,所以被广泛应用在食品、医疗、印染和化工等领域[2-4]。褐藻寡糖作为褐藻胶的降解产物,具有多种生物活性,如抗菌、抗氧化、抗凝血、降血糖、降血脂、抗肿瘤等[5]。
褐藻胶裂解酶具有β-消除催化裂解褐藻胶糖苷键的能力,产生多种不饱和糖醛酸寡糖及不饱和糖醛酸单体[6]。褐藻胶裂解酶具有底物专一性,据此可以将该酶分为多聚β-D-1,4-甘露糖醛酸裂解酶(EC 4.2.2.3)和多聚α-L-1,4-古罗糖醛酸裂解酶(EC 4.2.2.11)两大类。褐藻胶裂解酶生物来源十分广泛,如陆生真菌、土壤细菌、病毒、海洋细菌、棘皮动物、海洋软体动物和海藻类等[7],其中细菌类是该酶最为广泛的提取来源,如假交替单胞菌[8-10]、弧菌[11]、黄杆菌[12]、芽胞杆菌[13-14]、链霉菌[15]等。褐藻胶裂解酶被普遍认为是定向制备褐藻寡糖的有力工具,因而,不断寻找开发新的褐藻胶裂解酶的菌种资源,进而研究褐藻胶裂解酶,对实现褐藻寡糖的高效应用具有深远的意义。
在先前的研究中,本课题组从腐烂海带中筛选出一株褐藻胶裂解酶高产菌株ALW1,鉴定为微泡菌属(Microbulbifersp.)[16]。本研究进行Microbulbifersp.ALW1褐藻胶裂解酶AlgL14基因的克隆、表达及信息学分析,为该菌株褐藻胶裂解酶AlgL14的酶学性质、酶的结构与功能研究奠定基础。
1 材料与方法
1.1 实验材料
菌株ALW1由本实验室筛选获得;EscherichiacoliDH5α和E.coliBL21(DE3)菌株由本实验室保存;pET-28α(+)载体为Novagen公司产品;pMD18-T载体、Taq DNA聚合酶、dNTPs和DNA标准均为TaKaRa公司产品;T4DNA连接酶为Fermentas公司产品;细菌基因组DNA提取试剂盒购自广州东盛生物技术有限公司;Ni-NTA琼脂糖树脂为GE Healthcare公司产品;柱式质粒DNA提取试剂盒和柱式DNA胶回收试剂盒均为天根生化科技(北京)有限公司产品;寡核苷酸序列的合成及核酸序列的测定均委托厦门铂瑞生物科技有限公司完成;褐藻酸钠为国药集团产品;其余试剂均为分析纯产品。
1.2 褐藻胶裂解酶AlgL14基因的克隆
根据Microbulbifersp.ALW1褐藻胶裂解酶AlgL14的基因序列,合成以下引物,P1:5′-CGCGGATCCACCGAGGTTCGAGGAGCGATTG-3′(下划线部分为BamHI酶切位点),P2:5′-CCGCTCGAG CAAAGAGCAAGGAGATTTCGTGTCC-3′(下划线部分为XhoI酶切位点)。将菌株ALW1的基因组DNA作为模板,用PCR技术扩增特异的基因片段,反应条件为:95 ℃ 5 min 预变性;94 ℃ 55 s,55 ℃ 45 s,72 ℃ 90 s,30个循环;72 ℃延伸10 min。PCR产物经质量分数1%琼脂糖凝胶电泳检测后,凝胶回收目的基因片段。将回收产物与pMD18-T载体进行连接,转化E.coliDH5α感受态细胞。细胞涂布在含有100 μg/mL氨苄青霉素的LB固体培养平板上(平板上预先涂布10 μL 0.5 mol/L IPTG和50 μL 20 g/L X-gal)。从平板挑选白色单菌落进行菌落PCR鉴定重组子,并经测序鉴定重组质粒中的插入序列。
1.3 基因及其编码产物的生物学信息分析
利用NCBI的BLAST程序在GenBank数据库中进行蛋白质序列的同源性搜索。利用MEGA 6.0[17]的邻接法(Neighbor-Joining,NJ)构建系统发育树。利用ExPASy的Protparam工具进行蛋白质的理化性质预测。蛋白质二级结构预测采用NPS服务器(https://npsa-prabi.ibcp.fr/)上的GOR4法[18]进行,利用NCBI的CD Search程序[19]在GenBank数据库中进行蛋白质的结构域分析。利用Modeller 9.15[20]进行蛋白质结构的三维模建,采用VMD软件显示蛋白质的空间结构。
1.4 褐藻胶裂解酶AlgL14重组表达质粒的构建
用BamHI和XhoI对连接有褐藻胶裂解酶AlgL14基因的T载体和表达载体pET-28α(+)进行双酶切,电泳后回收目的片段,然后用T4DNA连接酶连接,连接产物转化大肠杆菌DH5α感受态细胞,菌落PCR筛选阳性克隆,提取质粒进行测序验证,所构建的重组表达质粒命名为pET-28α-algL14。
1.5 褐藻胶裂解酶AlgL14的诱导表达和纯化
1.5.1 诱导表达
将重组表达质粒转化至表达宿主E.coliBL21(DE3),经菌落PCR筛选阳性克隆后,挑取阳性转化子的单菌落,接种于10 mL LB液体培养基(含100 μg/mL卡那霉素),37 ℃振荡培养过夜,将培养菌液按1%(V/V)比例接种到100 mL LB液体培养基(含100 μg/mL卡那霉素),37 ℃振荡培养至A600值达到0.6~0.8,加入异丙基硫代半乳糖苷(isopropy thiogalactoside,IPTG)至终浓度为0.05 mmol/L,在12 ℃、200 r/min条件下诱导表达20 h。离心收集菌体,利用SDS-PAGE分析蛋白质的表达情况。
1.5.2 蛋白质纯化
采用Ni-NTA琼脂糖亲和层析柱进行纯化。将节1.5.1收集的菌体悬浮于10 mL预冷的缓冲液(50 mmol/L NaH2PO4,300 mmol/L NaCl,15 mmol/L咪唑,pH=8.0),冰浴条件下进行超声破菌,4 ℃下15 000 r/min离心20 min,收集上清液,用0.22 μm的滤膜过滤,将滤液参照Zhu等[21]的方法进行目的蛋白的纯化。取适量样品进行SDS-PAGE电泳分析洗脱样品的纯度,利用Bradford法[22]测定蛋白质的浓度。
1.6 褐藻胶裂解酶的活力测定
采用DNS(3,5-二硝基水杨酸)法[23]测定还原糖含量。0.9 mL的质量分数0.3%褐藻酸钠底物(溶于50 mmol/L磷酸钠缓冲液中)加入0.1 mL酶液,混合物于40 ℃水浴中反应15 min后,加入1 mL DNS试剂,并煮沸5 min显色,然后立即冷水冷却至室温。反应液定容至5 mL,在540 nm下测定吸光度值。以灭活酶液作为空白对照。在上述条件下,每分钟水解底物产生1 μg还原糖(以葡萄糖计)所需的酶量为1个酶活力单位(U)。
2 结果

2.1 褐藻胶裂解酶AlgL14基因的克隆
以Microbulbifersp.ALW1的基因组DNA为模板,利用褐藻胶裂解酶AlgL14的特异性引物进行PCR扩增。琼脂糖凝胶电泳显示,扩增产物为大约1 300 bp的DNA片段(见图1)。将该基因克隆入T载体后进行测序分析,结果显示,目的基因的大小为1 350 bp。
2.2 褐藻胶裂解酶AlgL14基因及其编码产物的序列分析
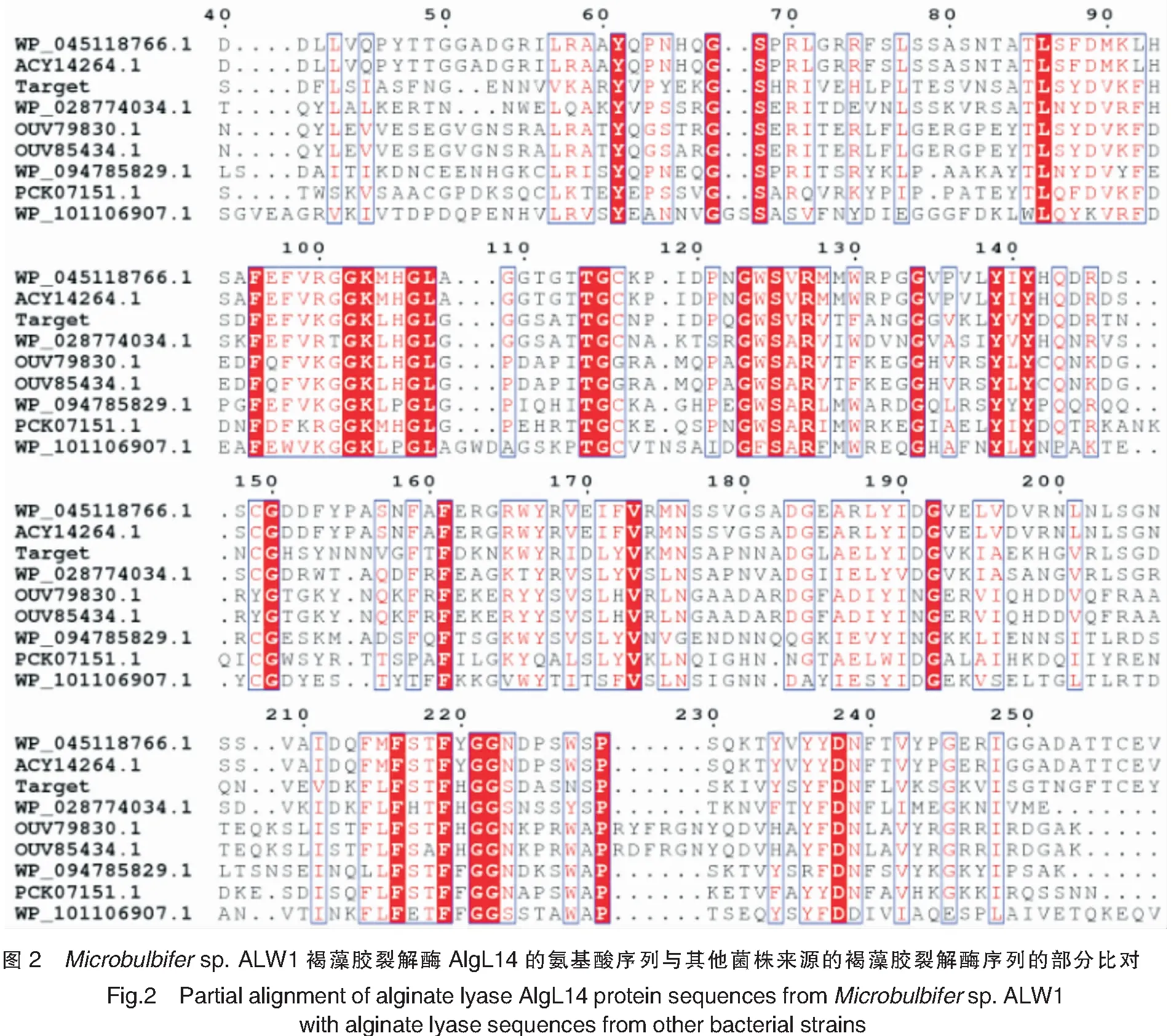
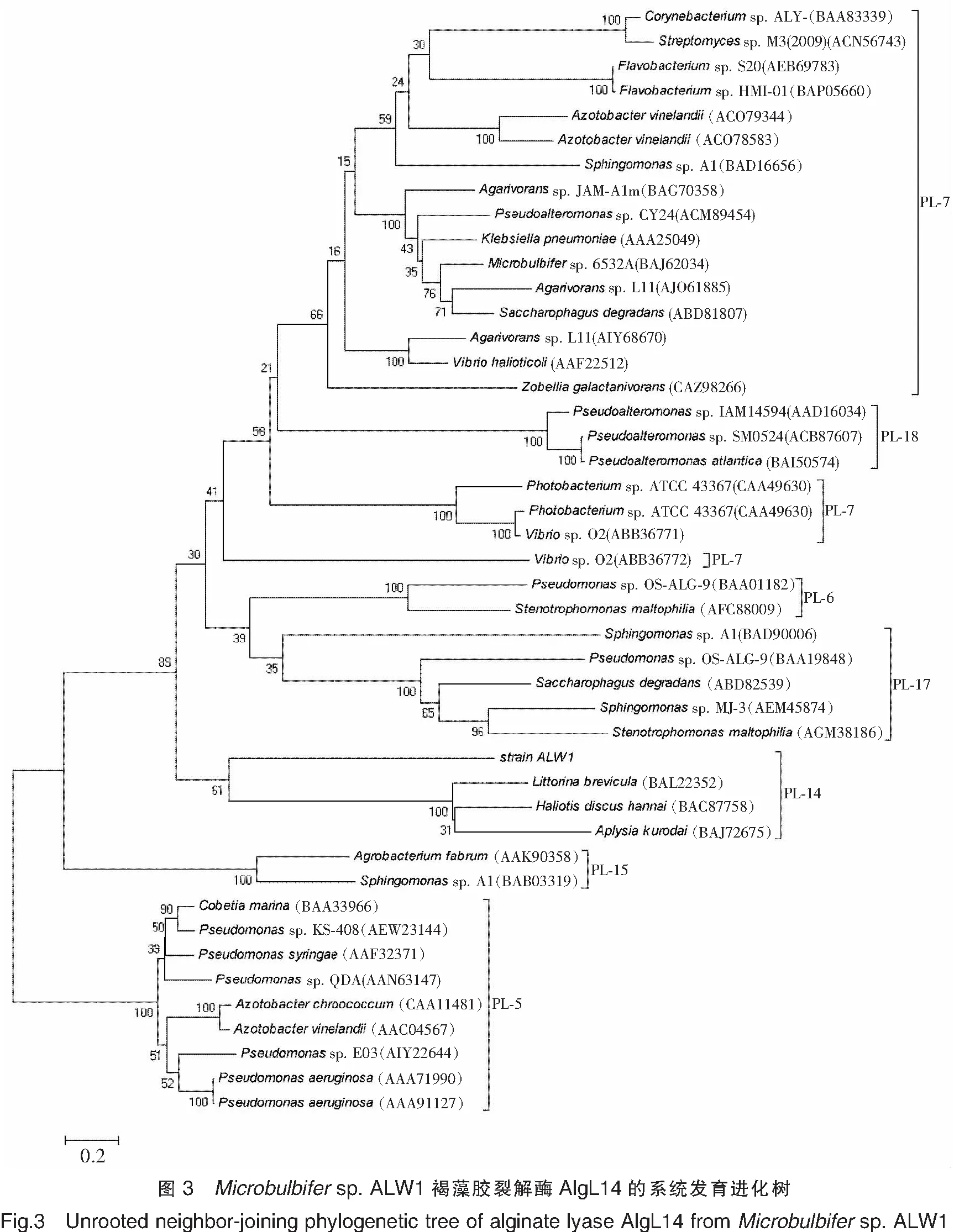
Microbulbifersp.ALW1褐藻胶裂解酶AlgL14基因(1 350 bp)预测编码449个氨基酸。该蛋白质的前33个氨基酸残基预测为信号肽,预测的切割位点位于A33和A34之间。将该蛋白质序列在GenBank的Reference proteins数据库中进行同源性搜索,结果显示,目的基因编码的蛋白质序列与来自Shewanellawaksmanii(WP_028774034.1)、Haliangiumochraceum(WP_045118766.1)、HaliangiumochraceumDSM 14365(ACY14264.1)、Psychromonassp.psych-6C06(WP_101106907.1)、OpitutalesbacteriumTMED158(OUW17800.1)、Alteromonadaceaebacteriu(PCK07151.1)、GammaproteobacteriabacteriumTMED134(OUV79830.1)和Zooshikellaganghwensis(WP_094785829.1)的多聚β-D-甘露糖醛酸裂解酶或褐藻胶裂解酶的序列分别具有57%、47%、47%、44%、41%、40%、40%和40%的相似性,所以预测目的基因编码产物为褐藻胶裂解酶。将本研究的菌株ALW1褐藻胶裂解酶序列与其他菌株来源的褐藻胶裂解酶序列进行比对,结果如图2所示。将本研究的菌株ALW1褐藻胶裂解酶AlgL14序列与其他多糖裂解酶家族来源的褐藻胶裂解酶序列进行系统发育分析,结果(见图3)显示,该褐藻胶裂解酶与PL-14家族褐藻胶裂解酶具有较近的亲缘关系,属于PL-14家族褐藻胶裂解酶。
2.3 褐藻胶裂解酶AlgL14基因编码蛋白质的理化性质
利用ExPASy的ProtParam工具分析目的基因所编码蛋白质的序列,结果如下:氨基酸个数为449,理论分子质量大小为48.8 ku;理论等电点为6.27,负电荷残基总数为43(D+E),正电荷残基总数为39(R+K);分子式为C2169H3290N584O670S18,原子总数为6 731;预测在大肠杆菌细胞内半衰期大于10 h,不稳定指数为25.21,该蛋白质分类为稳定蛋白;脂溶指数为70.36,亲水性平均指数(grand average of hydropathicity,GRAVY)为-0.258。
2.4 褐藻胶裂解酶AlgL14的二级结构和结构域
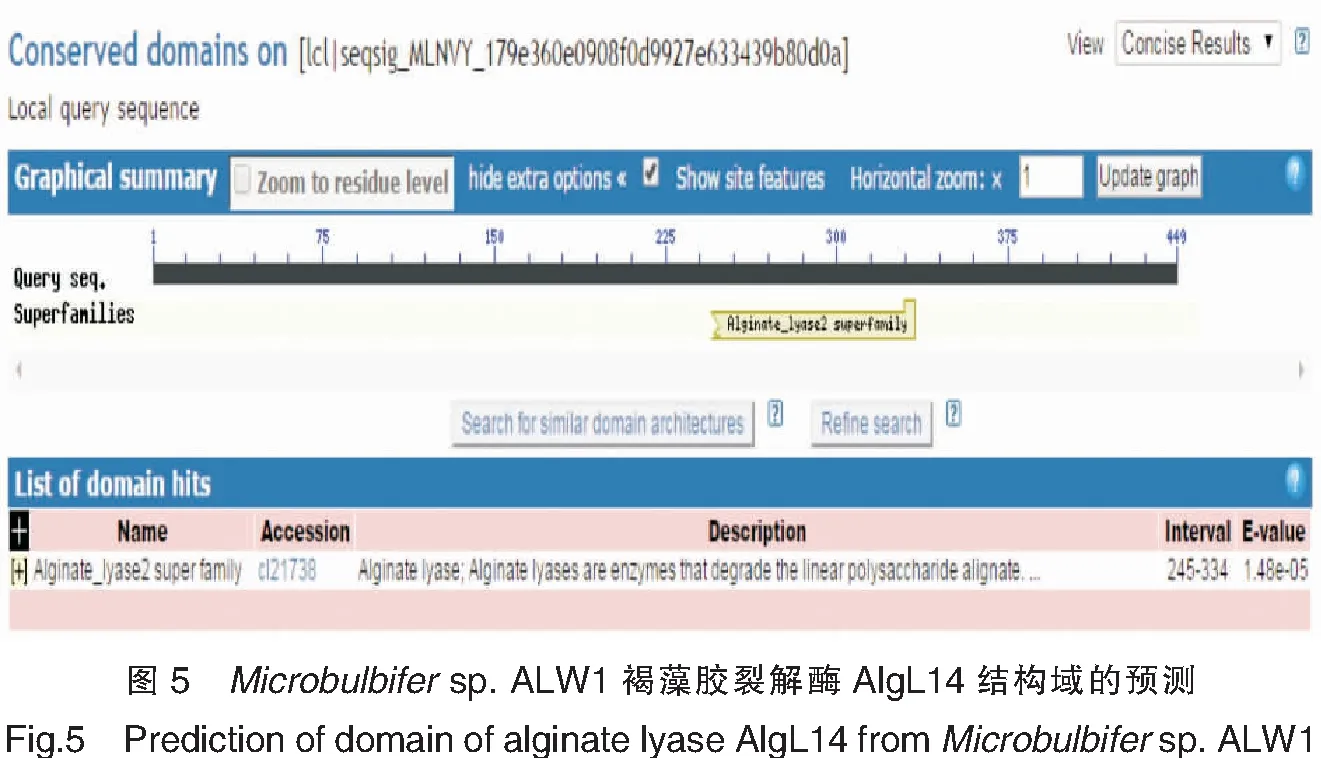
预测Microbulbifersp.ALW1褐藻胶裂解酶AlgL14的二级结构,结果如图4所示。α-螺旋、β-折叠和不规则卷曲所占比例分别为17.37%、59.91%和22.72%。该蛋白质包含褐藻胶裂解酶结构域,位于245~334位氨基酸残基,结果如图5所示。
2.5 褐藻胶裂解酶AlgL14的三级结构
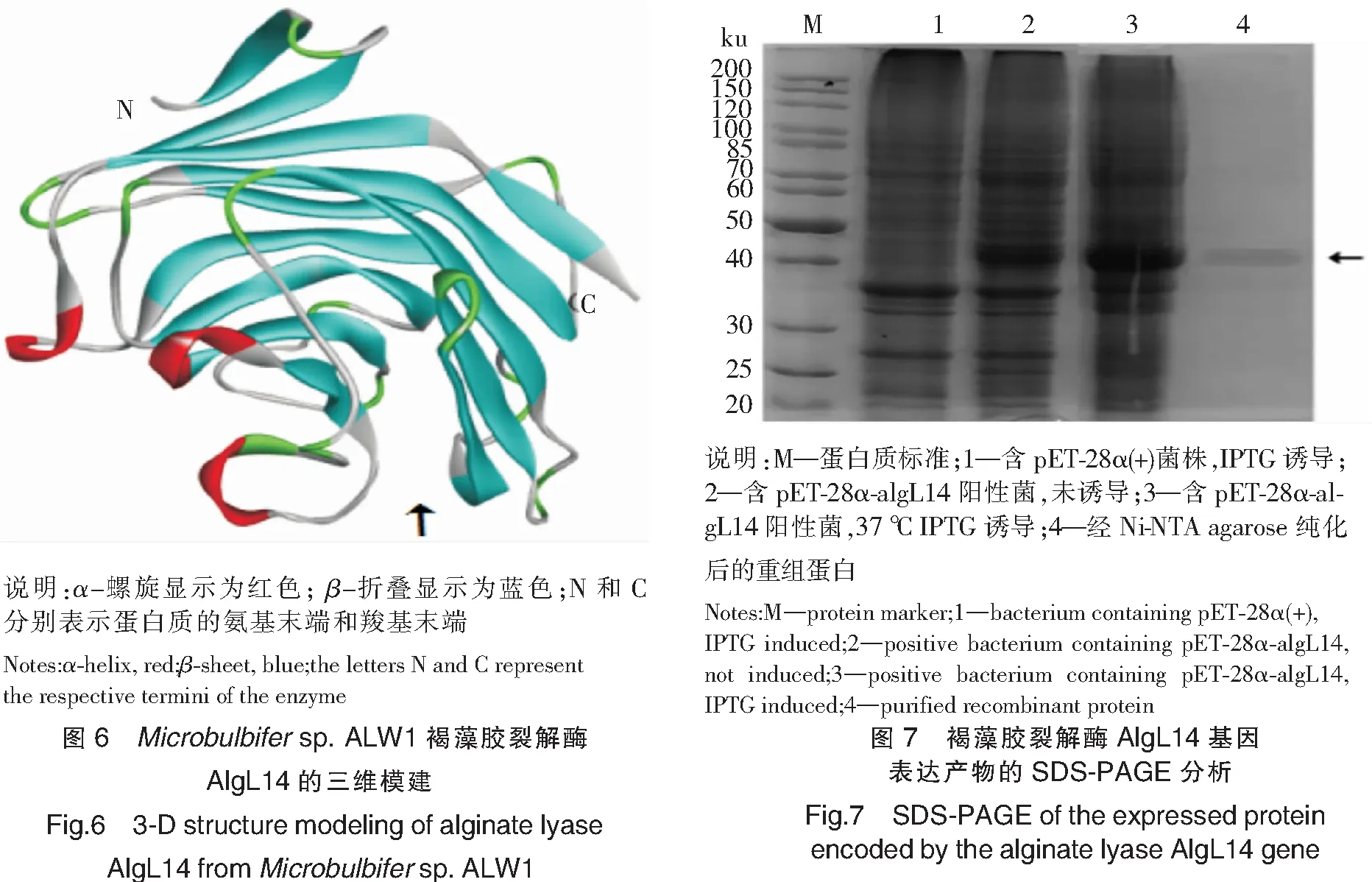
将Microbulbifersp.ALW1褐藻胶裂解酶AlgL14进行三维模建,利用Modeller 9.15多模板建模的功能,选择多个模板预测菌株ALW1褐藻胶裂解酶AlgL14的三级结构。模板在PDB数据库中的登录号分别为5GMT_B、3GNE_B和2ZZJ_A。由图6可以看出,Microbulbifersp.ALW1褐藻胶裂解酶AlgL14富含β-折叠,整体结构由多个反向平行的β-折叠组成,呈β-果冻卷状。AlgL14结构中存在一个宽度较大的裂隙(图6箭头所示)。
2.6 褐藻胶裂解酶AlgL14的表达与纯化
将重组褐藻胶裂解酶表达质粒转化至表达宿主E.coliBL21(DE3),进行IPTG诱导和SDS-PAGE电泳分析。结果显示,pET-28α(+)表达质粒插入目的基因,经IPTG诱导后,与pET-28α(+)的空载(图7的道1)和未诱导的pET-28α-algL14阳性菌(图7的道2)相比较,被诱导表达的含有pET-28α-algL14的阳性菌在45 ku左右有明显的融合蛋白表达条带(图7的道3)。破碎菌体后,上清液用Ni-NTA agarose亲和柱纯化,得到重组蛋白(图7的道4),分子质量为48.8 ku。
2.7 重组褐藻胶裂解酶的活力测定结果
DNS法检测还原糖含量,进而对纯化的褐藻胶裂解酶AlgL14的酶活力进行测定,结果显示,重组褐藻胶裂解酶AlgL14的酶活力为1.14 U/mg。
3 讨论
使用褐藻胶裂解酶可以制备具有多种生物活性的寡糖。此外,褐藻胶裂解酶在医药、海藻工程、褐藻胶的代谢研究等方面具有极其重要的作用。本研究中,从Microbulbifersp.ALW1的基因组中成功扩增了1 350 bp的褐藻胶裂解酶基因片段,该基因编码的蛋白质与其他菌株来源的褐藻胶裂解酶具有中等程度的相似性。将含有褐藻胶裂解酶基因的重组表达质粒转化至表达宿主E.coliBL21(DE3),在37 ℃条件下利用0.5 mmol/L IPTG进行诱导表达时,目的蛋白在细胞内主要以包涵体形式存在,利用亲和层析纯化不到可溶性重组蛋白(结果未示)。本研究中,在12 ℃条件下利用0.05 mmol/L IPTG进行诱导表达时,获得了低浓度的重组蛋白,酶的活力分析显示,目的蛋白具有褐藻胶裂解酶的活力。
褐藻胶裂解酶是多糖裂解酶家族(PLs,EC 4.2.2.-)的成员,根据酶的初级结构可将PLs分为22个家族,褐藻胶裂解酶属于7个家族,分别为PL-5,PL-6,PL-7,PL-14,PL-15,PL-17和PL-18,大多数细菌来源的内切褐藻胶裂解酶属于PL-5和PL-7,而前者多具有降解多聚β-D-甘露糖醛酸底物的特异性,后者多具有降解多聚α-L-古罗糖醛酸底物的特异性[23]。系统发育进化分析显示,Microbulbifersp.ALW1褐藻胶裂解酶AlgL14归属于PL-14家族多糖裂解酶。本研究中,Microbulbifersp.ALW1褐藻胶裂解酶AlgL14的空间结构主要为β-折叠,类似的结构常见于葡萄糖淀粉酶和纤维素酶。AlgL14结构中存在一个较大的裂隙,预测该结构能使得褐藻胶底物分子容易渗透进入,并与酶催化位点相互作用。
Microbulbifersp.ALW1褐藻胶裂解酶AlgL14的克隆与表达为该酶的进一步研究以及工业化生产和应用打下良好的基础。在未来的研究中,可以进行Microbulbifersp.ALW1褐藻胶裂解酶AlgL14的酶学性质以及酶的结构与功能研究。
