双向衍生化结合UPLC-MS/MS对唾液酸化N-聚糖的氧乙酰化修饰分析
2018-10-26张启伟吴兆冠
付 仙,张启伟,吴兆冠,郑 琦
(江汉大学 化学与环境工程学院;交叉学科研究院,湖北 武汉 430056)
0 引言
N-连接糖基化作为广泛且重要的蛋白质翻译后修饰丰富了蛋白质的结构和功能,N-聚糖因此参与到有机体各个阶段的生命活动中,丰富的生物学功能使得N-聚糖的研究具有重要的生物学意义和临床医学价值[1]。唾液酸化N-聚糖上丰富的氧乙酰化修饰极大地提高了N-聚糖在生物信号介导、生物识别中的作用。位于N-聚糖最外端的唾液酸残基被认为与疾病感染、炎症反应乃至人类的进化息息相关,也是生物修饰多发位点之一[2-4]。因此,进一步探讨其精细结构有重要意义。
目前分析N-聚糖结构最主要的方法是质谱法,在众多质谱方法中,液相色谱质谱联用(liquid chromatography-mass spectrometry,LC-MS)被认为是当前分析N-聚糖精细结构的最高效合理的技术[5-7]。但通过质谱法检测天然酸性N-聚糖时,唾液酸残基容易被解离从而影响其结构鉴定及定量分析[8]。为了克服上述问题,在分析酸性N-聚糖前需要进行一些前期处理,包括还原和中性化。
鲫鱼血清中的唾液酸化N-聚糖含有丰富的氧乙酰化修饰[3],是在寡聚糖水平上分析唾液酸修饰的良好的实验载体。因此,本文以鲫鱼血清作为研究对象,利用超高效液相色谱(ultra performance liq⁃uid chromatography,UPLC)的分离能力以及静电场轨道阱质谱(Orbitrap-MS)的高灵敏性和高分辨能力对双衍生化(苯胺化衍生和甲胺化衍生)的鲫鱼血清唾液酸化N-聚糖进行深入分析,从而鉴定氧乙酰化在N-聚糖结构中的存在情况,拟为丰富鲫鱼糖组学的生物信息和研究糖链修饰以及寻找糖蛋白生物标志物方面提供参考。
1 实验部分
1.1 仪器与设备
超高效液相色谱仪:Thermo Scientific,美国;四级杆和轨道阱联用高分辨质谱仪:Q Exactive Mass Spectrometer,Thermo Scientific,美国;PGC(Porous graphitized carbon)预柱:Thermo Scientific,美国;PGC色谱柱:3 μm,150 × 2.1 mm,Thermo Scientific,美国;移液器、冷冻离心机和真空离心浓缩离心仪:Eppen⁃dorf,德国;漩涡混匀仪:IKA,德国;超纯水制备仪:Millipore,美国;调温调压电炉和循环水真空泵:长城设备,北京;电热恒温水浴锅:新苗医疗器械,上海;固相萃取仪:Sigma,美国。
1.2 试剂与材料
肝素钠注射液:常生千红制药,苏州;肽N-糖苷酶F(PNGase F)和糖苷内切酶缓冲液试剂盒:New England Biolabs,美国;乙腈:Fisher,美国;三氟乙酸、氮甲基吗啉、甲胺盐酸盐、氰基硼氢化钠(NaBH3CN)、苯胺、甲酸、正丁醇、乙醇:Aladdin,上海;二甲基亚砜(DMSO)、六氟磷酸(7-氮杂苯并三唑-1-氧基)三吡咯烷磷(PyAOP)、微晶纤维素(MCC)、冰乙酸:Sigma,美国;流动相A:100%超纯水、0.1%甲酸;流动相B:90%乙腈、10%超纯水、0.1%甲酸;PGC固相萃取柱:柱容量1 mL,Sigma,美国;1.5 mL尖底离心试管和移液枪头:Axygen,美国;固相萃取柱空柱管和筛板:Agela,上海。
1.3 样品准备
鲫鱼血清样品采集自3种来源(渔场、菜市场、超市),鲫鱼平均体长约0.20 m。相关实验均提交江汉大学医学学术伦理委员会批准通过。
鲫鱼血清的采集:每条鱼抽血3.0 mL装入含有50 μL肝素钠的离心管中,混匀后于冷冻离心机中离心(4 000 r∕min,15 min,4℃)取上层血清于-80℃冻存待测。
N-聚糖的释放:10 μL血清用80 μL超纯水稀释,加入10 μL 10 × G7 buffer和1.0 μL 10 × SDS(蛋白质变性试剂),混匀后于沸水中加热10 min。冷却后加入5.0 μL NP-40,漩涡混匀静置5 min,再加入1.0 μL PNGase F酶,混匀后于37℃水浴中过夜。酶切反应结束后于沸水中加热5 min使酶失活,冷却至室温。
N-聚糖的纯化:采用固相萃取法(Solid phase extraction,SPE)对N-聚糖进行富集纯化[9]。酶切后的样品溶于0.9 mL PGC洗涤液(95%超纯水、5%乙腈、0.1%三氟乙酸),使用PGC固相萃取柱纯化。上样前,先用乙腈1.0 mL洗涤柱子3次,再用PGC润洗液(20%超纯水、80%乙腈、0.1%三氟乙酸)1.0 mL润洗3次,最后用3.0 mL PGC洗涤液平衡柱子。上样时,将样品溶液加入柱中使其自然下落。上样完成后,用PGC洗涤液1.0 mL冲洗3次。最后用PGC洗脱液(60%超纯水、40%乙腈、0.1%三氟乙酸)0.50 mL洗脱样品2次,回收洗脱液用真空离心浓缩仪干燥。
N-聚糖的苯胺化衍生:酶切纯化干燥的样品中加入25 μL苯胺试剂,现配25 μL还原试剂(NaBH3CN溶于混合液无水DMSO∶冰乙酸=7∶3,1 mol∕L),漩涡混匀,在恒温水浴65℃条件下反应3 h。完成反应后加入950 μL MCC洗涤液(正丁醇∶乙醇∶超纯水=4∶1∶1),混匀终止反应。
苯胺化N-聚糖的纯化:上样前,先用超纯水1.0 mL洗涤MCC固相萃取柱3次,再用MCC洗涤液1.0 mL润洗、平衡柱子3次;上样时,将溶解于MCC洗涤液的样品加载到MCC柱中,使其自然滴落;上样完成后,用MCC洗涤液1.0 mL冲洗3次。最后用MCC洗脱液(乙醇∶超纯水=1∶1)0.50 mL洗脱样品2次,回收洗脱液用真空离心浓缩仪干燥。
苯胺化N-聚糖的甲胺化衍生:苯胺化纯化干燥的样品中加入25 μL甲胺化试剂(甲胺盐酸盐7.0 mg和5.5 μL 氮甲基吗啉溶于100 μL无水DMSO,1 mol∕L甲胺盐酸盐,0.5 mol∕L氮甲基吗啉)和25 μL甲胺化辅助试剂(2.6 mg PyAOP溶解于100 μL无水DMSO,50 mmol∕L),漩涡混匀,于黑暗处30 ℃空气浴中反应30 min。完成反应后加入950 μL MCC洗涤液,混匀终止反应。双衍生N-聚糖的纯化参照苯胺化N-聚糖的纯化过程。
1.4 样品测试
UPLC超高效液相色谱仪相关参数设置如下:流速0.2 mL∕min,梯度泵程序为(以LC流动相B为参考):0 min,1%流动相B;20 min,20%流动相B;30 min,20%流动相B;45 min,40%流动相B;50 min,40%流动相B;55 min,95%流动相B;60 min,95%流动相B;65 min,1%流动相B;70 min,1%流动相B。
Orbitrap-MS(Orbitrap-tandem mass spectrometry)质谱仪相关参数设置如下:正离子模式条件设定下采用Full MS∕PRM扫描模式测定,一级质谱全扫描,其质荷比扫描范围150~2 000 m∕z;二级质谱选择特定质荷比母离子以获得其碎片离子信息。
1.5 谱图数据的解析
UPLC-Orbitrap-MS质谱图数据由软件Thermo Xcalibur解析。由GlycoWorkBench 2.1绘制确认N-聚糖结构[10]。由于糖链的分子结构复杂,采用符号表示各种单糖,其对应的缩写及符号如下:六碳糖缩写为H;氮乙酰六碳糖缩写为N;唾液酸缩写为S;半乳糖以表示;甘露糖以表示;氮乙酰葡萄糖胺以表示;唾液酸以表示。
2 结果与讨论
一个唾液酸最多连接了3个氧乙酰基,多唾液酸化N-聚糖理论上存在几种可能性分布[3]。对于单唾液酸化的N-聚糖而言,所有的氧乙酰基存在于同一个唾液酸上;而对于多唾液酸化的N-聚糖而言,氧乙酰基的分布则可能出现多种情况,包括分布不均匀等问题。以二唾液酸化的N-聚糖为例,其可能存在表1所示情况。
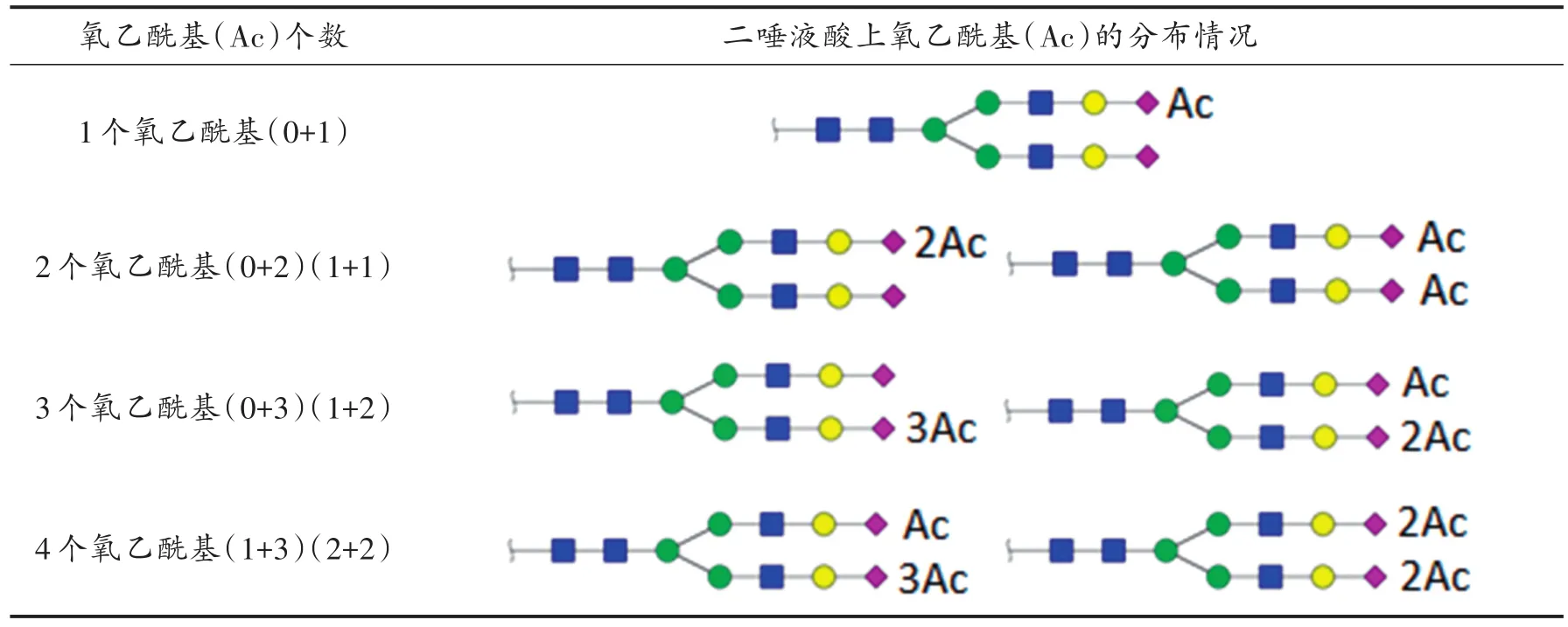
表1 二唾液酸化的N-聚糖唾液酸上氧乙酰基的分布情况Tab.1 Distribution of O-acetylation on N-glycans with bisialylatezation
唾液酸的氧乙酰化修饰指唾液酸上的羟基被氧乙酰基取代。因此,每增加一个氧乙酰基修饰,N-聚糖相对分子质量就增加42 Da。糖型结构为S2H5N4、OAc1-S2H5N4、OAc2-S2H5N4、OAc3-S2H5N4、OAc4-S2H5N4的5种N-聚糖末端连接2个唾液酸残基同时氧乙酰基比较丰富,唾液酸上依次修饰上了0~4个氧乙酰基,主要以这5种N-聚糖为代表利用UPLC-Orbitrap-MS具体深入分析其结构特点。
UPLC-Orbitrap-MS测定鲫鱼血清的双衍生N-聚糖的总离子流图如图1所示。

图1 双衍生N-聚糖总离子流图Fig.1 TIC of dual modifications N-glycans
由于唾液酸残基与半乳糖残基之间的连接方式有α2-3和α2-6连接方式,同时唾液酸残基4号位、7号位、8号位、9号位可以发生氧乙酰化现象[11],而且聚糖还原端还有异构现象等,因此唾液酸化聚糖的同分异构数呈倍数增长。本文聚糖还原端用苯胺衍生从而消除了还原端差向异构体,一定程度上减少聚糖同分异构体数量,增强PGC分离结果的准确性。
Orbitrap的二级质谱电离方式HCD(High collision dissociation,高能碰撞诱导解离)使得不同连接方式的异构体形成的碎片离子种类基本相同。依据双衍生的不同质荷比N-聚糖的提取离子色谱图及对应的二级质谱图(MS2)可知,对于每一个特定质荷比的N-聚糖,尽管在不同保留时间、不同色谱峰对应的MS2谱图的碎片离子相对丰度有稍许变化,但是碎片离子的种类基本相同,尤其典型特征性碎片离子种类完全相同(数据未发表)。
双衍生N-聚糖S2H5N4的提取离子色谱图及对应的MS2谱图见图2。N-聚糖S2H5N4不含氧乙酰基,其提取离子色谱图上有2个色谱峰,甲胺化使唾液酸化N-聚糖有稳定的保留时间和窄的峰宽。N-聚糖 S2H5N4的 MS2谱图,其 1电荷的 B∕Y 碎片离子 m∕z=305.13(S1)、467.19(S1H1)、670.26(S1H1N1)说明唾液酸甲胺化衍生成功,相对分子质量增加13 Da。碎片离子m∕z=1 191.48(H3N3)、1 353.53(H4N3)、1 556.61(H4N4)、1 718.67(H5N4)说明聚糖苯胺化衍生成功,相对分子质量增加77 Da。碎片离子m∕z=1 495.59(S1H3N3)、1 657.67(S1H4N3)、1 860.74(S1H4N4)、2 022.79(S1H5N4)说明聚糖双衍生成功,相对分子质量增加90 Da。

图2 双衍生N-聚糖S2H5N4的提取离子色谱图及对应的MS2谱图Fig.2 XIC and MS2spectra of dual modifications N-glycans S2H5N4
双衍生N-聚糖OAc1-S2H5N4的提取离子色谱图及对应的MS2谱图见图3。N-聚糖OAc1-S2H5N4含有1个氧乙酰基,在一定程度上增加了N-聚糖同分异构体种类,其提取离子色谱图上有5个色谱峰。N-聚糖OAc1-S2H5N4的MS2谱图,其1电荷的B∕Y碎片离子m∕z=305.13(S1)、347.14(OAc1-S1)、467.19(S1H1)、509.20(OAc1-S1H1)、670.26(S1H1N1)、712.28(OAc1-S1H1N1),它们的存在表明其中一个唾液酸上有一个氧乙酰基修饰而另一个唾液酸上没有氧乙酰基修饰,即(0+1)分布,碎片离子相对分子质量分别相差42 Da,其中碎片离子m∕z=467.19(S1H1)、509.20(OAc1-S1H1)说明酸性糖的唾液酸主要与半乳糖相连。碎片离子 m∕z=1 657.67(S1H4N3)、1 699.68(OAc1-S1H4N3)、2 022.79(S1H5N4)说明聚糖双衍生成功,相对分子质量增加90 Da。

图3 双衍生N-聚糖OAc1-S2H5N4的提取离子色谱图及对应的MS2谱图Fig.3 XIC and MS2spectra of dual modifications N-glycans OAc1-S2H5N4
双衍生N-聚糖OAc2-S2H5N4的提取离子色谱图及对应的MS2谱图见图4。N-聚糖OAc2-S2H5N4含有2个氧乙酰基,增加了N-聚糖同分异构体种类,其提取离子色谱图上有8个色谱峰。N-聚糖OAc2-S2H5N4的 MS2谱图,其 1电荷的 B∕Y 碎片离子 m∕z=305.13(S1)、389.15(OAc2-S1)、670.26(S1H1N1)、754.29(OAc2-S1H1N1),它们的存在表明二唾液酸化N-聚糖2个氧乙酰基修饰分布类型是(0+2)分布。碎片离子m∕z=347.14(OAc1-S1)、712.28(OAc1-S1H1N1),它们的存在表明二唾液酸化N-聚糖上2个氧乙酰基修饰分布类型是(1+1)分布。
双衍生N-聚糖OAc3-S2H5N4的提取离子色谱图及对应的MS2谱图见图5。N-聚糖OAc3-S2H5N4含有3个氧乙酰基,增加了N-聚糖同分异构体种类,其提取离子色谱图上有9个色谱峰,可能氧乙酰基数量较多,色谱峰分离度不太理想,UPLC分离分析方法未能实现血清N-聚糖的完全分离。OAc3-S2H5N4 聚糖的 MS2谱图,其 1电荷的 B∕Y 碎片离子 m∕z=305.13(S1)、431.16(OAc3-S1)、670.26(S1H1N1)、796.30(OAc3-S1H1N1),它们的存在表明二唾液酸化N-聚糖3个氧乙酰基修饰分布类型是(0+3)分布。碎片离子 m∕z=347.14(OAc1-S1)、389.15(OAc2-S1)、712.28(OAc1-S1H1N1)、754.29(OAc2-S1H1N1)表明二唾液酸化N-聚糖3个氧乙酰基修饰分布类型是(1+2)分布。

图4 双衍生N-聚糖OAc2-S2H5N4的提取离子色谱图及对应的MS2谱图Fig.4 XIC and MS2spectra of dual modifications N-glycans OAc2-S2H5N4

图5 双衍生N-聚糖OAc3-S2H5N4的提取离子色谱图及对应的MS2谱图Fig.5 XIC and MS2spectra of dual modifications N-glycans OAc3-S2H5N4
双衍生N-聚糖OAc4-S2H5N4的提取离子色谱图及对应的MS2谱图见图6。N-聚糖OAc4-S2H5N4含有4个氧乙酰基,增加了N-聚糖同分异构体种类,其提取离子色谱图上主要有5个色谱峰,色谱峰分离度不太理想。N-聚糖OAc4-S2H5N4的MS2谱图,其 1电荷的B∕Y碎片离子m∕z=347.14(OAc1-S1)、431.16(OAc3-S1)、712.28(OAc1-S1H1N1)、796.30(OAc3-S1H1N1),它们的存在表明二唾液酸化N-聚糖4个氧乙酰基修饰分布类型是(1+3)分布。碎片离子m∕z=389.15(OAc2-S1)、754.29(OAc2-S1H1N1)表明二唾液酸化N-聚糖4个氧乙酰基修饰分布类型是(2+2)分布。上述结果表明,对于多唾液酸化的鲫鱼血清N-聚糖而言,其氧乙酰化修饰存在分布不均匀的情况(图4~图6),这也是首次在淡水鱼中发现这一现象。此类N-聚糖的同分异构体种类太多,样品体系过于复杂,这导致本文未实现对异构体的有效分离。
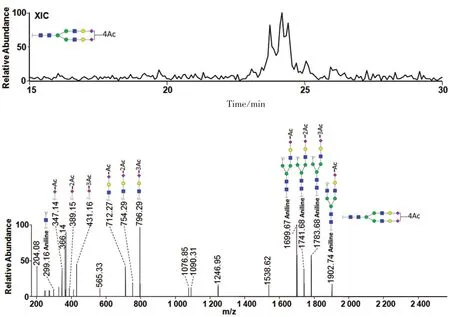
图6 双衍生N-聚糖OAc4-S2H5N4的提取离子色谱图及对应的MS2谱图Fig.6 XIC and MS2spectra of dual modifications N-glycans OAc4-S2H5N4
3 结论
本文基于双向衍生方法和UPLC-MS∕MS分离分析技术对鲫鱼血清N-聚糖的氧乙酰基修饰分布情况进行表征研究。一方面,一个唾液酸分子最多连接3个氧乙酰基;另一方面,对于二唾液酸化N-聚糖而言,氧乙酰化存在不均匀分布现象,例如,含有2个氧乙酰基修饰的N-聚糖存在两种分布类型:(0+2)分布和(1+1)分布;此外,氧乙酰化的位点在唾液酸上,由1电荷的碎片离子m∕z=305.13(S1)、347.14(OAc1-S1)、389.15(OAc2-S1)、431.16(OAc3-S1)可证明。
总之,双衍生方法对鲫鱼血清N-聚糖衍生效果良好,基于LC-MS发现了唾液酸化N-聚糖的同分异构体存在氧乙酰基分布不均匀的现象,也是首次在淡水鱼中发现这一现象。本文工作丰富了鲫鱼糖组学的生物信息,所建立方法在研究糖链修饰以及寻找糖蛋白生物标志物方面有着广泛的应用前景。
