山慈菇对甲状腺癌SW579细胞增殖及凋亡的影响
2018-10-26于治凡刘英华肖均财王明伟
于治凡,刘英华,肖均财,王明伟
1荣成市中医院外科,山东 荣成 264300
2湖北省肿瘤医院病理科,武汉 430079
甲状腺癌是一种常见的发生于头颈部的内分泌系统恶性肿瘤,近年来其发病率呈上升趋势,在女性中发病尤为突出,越来越引起人们的关注[1-2]。甲状腺癌的治疗目前仍以外科手术为主,但术后复发率较高。由于中药材具有安全、不良反应轻和药源丰富等特点,国内外学者们越来越关注从中药材中寻找和研发抗肿瘤药物。
山慈菇是兰科植物杜鸦兰Gremastra appendiculata(D.Don)Makino、独蒜兰Pleione bulbocodioides(Franch.)Rolfe或云南独蒜兰Pleione yunnanensisRolfe的干燥假鳞茎,含有菲类、苷类、芳香类和糖类等多种化合物,具有解毒消肿的功效[3]。临床上山慈菇已作为抗肿瘤的中药,常用于治疗乳腺癌、胃癌和结肠癌等多种恶性肿瘤[4-5]。研究发现,山慈菇对甲状腺癌细胞的增殖具有抑制作用[6],但关于山慈菇调控甲状腺癌细胞增殖及凋亡的机制尚不完全清楚。本研究采用不同浓度的山慈菇处理甲状腺癌SW579细胞,观察其对SW579细胞增殖和凋亡的影响,并分析B细胞淋巴瘤因子-2(B cell lymphoma-2,Bcl-2)的表达情况,探讨其分子机制,现报道如下。
1 材料与方法
1.1 制备山慈菇提取液
将粉碎的山慈菇用去离子水浸泡2 h,采用水煎法制备提取液,用旋转蒸发仪对水提液进行浓缩,得到浓度为1 g/ml的山慈菇提取液。经高压灭菌后,4℃保存备用。用培养基稀释到所需浓度。
1.2 主要试剂和仪器
山慈菇购自武汉生物制品研究所,人甲状腺癌SW579细胞株购自中国科学院细胞库,RPMI-1640培养基和胎牛血清均购自美国Hyclone公司,噻唑蓝(methyl thiazolyl tetrazolium,MTT)试剂盒和膜联蛋白(Annexin V)-异硫氰酸荧光素(FITC)/碘化丙啶(propidium iodide,PI)凋亡试剂盒均购自美国Invitrogen公司,兔抗Bcl-2抗体、β-actin抗体、羊抗兔二抗均购自美国Santa Cruz公司,流式细胞仪购自美国BD公司,酶标仪购自美国Bio-Rad公司。
1.3 实验方法
1.3.1 细胞培养 在RPMI-1640培养基(含100 U/ml青霉素、100 U/ml链霉素和10%胎牛血清)中培养SW579细胞,置于相对湿度为95%、温度为37℃、CO2含量为5%的恒温培养箱中常规培养,每隔2天更换一次培养基。待细胞生长至对数生长期时,采用0.25%胰蛋白酶在37℃水浴中消化5 min,然后用磷酸盐缓冲液(phosphate buffer solution,PBS)清洗,离心收集细胞,用培养基重悬细胞,以细胞密度(1∶3)~(1∶5)的比例进行传代培养。
1.3.2 细胞增殖检测 取上述培养的对数生长期细胞,经0.25%胰蛋白酶消化,重悬细胞液,按每孔1×105个细胞接种于96孔板上,每孔100 μl,经培养箱培养后,加入不同浓度的山慈菇提取液,使山慈菇终浓度为10、20、40、80、160 mg/ml,同时以只加培养液的处理组为对照组。培养48 h后,加入15 μl MTT(5 mg/ml),继续培养4 h后,弃上清,加入100 μl二甲基亚砜(dimethylsulfoxide,DMSO),完全溶解后在酶标仪490 nm处测每组的吸光值A,计算细胞增殖抑制率:细胞增殖抑制率=(1-实验组A/对照组A)×100%。实验重复3次。
1.3.3 细胞凋亡检测 收集经10 mg/ml和20 mg/ml山慈菇处理48 h的SW579细胞和只加培养液处理48 h的对照组SW579细胞,0.25%胰蛋白酶消化后,离心收集细胞。经PBS洗涤,加入100 μl结合缓冲液重悬,使细胞浓度为1×106/ml。然后分别加入5 μl Annexin V-FITC和2 μl PI,避光处理15 min后,流式细胞仪检测细胞的凋亡情况。实验重复3次。
1.3.4 蛋白质印迹法(Western blot)检测Bcl-2蛋白表达 收集经10 mg/ml和20 mg/ml山慈菇处理48 h的SW579细胞,采用RAPI裂解液提取各组细胞的总蛋白。采用BCA法测定蛋白浓度后,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)电泳,转聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF),采用 1%牛血清白蛋白(bovine serum albumins,BSA)封闭后加入 Bcl-2和β-actin抗体(1∶1000),过夜后加入羊抗兔二抗(1∶2000),孵育1 h后,增强化学发光法(enhanced chemiluminescence,ECL)显色。以β-actin为内参,采用Image J软件计算Bcl-2与β-actin的灰度值之比,即为Bcl-2蛋白的相对表达量。
1.4 统计学方法
采用SPSS 21.0软件对-数据进行统计分析。计量资料以均数±标准差(±s)表示,组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 山慈菇对SW579细胞的增殖抑制作用
MTT检测结果显示,山慈菇浓度为0、10、20、40、80、160 mg/ml时,对SW579细胞的增殖抑制作用呈先上升后下降的趋势。山慈菇浓度为0、10、20 mg/ml时,对SW579细胞的增殖抑制率随着浓度的增加而提高,且在山慈菇浓度为20 mg/ml时的细胞增殖抑制率最高;山慈菇浓度为40、80、160 mg/ml时,对SW579细胞的增殖抑制率随着浓度的增大而减小。经计算,半数抑制浓度(half inhibitory concentration,IC50)为 11.59 mg/ml。(图 1)
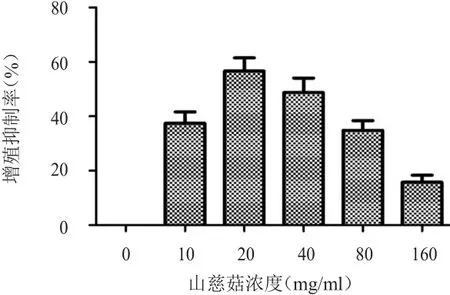
图1 不同浓度山慈菇提取液作用于SW579细胞后的增殖抑制率
2.2 山慈菇对SW579细胞凋亡的影响
经10 mg/ml和20 mg/ml山慈菇处理的SW579细胞的凋亡率分别为(25.56±1.62)%和(58.85±2.26)%,均高于对照组的(8.05±1.05)%,差异均有统计学意义(P<0.05)。(图2)
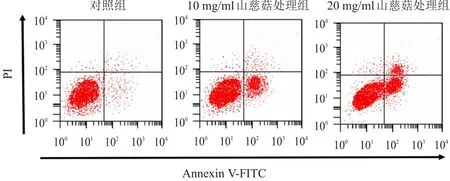
图2 不同组别SW579细胞的凋亡情况
2.3 山慈菇对Bcl-2蛋白表达的影响
Western blot检测结果显示,经10 mg/ml和20 mg/ml山慈菇处理的SW579细胞中Bcl-2蛋白表达水平均低于对照组。(图3)
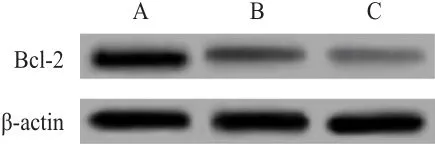
图3 Western blot检测Bcl-2蛋白表达情况
3 讨论
甲状腺癌作为内分泌系统中最常见的恶性肿瘤之一,每年新发病例占所有恶性肿瘤发病的1%~5%[7],已成为发病率增长最快的实体瘤,其发病与性别、年龄、家族史等多种因素有关[8-9]。近年来,有关甲状腺癌发生、发展和转移的研究取得了重大进展[10-12]。目前,甲状腺癌的治疗方法主要有手术、化疗、放疗以及基因治疗,但是这些治疗方法都会导致术后不良反应。由于中药具有不良反应轻、有效的特点,中药抗肿瘤的研究越来越受到学者们的关注[13]。
山慈菇在中国为常用的抗肿瘤中药,可以通过多种分子机制达到抗肿瘤效应。研究发现,山慈菇能够抑制肿瘤细胞增殖、侵袭和转移[14]。研究报道,山慈菇提取物对结肠癌HT29细胞有明显的促凋亡作用,其机制可能与上调Cyt-C、caspase 3、Bax蛋白和下调Bcl-2蛋白的表达有关[4]。研究报道,山慈菇抑制甲状腺癌SW579细胞增殖与NIS基因表达上调有关[15]。Bcl-2是Bcl-2家族中一种重要的抑制细胞凋亡的因子,它是位于线粒体、内质网以及核膜上的一种内膜蛋白,能够通过抑制钙离子释放从而阻止核酸内切酶的活化,发挥抗凋亡作用[16]。
本研究采用不同浓度(10、20、40、80和160 mg/ml)的山慈菇作用于甲状腺癌SW579细胞48 h,结果发现山慈菇浓度为0、10、20 mg/ml时,随着浓度的增加,山慈菇对SW579细胞的增殖抑制作用增强,具有明显的浓度依赖性。经计算,IC50为11.59 mg/ml。本研究采用10 mg/ml和20 mg/ml的山慈菇进行细胞凋亡实验,结果发现,经10 mg/ml和20 mg/ml山慈菇处理48 h后的SW579细胞的凋亡率分别为(25.56±1.62)%和(58.85±2.26)%,均高于对照组的(8.05±1.05)%,差异均有统计学意义(P<0.05)。Western blot检测结果显示,经10 mg/ml和20 mg/ml山慈菇处理48 h的SW579细胞中Bcl-2蛋白表达水平均低于对照组。表明山慈菇提取液的加入下调了Bcl-2蛋白的表达水平。
Bcl-2抗凋亡信号通路通过激活Bcl-2的表达,减少氧自由基的产生和脂质氧化物的形成,抑制线粒体释放促凋亡的蛋白质细胞色素C和凋亡诱导因子,抑制促凋亡的Bax/Bak细胞毒作用。Bcl-2能够结合Apaf-1和caspase 9,并维持其非活化状态,阻止caspase级联反应,从而抑制细胞凋亡。山慈菇提取液对甲状腺癌细胞的促凋亡机制还有待进一步研究。
综上所述,低浓度的山慈菇提取液对甲状腺癌细胞具有增殖抑制作用和促进细胞凋亡的作用,且其促凋亡机制可能与下调Bcl-2蛋白的表达有关。
