纳米正硅酸锂的合成、表征及CO2吸附性能研究
2018-10-25王平平杨丽霞刘成伟
王平平,刘 丹,杨丽霞,张 鹏,刘成伟
(1.天津工业大学环境与化学工程学院,天津300387;2.天津工业大学材料科学与工程学院,天津300387)
随着世界能源需求的日益增加,化石燃料大量燃烧产生过量的CO2使全球变暖问题日益凸显,温室效应加剧[1],为此CO2的捕获技术引起世界各国的广泛关注[2-3]。目前,碳捕获技术主要有膜分离法、湿法和干法捕获[4-6]。膜分离法虽耗能低但对气体选择性不高,造价较高,限制了其实际应用;湿法捕获主要采用胺类溶剂混合物,易于工业化,反应速率快,但存在能耗大、设备易腐蚀和工业烟气需预冷等缺点;干法捕获主要采用固体吸附剂,若结合变温吸附和成熟的流化床工艺,则该工艺具有吸附剂成本低,对环境污染小、能耗低、工业可行性强等优点。综上可知,高效低成本的变温吸附流化床的干法碳捕获技术尤为重要[7-8],而该技术的重点和难点在于开发合适有效的吸附剂。
由于钢铁、水泥等行业存在大量高温废气,直接采用高温吸附剂可解决烟气预冷所需的巨大能耗,提高碳捕获的效益[9-12]。正硅酸锂是适用于高温过程烟气的一种高效吸附剂,吸附容量较大,且它比锆酸锂具有更快的吸附速度,因此得到研究人员的广泛关注[13-16]。目前研究表明,正硅酸锂对CO2的吸附符合双指数模型[17-20],即外层正硅酸锂吸附CO2后生成坚固的外壳,阻止了内部颗粒吸收CO2;而内部的正硅酸锂只能向颗粒表面迁移才能继续反应,该过程慢,是吸附控制步骤。变温吸附流化床工艺是工业上较为成熟的且能耗较低的工艺,吸附剂与高温烟气接触时间很短,这就要求它能够快速吸收CO2,且较低的脱附温度也将有利于降低过程能耗。为此,所合成的Li4SiO4颗粒分布越均匀、尺寸越小、比表面积越大,CO2吸收和解吸速率就越快。
目前,正硅酸锂的合成方法主要有固相法、浸渍法,同时溶胶-凝胶法和沉淀法也有少量报道。固相法主要是将锂源、硅源等固体原料如Li2CO3或LiOH、SiO2等均匀混合,在800℃下煅烧得到。该方法制备简单,但物料混合不均匀,吸附剂颗粒尺寸大,耗能大,且CO2吸附过程是扩散控制过程[21-25]。浸渍法是以LiNO3等可溶性锂盐为锂源,硅藻土等二氧化硅为硅源,通过等体积浸渍法得到。该合成方法中物料混合较固相法均匀,该方法颗粒度一般在1~5μm,要加快吸附剂的吸附速度必须进一步降低其颗粒度[26-28]。溶胶-凝胶法是以LiNO3或乙酸锂为锂源,以正硅酸乙酯为硅源,同时加入柠檬酸等添加剂,水热条件下合成,并在850℃下煅烧得到。该方法合成的吸附剂颗粒均一且较小,但不足的是其所需时间较长,原料价格昂贵,不易于工业放大生产[29-32]。沉淀法则是在可溶性的锂盐和硅源的混合溶液中加入一种沉淀剂,使其均匀沉淀的方法。该方法工艺简单,但目前对于该方法的报道并不多[33-34],并且他们所制备的吸附剂颗粒度相对较大(3~25μm),具有较高的焙烧温度(800~900℃)和脱附温度(800~850℃),因此要得到高性能的吸附剂必须做进一步改进。
本课题组在开发固体CO2吸附剂方面做了许多工作[35-38]。由于正硅酸锂是一种比表面积很小的陶瓷材料,有效降低吸附剂的颗粒度将是提高吸附速率和降低脱附温度的关键。在前期研究的基础上,以较为廉价的LiOH为锂源,硅溶胶为硅源,NH4HCO3为沉淀剂,Li2CO3和SiO2均匀实现共沉淀,制得纳米正硅酸锂吸附剂。该合成方法成本低,简单可行,适合大规模的生产。采用XRD、SEM、N2吸附脱附方法进行了表征并对其动态吸附脱附性能研究进行了评价,发现均匀细小的颗粒度有利于降低焙烧温度和CO2脱附温度,进而降低其吸附脱附过程能耗。最后对不同温度下的静态吸附曲线进行拟合,证实了双壳反应机理,且均匀的纳米颗粒使Li从体相到表面的扩散速度加强,提高了其吸附速率。
1 实验部分
1.1 实验试剂
LiOH·H2O(AR)、NH4HCO3(AR)、硅溶胶(质量分数25%~26%),以上试剂均来自国药集团化学试剂有限公司;CO2与N2混合气(体积比为1∶7)。
1.2 吸附剂的制备
吸附剂是用共沉淀方法制备的,将LiOH·H2O溶于去离子水中,加入适量添加剂,按n(Li)/n(Si)=8.2∶1的原料配比称取一定量的硅溶胶,室温下将硅溶胶和NH4HCO3溶液同时滴入LiOH溶液中,滴定完毕搅拌1 h,然后蒸干,100℃下恒温干燥12 h,将得到的粉体研磨均匀后,放入管式炉,在一定的温度下焙烧6 h,即可得到吸附剂。
1.3 吸附剂的物性表征
XRD:采用德国布鲁克D8·Advance A 52型衍射仪对样品物相组成进行分析,采用Cu辐射源,管电流30 mA,管电压 40 k V,扫描角度 10°~80°,扫描速率为 5(°)/min。
SEM:利用荷兰Pheonm world G2pro扫描电子显微镜观察样品的形貌尺寸。
氮气吸附-脱附实验:在美国Micromeritics公司的ASAP 2420上进行,测试前所有样品均在90℃脱气30 min,然后在300℃下脱气3 h,直至达到稳定的真空度1.3332×10-4Pa。
1.4 吸附剂的吸附性能测试
吸附剂的性能测试在日本岛津DTG-60热重分析仪上进行。为了满足流化床接触时间短的特点,循环吸附稳定性考察采用变温动态吸附脱附循环实验,同时采用等温静态吸附考察某温度下CO2的静态吸附速率。首先取一定量的样品,在常压下通入 CO2和 N2的混合气(V(CO2)/V(N2)=1∶7),总流量约为50 mL/min。将样品由室温以5℃/min的速率升温至800℃,再以同样的速率降温至400℃,然后再升温至800℃,如此反复循环,使吸附剂在400~800℃进行低温吸附-高温脱附循环实验。此外,在CO2和N2混合气中将吸附剂分别在555、565、575、585℃四个不同的温度下进行动力学吸附实验,吸附时间约2 h。
2 结果与讨论
2.1 吸附剂表征
2.1.1 XRD表征 为了考察吸附剂在循环吸附-脱附过程的相变行为,各不同阶段的吸附剂样品的XRD如图1所示。

图1 不同阶段吸附剂样品的XRD谱图Fig.1 XRD patterns of the samples after different tr eatments
由图1可知,干燥后样品的物相以偏硅酸锂(Li2SiO3,PDF:15-0519)和碳酸锂(Li2CO3,PDF:22-1141)为主,说明在干燥的过程中LiOH与SiO2反应生成了Li2SiO3;而吸附剂在650℃焙烧6 h后的XRD图中出现正硅酸锂(Li4SiO4,PDF:20-0637)和偏硅酸锂的特征衍射峰,以及少量碳酸锂相,这是由于吸附剂中的部分Li2SiO3和Li2CO3转化成了Li4SiO4,并释放出了CO2。600 ℃在V(CO2)/V(N2)=7∶1的气流中静态吸附CO22 h后,吸附剂中正硅酸锂的相消失,碳酸锂相的衍射峰明显加强,这是由于焙烧后Li4SiO4相快速吸附CO2,生成了Li2CO3和Li2SiO3相。实验中CO2脱附后碳酸锂相消失,同时出现正硅酸锂的特征衍射峰,其原因在于吸附剂中的部分Li2SiO3和Li2CO3的分解。这一结果表明,Li4SiO4相的存在是变温吸附脱附过程中吸附剂可以循环使用的主要原因。
图2为沉淀法制备的Li4SiO4在不同焙烧温度下的XRD谱图。由图2可知,600℃焙烧样品的物相仍以偏硅酸锂和碳酸锂为主,结合图1可知,此时的物相组成与之前干燥后的样品相同,说明焙烧温度过低,未生成Li4SiO4相;650~800℃四个不同焙烧温度的样品均开始出现正硅酸锂的特征衍射峰,说明吸附剂在此焙烧温度下部分Li2SiO3和Li2CO3开始反应生成了Li4SiO4,并释放出CO2。此外,从图2中可以看出,焙烧温度越高,Li4SiO4衍射峰强度越大,这是由于温度过高可能使Li4SiO4粒径变大,结晶度提高,这一结果在后面的SEM表征中可得到进一步证实。因此,采用本沉淀法所制备的纳米吸附剂在较低的焙烧温度(650℃)就可以生成Li4SiO4,比其他文献报道的焙烧温度(750~800 ℃)[17,25,29-30]有显著降低。

图2 不同焙烧温度下Li4SiO4样品的XRDFig.2 XRD patterns of Li4SiO4 samples at different calcination temperatures
2.1.2 SEM表征 图3为沉淀法制备的Li4SiO4不同焙烧温度下的SEM照片。由图3可知,650℃焙烧后的样品颗粒较小,基本没有团聚,颗粒分布均匀,为纳米颗粒。700、750、800℃焙烧所得到的样品均呈现出一定程度的团聚现象,颗粒尺寸明显增大,说明升高温度导致Li4SiO4烧结,粒径变大。
2.1.3 N2吸附-脱附等温线 图4为沉淀法制备的Li4SiO4不同焙烧温度下的N2吸附脱附等温线。由图4可知,所有样品的吸附脱附等温线在相对压力为0.600~0.995出现滞后环,说明该系列样品均具有介孔-大孔结构,这主要是由于纳米颗粒的堆积而产生的孔。650、700、750、800℃焙烧后的样品比表面积分别为 5.609、4.325、3.933、3.417 m2/g,可见随着焙烧温度的升高,样品的比表面积逐渐减小,这是由于焙烧温度越高,样品越容易呈现团聚烧结现象,进而导致颗粒尺寸增大。
2.2 CO2动态吸附性能考察
吸附剂的变温循环吸附-脱附实验从室温升至800℃完成一次循环,然后在800~400℃内再循环一次,升降温速率均为5℃/min。对不同焙烧温度的4个吸附剂样品分别进行了CO2吸附-脱附循环实验,结果见图5。由图5可知,在室温升至800℃过程中,吸附剂在505℃时,开始吸收CO2,到640℃时完成整个吸收过程。脱附过程从640℃到670℃结束,在5 min内完成,其脱附过程速率较快。在800~400℃的循环吸附中出现了两段吸附,分别在降温至625~590℃和升温至550~610℃时,且第一段CO2吸收为主要过程,吸附速率很快,650℃焙烧的样品吸附容量5 min内可达到17.8%;第二段吸附过程,吸附量增加较少,说明一段吸附过程快且已经接近饱和。从不同焙烧温度的4个吸附剂样品CO2吸附-脱附循环实验可以看出,650℃焙烧后的样品具有最快的吸附速率和最高的吸附容量。其原因为根据该材料的核壳吸收模型,CO2吸收是由表面开始,形成一层Li2CO3和Li2SiO3外壳,进而阻止了内部颗粒吸收CO2,而内部Li要迁移到颗粒表面才能进一步反应[39]。因此,样品颗粒尺寸小、分布均匀,外表面积大有助于得到更快的CO2吸收和解吸速率,此特点与2.1的SEM表征和N2吸附脱附的结果一致。为了研究此吸附剂中的扩散现象,对其静态吸附曲线进行了动力学分析。

图3 不同焙烧温度Li4SiO4样品的SEM谱图Fig.3 SEM images of Li4SiO4 samples at different calcination temperatures

图4 不同焙烧温度的吸附剂样品的N2吸附-脱附等温线Fig.4 N2 absorption-desorption isotherms of the sorbents samples at different calcination temperatures
2.3 静态吸附的动力学分析
图6 为650℃焙烧后的样品在4个不同温度(555、565、575、585℃)下的静态吸附曲线。采用如式(1)所示的双指数模型进行了数据拟合[31,34,39],即
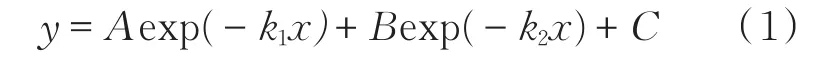
其中,y代表CO2吸附量,x代表吸附时间,A、B、C代表指数前因子,k1和k2分别代表CO2和Li离子的散速度常数。

图5 不同焙烧温度合成吸附剂变温动态脱附-吸附循环Fig.5 Temperature-swing dynamic CO2 desorptionabsorption cyclic tests of sorbent samples at different calcination temperatures
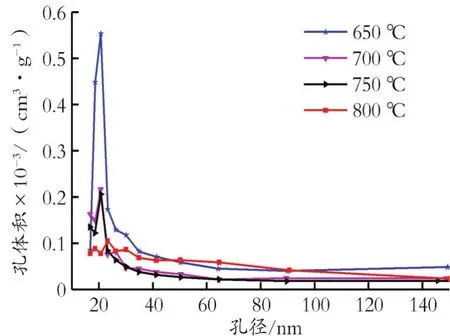
图6 吸附剂在不同吸附温度下的静态CO2动力学吸附Fig.6 Static CO2 kinetic absorption tests of Li4SiO4 sample at different absorption temper atur es
表1为4个不同温度的动力学吸附曲线拟合所得的动力学参数。

表1 Li4SiO4等温线所得的动力学参数Table1 Kinetic parameters obtained from the absorption isotherms of Li4SiO4
从表1可知,k1和k2随温度升高逐渐增大,且CO2吸收速率k1要远远高于Li的扩散速率k2,表明锂扩散是整个反应的速率控制步骤。同时发现,该吸附剂在650℃焙烧后Li的扩散速率k2为(1.93~3.29)×10-4,明显大于之前文献报道[19,22,30],表明本方法制备的Li4SiO4吸附剂具有很好的吸附性能。
3 结 论
采用沉淀法,以廉价的原材料合成了高温CO2吸附剂正硅酸锂(Li4SiO4);研究了不同焙烧温度对CO2性能的影响,发现此纳米吸附剂的最佳焙烧温度较低(650℃),此焙烧条件下没有出现明显的团聚现象,吸附脱附速度加快,在模拟烟气(体积分数12.5%CO2)条件下,5 min内变温动态吸附容量可达17.8%,且脱附温度可降低至(670℃)。对其不同温度下的吸附曲线利用双指数模型进行拟合,说明其吸附过程符合核壳反应机理,在低体积分数CO2(12.5%)模拟工业烟气下,锂从体相迁移到表面的速率依然较高,这主要是由于吸附剂颗粒较小,降低了Li的迁移阻力,从而提高了其吸附速度。
