低硒大鼠心肌组织中微小RNA的差异表达研究
2018-10-25高登峰冯雁京邢玉洁牛小麟
高登峰,冯雁京,邢玉洁,牛小麟
克山病是一种原因未明的地方性心肌病,曾多次暴发流行,病死率较高[1]。硒是一种与人类健康息息相关的微量元素,与多种心血管疾病的发生、发展有关[2]。目前研究认为体内硒缺乏是克山病的重要发病原因之一,体内硒水平较低会引起左心室收缩功能下降,最终导致心力衰竭,但低硒与心功能不全的关系及具体机制尚不清楚[3-5]。近年研究发现,微小RNA(miRNA)在心脏发育及心脏病发生发展过程中发挥着重要作用,其已成为心血管疾病研究领域的热点[6-7]。但低硒所致克山病是否存在miRNA异常表达尚不清楚。本研究拟给予低硒饲料制备低硒大鼠模型,并分析心肌组织中miRNA的差异表达,为克山病的发病机制研究及防治提供参考。
1 材料与方法
1.1 实验动物 30只清洁级SD大鼠购自西安交通大学动物中心,3周龄,平均体质量(75±10)g;按照随机数字表法将大鼠分为对照组、低硒组、补硒组,每组10只。
1.2 方法 对照组大鼠给予AIN-93标准饲料(西安交通大学动物中心提供)喂养,低硒组及补硒组大鼠均给予AIN-93 M(低硒)饲料(西安交通大学动物中心提供)喂养;3组大鼠均喂养14周。之后补硒组大鼠给予亚硒酸钠溶液(南京通盈生物科技有限公司生产)0.05 mg·kg-1·d-1灌胃,对照组和低硒组大鼠则给予相同剂量蒸馏水灌胃;3组大鼠均连续灌胃3周。入组17周后腹腔内注射10%水合氯醛0.03 ml/100 g,麻醉满意后处死3组大鼠,腹主动脉留取全血,采用2,3-二氨基萘荧光法检测血清硒水平;采用Triage 脑钠肽(BNP)快速检测试验检测血浆BNP水平。
1.3 HE染色 留取3组大鼠部分心肌组织标本,采用4%多聚甲醛固定24 h,石蜡包埋切片,厚度10 μm/片,之后按照HE标准流程进行染色,光镜下观察心肌组织形态学结构。
1.4 基因芯片测序 留取3组大鼠剩余心脏组织并迅速投入液氮20~30 s,置于-80 ℃环境下冻存,采用TRIzol试剂(Invitrogen公司生产)和Qiagen miRNeasy Mini Kit提取总RNA,使用NanoDrop 1000超微量分光光度计检测RNA质量及数量,并通过凝胶电泳确定RNA完整性。采用miRCURY™Hy3™/Hy5™标记试剂盒(Exiqon,Vedbaek,Denmark)对miRNA进行标记,根据阵列说明书在miRCURYTMLNA阵列(v.16.0)上对Hy3TM标记的样品进行杂交。采用洗涤缓冲液试剂盒(Exiqon)洗涤,400 r/min离心5 min,最后干燥。采用AXON GenePix 4000B生物芯片扫描仪扫描切片,采用Significant Analysis of Microarrays(SAM)v4.0软件挑选差异表达基因,差异表达基因筛选标准:错误发现率(FDR)≤5%,Fold change>2倍。miRNA表达的聚类分析采用每张芯片平均值归一化后的数据,采用Cluster 3.0软件进行聚类分析。
1.5 靶基因功能的显著性分析 采用miRNA生物信息学分析软件Targetscan和miRanda对芯片检测的差异表达miRNA进行靶基因预测,选择两种软件交集的靶基因。基于基因本体(gene ontology,GO)数据库,应用DAVID软件根据靶基因的功能富集程度进行GO显著性分析;基于KEEG数据库,应用DAVID软件根据靶基因在信号通路中的富集程度进行Pathway显著性分析。
1.6 实时荧光定量聚合酶链反应(PCR) 选取差异表达显著的miRNA作为验证基因,设计miRNA特异性反反录引物和PCR引物。取500 ng总RNA,利用miRNA特异性反转录引物和oligo-dT16在反转录酶作用下反转录合成cDNA。以U6为内参,在冰上按照实时荧光定量PCR试剂盒SYBR Premix Ex TaqTMⅡ说明书进行反应体系配制。反应体系为20 μl:试剂盒中SYBR Premix Ex Taq 10 μl,cDNA 模板,引物 0.4 μmol/L,并使用RNase Free H2O溶解至20 μl。95 ℃预变性3 min,变性 95 ℃ 10 s、退火 67 ℃ 30 s、延伸 72 ℃ 30 s,共40个循环。采用2-ΔΔCT法计算miRNA相对表达量。
1.7 统计学方法 采用SPSS 17.0统计学软件进行数据处理,计量资料以(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用q检验,两组间比较采用两独立样本t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 血清硒和血浆BNP水平 3组大鼠血清硒和血浆BNP水平比较,差异有统计学意义(P<0.05);低硒组和补硒组大鼠血清硒水平低于对照组,血浆BNP水平高于对照组,差异有统计学意义(P<0.05);低硒组大鼠血清硒水平低于补硒组,血浆BNP水平高于补硒组,差异有统计学意义(P<0.05,见表1)。
2.2 HE染色结果 对照组大鼠心肌组织结构清晰,闰盘连接结构良好,肌丝排列、肌走形均正常(见图1A)。低硒组大鼠肌纤维肿胀、排列紊乱(见图1B),心肌细胞坏死、细胞核固缩(见图1C),部分肌纤维断续(见图1D),部分地方可见小的心肌坏死灶,且坏死灶周围伴有炎性浸润(见图1E)。补硒组大鼠心肌纤维较对照组轻度肿胀,但肌纤维排列基本整齐有序(见图1F)。
2.3 miRNA表达差异及聚类分析 基因芯片测序结果显示,3组大鼠共119个miRNA差异表达,共8种变化趋势,其中低硒组较对照组上调、补硒组与对照组间无差异的miRNA共30个(见图2趋势1);低硒组较对照组下调、补硒组与对照组间无差异的miRNA共10个(见图2趋势6),上述40个miRNA为硒敏感性miRNA。
2.4 靶基因功能的显著性分析 GO功能富集分析结果显示,上述40种差异表达miRNA靶基因功能主要富集于脂代谢、心脏发育、细胞黏附、血管发育、轴突导向、细胞迁移调控、输尿管芽发育、跨膜受体蛋白酪氨酸激酶信号通路、细胞分化、有机氮化物反应、棕色脂肪分化、髓系祖细胞分化、细胞-基质黏附、细胞增殖调控、生物钟节律,见图3。靶基因投射的13条信号转导通路为肾细胞癌、转录调节、多巴胺能突触、焦点黏附、Rap信号通路、脂代谢、PPAR信号通路、Ras信号通路、Oxytocin信号通路、长期抑制、PI3K-Akt信号通路、MAPK信号通路、HTLV-1感染,见图4。
表1 3组大鼠血清硒和血浆BNP水平比较(±s)Table 1 Comparison of serum selenium level and plasma BNP level in the three groups

表1 3组大鼠血清硒和血浆BNP水平比较(±s)Table 1 Comparison of serum selenium level and plasma BNP level in the three groups
注:BNP=脑钠肽;与对照组比较,aP<0.05;与低硒组比较,bP<0.05
组别 只数 硒(mg/L) BNP(pg/ml)对照组 10 0.144±0.007 894.3±11.3低硒组 10 0.026±0.004a 1 436.4±121.7a补硒组 10 0.092±0.012ab 1 174.2±132.8ab F值 4.32 3.96 P值 0.02 0.03
2.5 实时荧光定量PCR结果 上述40个miRNA中表达上调最显著的5个miRNA分别为miRNA-374、miRNA-16、miRNA-199a-5p、miRNA-195、miRNA-30e*,表达下调最显著的3个miRNA分别为miRNA-3571、miRNA-675、miRNA-450a*。实时荧光定量PCR结果显示,以对照组心肌组织miRNA为参照,补硒组大鼠心肌组织miRNA-374、miRNA-16、miRNA-199a-5p、miRNA-195、miRNA-30e*相对表达量低于低硒组,心肌组织miRNA-3571、miRNA-675、miRNA-450a*相对表达量高于低硒组,差异有统计学意义(P<0.05,见表2)。
3 讨论
克山病的病因迄今尚未完全明确,主要包括微生物地球化学病因和生物病因。目前,流行病学研究证实,地方性克山病几乎全部发生在低硒地带,该地区患者头发和血液中的硒明显低于非病区居民,故认为克山病的发生与当地饮食中硒元素缺乏有关,而口服亚硒酸钠后患者病情得到明显缓解,提示补硒能预防克山病的发生[3,8]。本研究采用低硒饲料喂养大鼠以构建低硒模型,结果显示,低硒组大鼠血清硒水平低于对照组和补硒组,提示低硒大鼠模型构建成功。
近期一项前瞻性队列研究结果显示,血清硒基线水平与急性冠脉综合征患者病死率呈负相关,且低硒是其独立危险因素[9]。动物实验结果显示,低硒与心功能恶化及心肌肥厚有关,其水平可伴心脏组织中谷胱甘肽过氧化物酶(GPx)活性降低而下降[10]。本研究结果显示,低硒组大鼠血浆BNP水平高于对照组和补硒组,补硒组大鼠血浆BNP水平高于对照组,提示低硒大鼠存在心功能损伤。
表2 低硒组和补硒组大鼠心肌组织表达最显著的8种miRNA相对表达量比较(±s)Table 2 Comparison of relative expression quantity of 8 miRNA with the most significant differential expression in myocardium tissue between low-selenium group and selenium supplement group
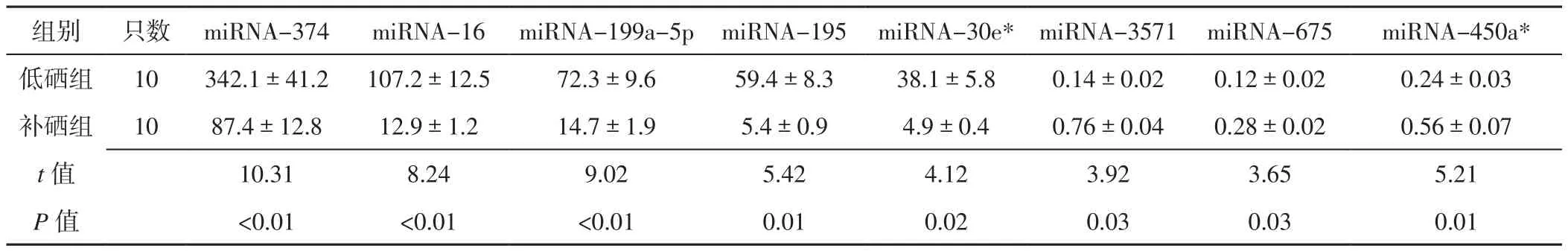
表2 低硒组和补硒组大鼠心肌组织表达最显著的8种miRNA相对表达量比较(±s)Table 2 Comparison of relative expression quantity of 8 miRNA with the most significant differential expression in myocardium tissue between low-selenium group and selenium supplement group
组别 只数 miRNA-374 miRNA-16 miRNA-199a-5p miRNA-195 miRNA-30e*miRNA-3571 miRNA-675 miRNA-450a*低硒组 10 342.1±41.2 107.2±12.5 72.3±9.6 59.4±8.3 38.1±5.8 0.14±0.02 0.12±0.02 0.24±0.03补硒组 10 87.4±12.8 12.9±1.2 14.7±1.9 5.4±0.9 4.9±0.4 0.76±0.04 0.28±0.02 0.56±0.07 t值 10.31 8.24 9.02 5.42 4.12 3.92 3.65 5.21 P值 <0.01 <0.01 <0.01 0.01 0.02 0.03 0.03 0.01

图1 HE染色结果Figure 1 HE staining results
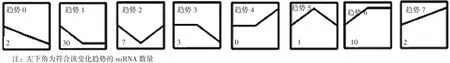
图2 3组大鼠miRNA变化趋势图Figure 2 miRNA change trends in the three groups
近年来,miRNA在心血管疾病领域的研究报道日益增多,其在高血压、先天性心脏病、冠心病的发生发展中发挥着重要作用[8,11]。本研究通过基因芯片测序筛选出40个硒敏感性miRNA,包括30个表达上调的miRNA和10个表达下调的miRNA;进一步行GO功能富集分析结果显示,上述40种差异表达miRNA靶基因功能主要富集于脂代谢、心脏发育、细胞黏附、血管发育、轴突导向、细胞迁移调控、输尿管芽发育、跨膜受体蛋白酪氨酸激酶信号通路、细胞分化、有机氮化物反应、棕色脂肪分化、髓系祖细胞分化、细胞-基质黏附、细胞增殖调控、生物钟节律,且靶基因主要投射13条信号转导通路。为了验证基因芯片测序结果,本研究选取8个表达显著的miRNA,结果提示基因芯片测序结果与实时荧光定量PCR结果相一致。既往研究表明,miRNA在低硒所致克山病的发生发展中发挥着重要作用,其可能的作用机制为miRNA通过影响某种信号转导通路而导致心脏结构或功能异常,最终发展为心力衰竭[12]。

图3 差异表达miRNA靶基因GO功能富集分析结果Figure 3 Gene ontology functional enrichment analysis results of target gene of miRNA with differential expression

图4 靶基因投射的信号转导通路Figure 4 Target gene projected signal transduction pathways
综上所述,低硒会导致大鼠心功能损伤,低硒大鼠心肌组织中存在多个差异表达的miRNA,主要涉及15种生物学功能和13条信号转导通路,这些差异表达的miRNA可能参与克山病的发生发展。但本研究存在以下不足:(1)低硒大鼠模型并不能完全模拟和反映克山病的自然病程;(2)实验大鼠数量较少;(3)芯片基因筛选时采用了样本混合方法,以节约成本,但可能降低研究结论的可靠性。
作者贡献:高登峰、牛小麟进行文章的构思与设计,对文章整体负责,监督管理;高登峰进行研究的实施与可行性分析;冯雁京进行数据收集、整理、分析;邢玉洁进行结果分析与解释;高登峰、冯雁京负责撰写论文。
本文无利益冲突。
