血浆骨桥蛋白、纤维蛋白原水平与急性脑梗死患者神经功能缺损程度及预后相关性的前瞻性研究
2018-10-25赵士娇韩雪高燕军
赵士娇,韩雪,高燕军
脑卒中是全球范围内因病死亡的第二大原因,仅次于恶性肿瘤[1],且约2/3脑卒中存活者存在不同程度残疾,进而增加了医疗负担及社会负担[2]。缺血性脑卒中最常见的TOAST病因分型是大动脉粥样硬化型,而炎性反应在动脉粥样硬化(atherosclerosis,AS)的发生发展过程中发挥着重要作用[3]。骨桥蛋白(OPN)是一种多功能蛋白,其通过与细胞表面整合素相互作用而参与AS发生发展过程;此外,OPN还对炎性反应和钙化形成具有调控作用,进而影响粥样硬化斑块形成[4]。纤维蛋白原(FIB)是由凝血因子Ⅰ在肝细胞内合成,为炎性反应急性期蛋白,其可促进内皮细胞迁移、变性及平滑肌细胞增殖,并可加速AS发生[5]。本研究旨在探讨血浆OPN、FIB水平与急性脑梗死患者神经功能损伤严重程度及预后的相关性,为改善患者预后提供参考,现报道如下。
1 资料与方法
1.1 一般资料 连续选取2017年8月—2018年3月承德医学院附属医院神经内科收治的急性脑梗死患者150例作为脑梗死组,于发病48 h内入院,均符合《中国急性缺血性脑卒中诊治指南2014》[6]中的急性脑梗死诊断标准,并经颅脑CT或磁共振成像(MRI)证实。根据美国国立卫生研究院卒中量表(NIHSS)评分将急性脑梗死组患者分为轻型脑梗死组(n=87)和中重型脑梗死组(n=63),根据治疗后90 d改良Rankin量表(mRS)评分将急性脑梗死组患者分为预后良好组(n=104)和预后不良组(n=46)。排除标准:(1)年龄<18岁;(2)有脑卒中病史者;(3)合并出血性卒中者;(4)合并颅内感染、慢性炎性疾病、冠心病、心力衰竭、骨质疏松、结缔组织疾病及肿瘤者;(5)合并肝、肾功能不全者;(6)近期有手术或创伤、中途转院或失访者。另选取同期体检中心体检健康志愿者100例作为对照组。脑梗死组和对照组受试者性别、年龄、体质指数(BMI)、高血压病史、糖尿病病史、吸烟史、饮酒史比较,差异无统计学意义(P>0.05,见表1),具有可比性。本研究经承德医学院附属医院伦理委员会审核批准,所有患者或家属知情并签署知情同意书。
1.2 血浆OPN和FIB水平检测方法 对照组受试者于体检当天、脑梗死组患者于入院后第2天抽取空腹静脉血3 ml,均置于乙二胺四乙酸(EDTA)抗凝管中,3 000 r/min离心15 min,留取血浆并置于-80 ℃冰箱中保存待测。采用酶联免疫吸附试验(ELISA)检测血浆OPN水平,试剂盒购自上海酶联生物科技有限公司,并严格按照说明书进行操作;采用日本Sysmex CA 8000全自动血凝仪检测血浆FIB水平。
1.3 神经功能缺损程度评估 采用NIHSS评估脑梗死组患者入院第1天神经功能缺损程度,总分42分,评分越高提示患者神经功能损伤程度越重。NIHSS评分<5分定义为轻型脑梗死,NIHSS评分≥5分定义为中重型脑梗死。
1.4 近期预后评估 患者出院后通过门诊或电话进行随访,采用mRS评估脑梗死组患者发病3个月预后,总分5分,评分越高提示患者预后越差。mRS评分≤2分定义为预后良好,mRS评分>2分定义为预后不良。
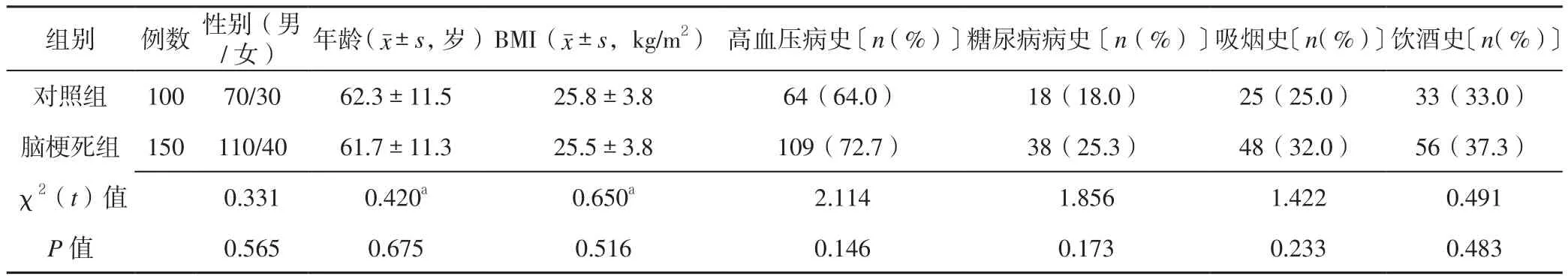
表1 脑梗死组和对照组受试者一般资料比较Table 1 Comparison of general information between control group and case group
1.5 统计学方法 采用SPSS 21.0统计软件进行数据分析,计量资料以(x ±s)表示,组间比较采用两独立样本t检验;计数资料分析采用χ2检验;血浆OPN、FIB水平与急性脑梗死患者NIHSS评分、mRS评分的相关性分析采用Spearman秩相关分析;绘制ROC曲线以评价血浆OPN、FIB水平对急性脑梗死患者神经功能损伤程度和预后的预测价值。以P<0.05为差异有统计学意义。
2 结果
2.1 脑梗死组和对照组受试者血浆OPN、FIB水平比较脑梗死组患者血浆OPN、FIB水平高于对照组,差异有统计学意义(P<0.05,见表2)。
表2 脑梗死组和对照组受试者血浆OPN、FIB水平比较(±s)Table 2 Comparison of plasma levels of OPN and FIB between control group and case group
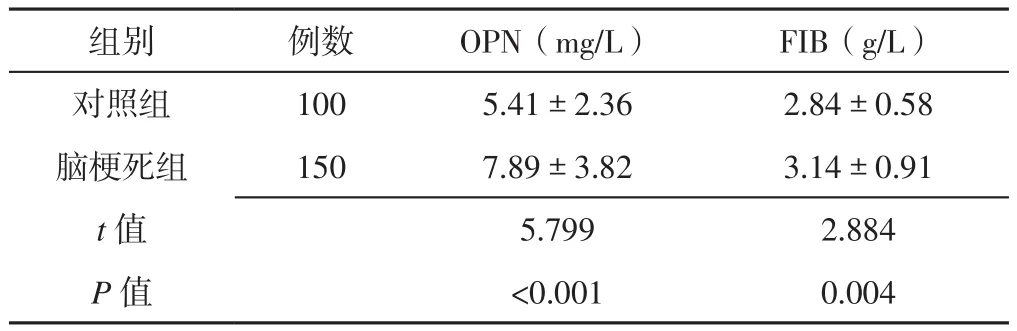
表2 脑梗死组和对照组受试者血浆OPN、FIB水平比较(±s)Table 2 Comparison of plasma levels of OPN and FIB between control group and case group
注:OPN=骨桥蛋白,FIB=纤维蛋白原
组别 例数 OPN(mg/L) FIB(g/L)对照组 100 5.41±2.36 2.84±0.58脑梗死组 150 7.89±3.82 3.14±0.91 t值 5.799 2.884 P值 <0.001 0.004
2.2 轻型脑梗死组和中重型脑梗死组患者血浆OPN、FIB水平比较 中重型脑梗死组患者血浆OPN、FIB水平高于轻型脑梗死组,差异有统计学意义(P<0.05,见表3)。
2.3 预后良好组和预后不良组患者血浆OPN、FIB水平比较 预后不良组患者血浆OPN、FIB水平高于预后良好组,差异有统计学意义(P<0.05,见表4)。
2.4 相关性分析 Spearman秩相关分析结果显示,血浆OPN、FIB水平与急性脑梗死患者NIHSS评分(rs分别为0.480、0.497)、mRS评分(rs分别为0.387、0.352)呈正相关(P<0.05)。
2.5 预测价值 ROC曲线显示,血浆OPN水平预测急性脑梗死患者神经功能缺损程度和预后的曲线下面积(AUC)分别为0.724、0.726,血浆FIB水平预测急性脑梗死患者神经功能缺损程度和预后的AUC分别为0.714、0.711(见表 5、图 1~2)。
表3 轻型脑梗死组和中重型脑梗死组患者血浆OPN、FIB水平比较(±s)Table 3 Comparison of plasma levels of OPN and FIB in patients with different severity of cerebral infarction

表3 轻型脑梗死组和中重型脑梗死组患者血浆OPN、FIB水平比较(±s)Table 3 Comparison of plasma levels of OPN and FIB in patients with different severity of cerebral infarction
组别 例数 OPN(mg/L) FIB(g/L)轻型脑梗死组 87 6.61±3.11 2.88±0.69中重型脑梗死组 63 9.65±4.03 3.49±1.05 t值 5.214 4.274 P 值 <0.001 <0.001
表4 预后良好组和预后不良组患者血浆OPN、FIB水平比较(±s)Table 4 Comparison of plasma levels of OPN and FIB in patients with different prognosis
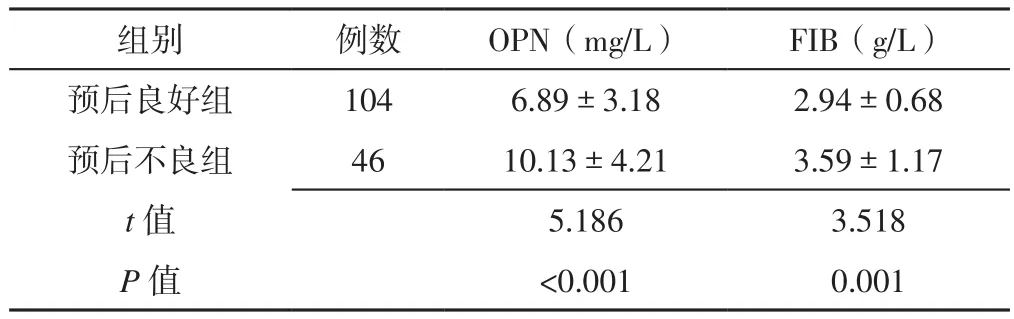
表4 预后良好组和预后不良组患者血浆OPN、FIB水平比较(±s)Table 4 Comparison of plasma levels of OPN and FIB in patients with different prognosis
组别 例数 OPN(mg/L) FIB(g/L)预后良好组 104 6.89±3.18 2.94±0.68预后不良组 46 10.13±4.21 3.59±1.17 t值 5.186 3.518 P值 <0.001 0.001
3 讨论
ROSS[7]研究结果显示,炎性反应可参与AS的发生、发展。WU等[8]研究表明,伴有颈动脉粥样硬化斑块患者炎性标志物表达升高,且颈动脉粥样硬化斑块易损性与血清中炎性标志物水平相关,包括OPN、FIB、超敏C反应蛋白(hs-CRP)、白介素6(IL-6)及肿瘤坏死因子α(TNF-α)等。脑组织缺血后的炎症级联反应可能是导致脑损伤进一步加重的重要原因之一[9]。有研究显示,通过检测炎性反应因子可预测脑梗死患者预后[10]。因此,本研究分析了血浆OPN、FIB水平与急性脑梗死患者NIHSS、mRS评分的相关性,并进一步探讨其对患者神经功能缺损程度及预后的预测价值。
OPN是一种特异性骨涎蛋白,于大鼠肉瘤细胞克隆时被首次提出[11]。动物实验研究结果显示,颈动脉血管内皮损伤后内皮细胞、平滑肌细胞内OPN mRNA表达上调,8 h可达高峰,持续14 d后逐渐下降[8]。WANG等[12]研究发现,急性缺血性脑卒中患者血浆OPN水平明显升高,且其不仅在原发性AS形成过程中具有促进作用,还可促进血管重建术后动脉再狭窄。相关研究表明,在颈动脉内膜剥脱前采用抗OPN抗体治疗可抑制内膜增生[13]。本研究结果显示,脑梗死组患者血浆OPN水平高于对照组,中重型脑梗死组患者血浆OPN水平高于轻型脑梗死组,预后不良组患者血浆OPN水平高于预后良好组,且血浆OPN水平与急性脑梗死患者NIHSS评分和mRS评分呈正相关,提示血浆OPN水平越高急性脑梗死患者神经功能损伤越严重、预后越差。分析血浆OPN水平影响急性脑梗死患者神经功能损伤程度及预后的可能机制如下:(1)OPN可通过RGD、SVVYGLR序列与细胞表面的多种整合素受体(如整合素αvβ1、αvβ3、αvβ5、α4β1等)相互作用,进而促进血管平滑肌细胞由中膜向内膜迁移及以巨噬细胞为主的炎性细胞向损伤部位聚集,增加T淋巴细胞中CD3表达和活性氧生成,加速AS形成[14];(2)OPN是一种强效的软组织矿化抑制剂,可防止血管钙化、降低斑块稳定性;(3)AS斑块中微血管形成有助于易损斑块形成,OPN可通过αvβ3-磷脂酰肌醇3-激酶-蛋白激酶B-内皮型一氧化氮合酶-一氧化氮(αvβ3-PI3-K-Akt-eNOS-NO)信号通路直接刺激微血管生成,进而增加斑块破裂发生风险[15]。本研究结果还显示,血浆OPN水平预测急性脑梗死患者神经功能缺损程度和预后的AUC分别为0.724、0.726,提示血浆OPN水平可在一定程度上预测急性脑梗死患者神经功能缺损程度及预后。

表5 血浆OPN、FIB水平对急性脑梗死患者神经功能缺损程度和预后的预测价值Table 5 Predictive value of plasma levels of OPN and FIB on degree of nervous functional defects and prognosis

图1 血浆OPN、FIB水平预测急性脑梗死患者神经功能缺损程度的ROC曲线Fugure 1 ROC curve for predictive value of plasma levels of OPN and FIB on degree of nervous functional defects in patients with acute cerebral infarction
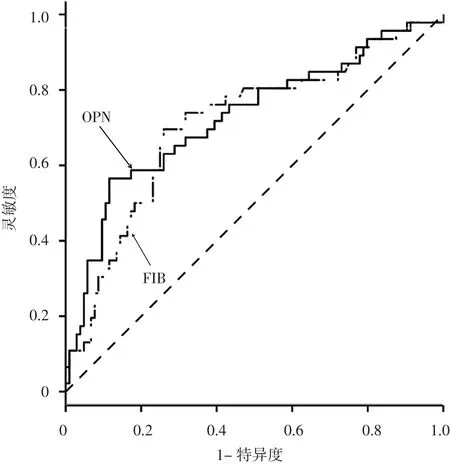
图2 血浆OPN、FIB水平预测急性脑梗死患者预后的ROC曲线Figure 2 ROC curve for predictive value of plasma levels of OPN and FIB on prognosis in patients with acute cerebral infarction
FIB是一种经典的炎性标志物,其在AS形成过程中诱导平滑肌细胞向血管内膜迁移,促进其形成斑块内的泡沫细胞,从而导致血管内皮细胞损伤;此外,FIB还可通过在血浆中形成网状结构而影响血流动力学,使血小板和红细胞聚集性增加,调节白细胞-内皮细胞相互作用,增加血液黏稠度,促使血栓形成[16]。本研究结果显示,脑梗死组患者血浆FIB水平高于对照组,中重型脑梗死组患者血浆FIB水平高于轻型脑梗死组,预后不良组患者血浆FIB水平高于预后良好组,且血浆FIB水平与急性脑梗死患者NIHSS评分和mRS评分呈正相关,推测FIB可能参与急性脑梗死患者的炎性反应过程。既往研究表明,血浆FIB水平升高是罹患冠状动脉粥样硬化性心脏病、缺血性脑卒中和周围血管疾病的独立危险因素[17]。本研究结果显示,血浆FIB水平预测急性脑梗死患者神经功能缺损程度和预后的AUC分别为0.714、0.711,提示血浆FIB水平可在一定程度上预测急性脑梗死患者神经功能缺损程度及预后。DEL ZOPPO等[18]研究结果显示,血浆FIB水平升高是急性脑梗死患者发病后90 d时预后不良的独立预测因素,本研究结果与其相似。
综上所述,血浆OPN、FIB水平与急性脑梗死患者神经功能缺损程度及预后呈正相关,并可在一定程度上预测患者神经功能缺损程度及预后。但本研究为单中心研究,样本量较小,且未动态监测血浆OPN、FIB水平变化,故研究结果结论仍需扩大样本量、联合多中心进一步研究证实。
作者贡献:赵士娇、高燕军进行文章的构思与设计;赵士娇进行研究的实施与可行性分析并撰写论文;赵士娇、韩雪进行数据收集与整理,结果分析与解释;韩雪进行论文修订;高燕军负责文章的质量控制及审校,对文章整体负责、监督管理。
本文无利益冲突。
