TLR4及MYD88多态性与江苏地区幽门螺杆菌感染的相关性研究
2018-10-25欧希龙俞文秀
杜 江 欧希龙 俞文秀
幽门螺杆菌(H.pylori)是一种寄生于胃及十二指肠的微需氧的革兰阴性细菌[1]。最早由澳大利亚科学家Barry Marshall和Robin Warren在患有慢性胃炎及胃溃疡的患者中发现。流行病学调查显示目前某些发展中国家H.pylori的感染率高达90%,且有20%~30%的感染者诱发相关疾病,包括消化性溃疡、胃癌、黏膜相关性淋巴组织淋巴瘤。我国人群H.pylori感染率在60%以上,如何确定H.pylori感染的高危人群并实施有效的预防措施,是降低H.pylori感染相关性疾病关键[2-4]。
不同个体感染H.pylori后表现出不同的临床结果,这些不同的临床表型主要取决于机体的遗传背景与感染源的相互作用。Toll样受体(TLRs)是一种病原相关性分子模式受体,在机体天然免疫系统的调节中发挥重要作用。TLRs常以单体、跨膜的形式广泛表达于巨噬细胞、树突状细胞、自然杀伤细胞等多种免疫细胞上,其主要作用是识别结构上高度保守的微生物抗原,最终诱导机体产生天然免疫反应和抗原特异的获得性免疫反应。
多种原因引起的TLRs表达水平异常会引起TLRs的功能紊乱,导致其抗原识别能力减弱,机体发生感染复发及多重感染[5-6]。单核苷酸多态性(single nucleotide polymorphism,SNP)是由于单个核苷酸改变而导致的核酸序列多态性,发生在基因启动子、外显子区域的功能性SNP常是多种基因及蛋白表达及功能改变的主要原因。本文拟通过病例对照研究,探讨TLR4信号通路上的TLR4 rs10759932及Myd88rs7744多态性与H.pylori感染的相关性,以扩展对于H.pylori感染人群基因背景的认识,并为寻找新的防治H.pylori感染的治疗策略提供理论支持。
资料与方法
一、SNP的选择
应用国际人类基因组单体型图计划(Hapmap计划)和dbSNP数据库中公布的中国人群或亚洲人群TLR4及MYD88基因的SNP数据,选择突变频率相对较高且发生在启动子或编码区的TLR4 rs10759932及MYD88 rs7744作为本次研究的候选SNP。
二、样本选择和采集及临床资料的收集
样本资料来自2015年8月至2017年12月间到我院门诊就诊并确诊为H.pylori感染的236例患者及同期在我院健康管理中心体检确定无H.pylori感染的242例对照人群。H.pylori感染患者经临床、实验室检查排除胃癌、胃泌素瘤、平滑肌肉瘤、非甾体抗炎药所致溃疡、克罗恩病等原有胃部疾病。对照组人群排除胃肠道疾病、恶性肿瘤、自身免疫性疾病、糖尿病、高血压等疾病。所有入选者在入选时均告知其项目研究内容及意义。本研究获江苏省句容市人民医院伦理委员会的批准。采集所有入选个体5 mL静脉血用以抽提DNA进行基因分型,同时采集空腹静脉血3 mL,进行血清学细胞因子IL-1β、IL-6等细胞因子的检测。
三、基因分型
酚-氯仿法抽提人外周血基因组DNA,应用聚合酶链式反应-限制性片段长度多态性 (PCRRFLP)的分析方法对所选取的LR4 rs10759932及MYD88 rs7744多态性位点进行基因分型。
四、外周血单个核细胞(PBMCs)提取
采集人外周静脉血5 mL于EDTA抗凝管,将新鲜血液转移进15 mL离心管中,用无菌5 mL PBS等倍稀释血液,上下颠倒混匀。吸取5 mL淋巴细胞分离液置于15 mL离心管,放入平衡离心机选择2 000 rpm/min,离心30 min。用吸管小心吸取白膜层,置于另一15 mL离心管中,加入2~3倍体积的无菌PBS,上下颠倒混匀,2 000 rpm/min,离心10 min。将上清倒掉,沉淀用同法洗涤两次。将所得PBMCs置于无酶无菌1.5 mL EP管中。
五、Western blot
准备蛋白样品,98℃变性5 min,冰上冷却,SDS-PAGE电泳后使用半干转膜系统进行转膜,用含5%脱脂奶粉的TBST室温封闭2 h。一抗4℃孵育16~18 h,TBST洗涤10 min,3次。二抗室温(20~25℃)孵育 1 h,TBST 洗涤 10 min,3次。加入高灵敏的LunimataTM Crescendo发光剂至膜的正表面,采用Bio-Rad ChemiDoc XRS+成像系统进行拍照分析。
六、血清细胞因子IL-1β、IL-6的检测
采用ELISA法检测入组者血清中IL-1β、IL-6的浓度。试剂盒购自北京热景生物技术有限公司,具体步骤严格按照操作说明进行。
七、统计方法
运用SPSS 16.0软件对研究数据进行统计处理。计量资料以x±s表示,两组间比较采用独立样本t检验,不符合正态分布的计量资料采用对数(lg)转换呈正态分布后再进行检验。计数资料以%表示,采用χ2检验。双侧P<0.05时认为有统计学差异。
结 果
一、病例组及对照组一般情况比较
本实验共收集到H.pylori感染病例236例,对照组242例。两组人群在年龄、性别、体重指数、血脂、胃肠疾病家族史等指标方面无统计学差异,见表1。

表1 H.pylori病例及对照人群一般资料比较
二、TLR4基因rs10759932多态性位点分析
H.pylori感染组和对照组中rs10759932位点TT、TC和 CC基因型频率分别为 61.4%、33.9%、4.7%和52.9%、36.8%、10.3%,两组中rs10759932不同基因型的分布符合Hardy-Weinberg平衡。H.pylori感染组rs10759932 TT基因型分布频率显著高于对照组 (P=0.032), 见表 2。与基因型为rs10759932 CC的个体相比,携带rs10759932 T等位的个体 (TC+TT基因型)H.pylori感染的风险显著升高(OR=2.357,95%可信区间:1.132-4.906,P=0.019)。

表2 H.pylori病例及对照人群TLR4基因rs10759932位点基因型分布情况 [n(%)]
三、TLR4基因 rs10759932多态性对外周血PBMCs TLR4表达的影响
通过分离收集H.pylori感染患者外周血的PBMCs,并运用 Western blot对 PBMCs上的 TLR4的表达进行分析,我们发现在H.pylori感染患者中,rs10759932 TT基因型个体外周血PBMCs中TLR4的蛋白表达水平量显著高于TC及CC基因型个体(P < 0.01,图 1)。
四、MYD88 rs7744多态性位点分析
H.pylori感染组和对照组rs7744位点GG、AG和 AA基因型频率分别为40.7%、52.5%、6.8%和31.8%、55.4%、12.8%,两组中rs7744不同基因型的分布符合Hardy-Weinberg平衡。H.pylori感染组rs7744 GG基因型分布频率显著高于对照组 (P=0.027),见表3。与基因型为rs7744 AA的个体相比,携带rs7744 G等位的个体(GG+AG基因型)H.pylori感染的风险显著升高 (OR=2.020,95%可信区间:1.074-3.801,P=0.027)。
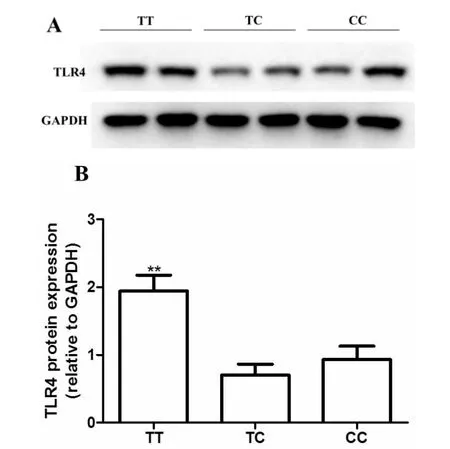
图1 TLR4 rs10759932多态性对TLR4表达变化的影响(A代表性免疫印迹图;B不同基因型个体TLR4表达差异统计直方图,n=10,**与 CC基因型个体比较 P<0.01。TT:rs10759932 TT基因型个体,TC:rs10759932 TC基因型个体,CC:rs10759932 CC基因型个体)

表3 H.pylori病例及对照人群MYD88基因rs7744位点基因型分布情况 [n(%)]
五、TLR4与MYD88多态性对血清IL-1β、IL-6的影响
通过应用ELISA法检测H.pylori感染者及对照组人群血清IL-1β、IL-6的水平,我们发现携带TLR4 rs10759932 T等位MYD88 rs7744 G等位基因的H.pylori感染患者其血清IL-1β、IL-6的水平显著高于对照人群(P<0.01,图2)。
讨 论
TLRs受体能够识别广泛表达于病原微生物上的模式分子并将其与宿主分子区别开来,通过启动天然免疫和调节免疫反应而在机体防御病原微生物感染中发挥了重要作用。胃黏膜上皮细胞中表达多种TLRs,这些TLRs通过识别H.pylori上的模式分子,启动宿主的免疫应答,招募包括髓样分化因子88(myeloid differentiation factor 88,MYD88)在内的多种衔接蛋白进行细胞内信号转导,最终导致NF-κB通路的激活及相关细胞促炎因子的释放[7-8]。本研究通过设置病例对照实验,探讨了TLR4及其相应的信号衔接蛋白MYD88上的两个功能性SNP与H.pylori感染易感性的关系。我们发现在H.pylori感染患者中,TLR4 rs10759932 T等位基因的分布频率显著高于对照人群;同样,MYD rs7744 G等位携带个体H.pylori感染风险显著上升。

图2 TLR4与MYD88多态性对血清IL-1β、IL-6的影响(与对照组比较,*P<0.05,**P<0.01)
TLR信号通路异常会引起机体促炎因子及抑炎因子的比例失调而导致多种疾病的发生[9-10]。有研究报道,在TLR4基因编码区的TLR4 Asp299Gly和Thr399Ile两个功能性SNP能够改变机体对病原微生物的免疫反应水平并影响中北美地区人群胃肠疾病的易感性[11-14]。以上研究均提示TLR4多态性通过改变TLR4的功能在胃肠疾病的发生发展中发挥重要作用。但是上述功能性SNP在中国人群中的比例相当罕见,因此作为疾病标志物的参考价值不大。通过检索国际人类基因组单体型图计划(Hapmap计划)和中国人群dbSNP数据库我们发现TLR4 rs10759932多态性各等位基因在中国人群中均有一定的分布频率,且此SNP位于TLR4基因的5′-端侧翼区域,发生在此区域的SNP能够改变相关转录因子与TLR4启动子区域的结合使TLR4的表达水平发生改变。Huang等[15]的研究也已证明此SNP与中国人群胃癌的发病率相关。我们的研究结果表明TLR4 rs10759932 T等位基因携带者其H.pylori感染的风险性明显升高。这一结果进一步支持可将TLR4 rs10759932 T等位基因作为一个临床上预测胃肠疾病风险性的独立指标。此外,本研究还通过随机检测部分H.pylori感染患者外周血PBMCs中TLR4蛋白表达水平,进一步验证了TLR4 rs10759932 T等位基因对TLR4表达的影响,结果表明TLR4 rs10759932 TT基因型个体其外周血PBMCs TLR4表达水平显著高于其他基因型个体,提示这一功能性SNP对TLR4表达水平产生影响。
MYD88是大多数TLRs的衔接蛋白,TLRs与相应配体结合后通过招募MYD88激活下游NF-κB通路[16-18]。通过前期在数据库中检索我们发现,MYD88 rs7744在中国人群中有一定突变频率,且其发生在MYD88基因外显子区域,可能影响MYD88的转录及翻译从而对TLR4-MYD88信号通路造成异常影响。因此我们的研究中也考察了MYD88 rs7744多态性与中国人群H.pylori感染的相关性,发现MYD88 rs7744 G等位携带者在H.pylori感染患者中的比例显著高于对照组人群。以往研究关于MYD88 rs7744多态性的报道较少,仅提示了其与溃疡性结肠炎及冠心病的关系[19-20]。本研究首次将MYD88的这一多态性与TLR4 rs10759932多态性进行联合分析,显示MYD88的这一多态性与中国人群H.pylori感染的相关性。我们发现MYD88 rs7744 G等位携带个体H.pylori感染风险性显著升高。通过分析H.pylori感染患者与对照组人群血清中的细胞因子水平,我们还发现同时携带TLR4 rs10759932 T等位MYD88 rs7744 G等位基因的H.pylori感染患者其血清IL-1β、IL-6的水平显著高于对照人群,表明TLR4 rs10759932及MYD88 rs7744多态性通过改变TLR4-MYD88信号通路的活性改变了机体应对外来微生物感染的免疫应答活性。
综上所述,本研究在江苏地区人群中证明了TLR4 rs10759932及MYD88 rs7744多态性与H.pylori感染的相关性,其中TLR4 rs10759932 T等位及MYD88 rs7744 G等位携带者其H.pylori感染风险性升高,这一结果可能与这两个SNP影响了TLR4-MYD88信号通路的活性而改变了机体的防御性免疫应答状态有关。关于TLRs家族及其衔接蛋白基因的其他多态性位点与H.pylori感染的关系还有待进一步研究。
