百里酚和香芹酚对阪崎克罗诺肠杆菌的抑制作用
2018-10-24贾振宇孙慧慧郝旭昇康慎敏郑晓营夏效东
贾振宇,孙慧慧,郝旭昇,康慎敏,郑晓营,郭 都,孙 怡,石 超,夏效东
(西北农林科技大学食品科学与工程学院,陕西杨凌 712100)
阪崎克罗诺肠杆菌是一种革兰氏阴性、兼性厌氧的无芽孢杆菌[1],能够引起菌血症、败血症、脑膜炎及坏死性小肠结肠炎,主要致病人群为新生儿、早产儿、低出生体重儿及免疫力低下的婴幼儿和成人,致死率高达50%~80%[2-3]。有研究表明,阪崎克罗诺肠杆菌可以从乳制品、干肉、牛奶、水果、蔬菜、大米等多种食物中分离得到[4]。该菌对酸性、高温、干燥、渗透压等环境压力都有一定的耐受能力,这一特点使其能够更好地在食物及环境中生存,进而导致食源性疾病[5-6]。
抗生素耐药性已成为重要的公共健康问题,发现新的抗菌药物对这一难题的解决至关重要[7]。因此,人们越来越关注合成化合物与抗生素过度使用的安全性,对利用天然抗菌物质研制食品防腐剂的兴趣也逐渐增加[3]。已有研究发现多种植物精油具有抗细菌、真菌等作用[8-9]。
香芹酚(2-甲基-5-异丙基苯酚)是一种酚类单萜物质,存在于多种芳香植物和植物精油中,已有报道表明这类单萜物质具有抑菌、杀菌、抗肿瘤、抗癌等活性[10]。百里酚(5-甲基-2-异丙基苯酚)与香芹酚互为同分异构体,区别为酚羟基在苯环上的位置不同。常温下,香芹酚为无色至淡黄色的油状液体,百里酚为无色半透明结晶。香芹酚和百里酚目前已被欧盟委员会认定为可作为食品中的调味剂(Regulation EU 872/2012),且被美国食品药品管理局认定为公认安全的食品添加剂(21 CFR 182.60)。在许多报道中,香芹酚和百里酚相比于其他药剂,具有更加突出的抑菌效果[5,11-12],但两者对阪崎克罗诺肠杆菌的抑菌作用及机制尚鲜有报道。另外,有研究显示,酚类化合物中的羟基官能团在抑菌活性中发挥重要作用[13-14],尤其是可能通过影响细胞膜结构及功能来影响细菌生长[15],但目前尚不明确物质结构中羟基位置的不同是否对抑菌效果有显著影响[14,16]。
本研究旨在确定和比较百里酚和香芹酚对阪崎克罗诺肠杆菌的抑菌效果,并且通过测定细胞膜电位、胞内ATP浓度、胞内pH、细胞膜完整性的改变及观察显微结构的变化,探讨可能的抑菌机制,为其作为天然抗菌剂在食品工业中的应用提供理论参考。
1 材料与方法
1.1 材料与仪器
阪崎克罗诺肠杆菌(Cronobactersakazakii)ATCC 29544、ATCC 29004、ATCC 12868、ATCCBAA-894 美国模式菌株收集中心;阪崎克罗诺肠杆菌分离菌株12-2、14-15、18-7、18-8和18-13 由西北农林科技大学食品科学与工程学院食品微生物研究团队分离;婴幼儿奶粉及米粉;胰蛋白胨大豆琼脂(Tryptone soya agar,TSA)、胰蛋白胨大豆肉汤(Tryptic Soy Broth,TSB) 北京陆桥技术股份有限公司;百里酚、香芹酚(HPLC≥98%) 成都曼斯特生物科技有限公司;LIVE/DEAD® BacLightTM细菌活性检测试剂盒 赛默飞世尔科技公司;DIBAC4(3)荧光探针、cFDA-SE荧光探针 美国Sigma公司;ATP检测试剂盒 碧云天生物技术公司;磷酸盐缓冲溶液(Phosohate buffered saline,PBS) 氯化钠 8.0 g/L,氯化钾 0.2 g/L,十二水合磷酸氢钠 3.62 g/L,磷酸二氢钾 0.24 g/L。
YT-CJ-LND型超净工作台 北京亚泰科隆仪器技术有限公司;GHX-9050B-2型细菌培养箱 上海福玛实验设备有限公司;5804R型低温冷冻离心机 德国Eppendorf公司;CD-UPT-1型分体式超纯水机 成都越纯科技有限公司;Smart SpecTMplus分光光度计 美国BIO-RAD公司;Bioscreen C微生物全自动生长曲线分析仪 芬兰Bioscreen公司;InfiniteTMM200 PRO多功能酶标仪 瑞士帝肯(TECAN)集团公司;Starter 2100/3C PropH计 上海洪纪设备有限公司;SCIENTZ-IID型超声波细胞粉碎机 宁波新芝生物科技股份有限公司;S-4800型场发射扫描电镜 日本Hitachi公司。
1.2 实验方法
1.2.1 菌种活化 将冻存于-80 ℃的阪崎克罗诺肠杆菌菌种ATCC 29544采用划线法在TSA平板上活化,37 ℃培养12 h后,挑取单菌落接种于30 mL TSB中,将培养液置于37 ℃培养18 h,培养后的菌悬液经离心(5000×g,15 min,4 ℃)去除上清液,PBS(pH7.2)洗涤两次后,再以一定量的PBS(pH7.2)重新悬浮菌体沉淀,用分光光度计测定并调整菌悬液的OD600 nm=0.5,使菌体浓度约为108CFU/mL。
1.2.2 百里酚和香芹酚对阪崎克罗诺肠杆菌最小抑菌浓度的测定 最小抑菌浓度(Minimal Inhibitory Concentrations,MIC)采用琼脂稀释法测定[17]。将TSA培养基高温高压灭菌并冷却至45 ℃左右,加入24孔细胞培养板中,再向其中加入百里酚或香芹酚,使其各孔的终浓度为800、600、400、300、200、150、100、75、50和37.5 μg/mL,充分吹打混匀。等待培养基在室温下凝固后,按照1.2.1中的方法活化菌种,并制备菌悬液,调整菌悬液吸光度至OD600 nm=0.5(108CFU/mL)。随后吸取2 μL菌悬液接种至各孔中央,将24孔板置于37 ℃培养箱中培养24 h后观测结果,其中MIC为抑制阪崎克罗诺肠杆菌生长的百里酚或香芹酚的最低浓度。实验以不含有百里酚或香芹酚的TSA培养基作为阴性对照,以含有1 mg/mL氨苄西林的TSA培养基作为阳性对照,其中,氨苄西林溶液使用无菌水配制,并用0.22 μm滤膜过滤。
1.2.3 百里酚和香芹酚对阪崎克罗诺肠杆菌生长曲线的影响 参照Silvaangulo等[18]的方法。首先按照1.2.1将阪崎克罗诺肠杆菌菌种ATCC 29544活化菌种,并制备菌悬液,用TSB肉汤调整菌悬液OD600 nm=0.5并稀释100倍,使菌体浓度约为106CFU/mL。向96孔细胞培养板每孔加入125 μL菌悬液和百里酚或香芹酚溶液(用1% DMSO溶解,TSB配制),使其各孔中百里酚和香芹酚的终浓度分别为MIC、1/2MIC和1/4MIC。样品对照组添加125 μL菌悬液及125 μL TSB,背景空白对照组添加250 μL TSB。设置微生物全自动生长曲线分析仪,培养温度为37 ℃,每隔1 h检测波长600 nm下的吸光度值。以时间(h)为横坐标,菌悬液在波长600 nm下的吸光度值为纵坐标,绘制生长曲线。
1.2.4 百里酚和香芹酚对阪崎克罗诺肠杆菌膜电位的影响 阪崎克罗诺肠杆菌细胞膜电位的测定参照Sanchez等[19]的方法进行,具体如下:菌液制备同1.2.1,将125 μL菌悬液加入黑色96孔细胞酶标板中,置于37 ℃培养箱中培养30 min。随后加入百里酚或香芹酚溶液(用PBS缓冲溶液配制),使其终浓度分别为0(对照组)、2MIC和4MIC,培养30 min。再向每孔中加入1 μmol/L荧光染料DiBAC4(3),37 ℃处理5 min后,使用多功能酶标仪检测荧光强度,设置激发和发射波长分别为492 nm和515 nm,激发和发射缝隙宽度分别为3 nm和5 nm。测得的各组荧光值均减去对应背景空白荧光值。
1.2.5 百里酚和香芹酚对阪崎克罗诺肠杆菌胞内pH的影响 阪崎克罗诺肠杆菌胞内pH的测定参照Li等[20]的方法进行,菌液制备同1.2.1,将菌液离心(5000×g,10 min,4 ℃),去除上清液,使用磷酸钾缓冲溶液洗涤一次,并调整菌悬液吸光度为OD600 nm=0.5。以50 mmol/L HEPES缓冲溶液(含5 mmol/L EDTA,pH=8.0)洗涤菌体两次,并重新悬浮于20 mL的HEPES缓冲溶液。随后加入3 μmol/L cFDA-SE荧光探针,在37 ℃培养箱中孵育20 min,以50 mmol/L磷酸钾缓冲溶液(含10 mmol/L MgCl2,pH=7.0)洗涤一次,并将菌体重悬于10 mL该溶液。加入10 μmol/L葡萄糖溶液并在37 ℃培养30 min,以消除非共轭的cFSE荧光探针。最后,使用PBS缓冲溶液(pH=7.0)洗涤菌体两次,在冰上保存。用磷酸钾缓冲溶液配制百里酚及香芹酚溶液,添加至菌悬液中,浓度设置为0(对照组)、2MIC和4MIC,37 ℃下培养20 min。将样品加入黑色96孔细胞酶标板中,使用多功能酶标仪测定荧光强度,设置激发波长为490 nm和440 nm,发射波长为520 nm,激发和发射缝隙宽度分别为9 nm和20 nm,检测温度为25 ℃。检测不含菌悬液的PBS缓冲溶液(百里酚、香芹酚浓度为:0、2MIC和4MIC)的背景空白荧光值,测得的各组荧光值均减去对应背景空白荧光值。配制一系列不同pH(3、4、5、6、7、8、9、10)的缓冲溶液,使用cFDA-SE荧光探针检测荧光强度,构建标准曲线。pH缓冲溶液由甘氨酸(50 mmol/L)、柠檬酸(50 mmol/L)、Na2HPO4·2H2O(50 mmol/L)和KCl(50 mmol/L)配制而成,使用NaOH和HCl调整pH。加入缬氨霉素(10 μmol/L)和尼日利亚菌素(10 μmol/L),使细菌胞内pH和胞外pH相等。检测温度同为25 ℃。
1.2.6 百里酚和香芹酚对阪崎克罗诺肠杆菌胞内ATP浓度的影响 阪崎克罗诺肠杆菌胞内ATP浓度的测定方法参考Sanchez等[19]的方法,具体为:按照1.2.1制备菌悬液,向离心管中加入2 mL菌悬液,之后加入不同浓度的百里酚、香芹酚溶液(用PBS缓冲溶液配制),使其两种物质浓度分别达到0、2MIC和4MIC,置于37 ℃培养箱中培养30 min。随后对样品进行超声处理,裂解菌体细胞。每个样品超声结束后立即置于100 ℃温度下处理2~3 min,使样品中ATP酶灭活。将样品离心(5000×g,5 min),取上清液。根据ATP检测试剂盒说明书将ATP检测工作液加入白色96孔酶标板,放置3~5 min后加入样品,使用多功能酶标仪测定化学发光强度。同时,使用ATP检测裂解液将ATP标准溶液稀释成0.01、0.1、1和10 μmol/L 4个浓度梯度,绘制化学发光强度与ATP浓度的标准曲线,并根据标准曲线计算样品中的ATP浓度。
1.2.7 百里酚和香芹酚对阪崎克罗诺肠杆菌细胞膜完整性的影响 阪崎克罗诺肠杆菌细胞膜完整性的测定参照Shi等[21]的方法,使用LIVE/DEAD® BacLight细菌活性检测试剂盒进行检测。具体方法为:菌液制备同1.2.1,将菌液离心(10000×g,15 min,4 ℃),去除上清液后用0.85% NaCl溶液洗涤菌体两次。随后加入2 mL的0.85% NaCl溶液重新悬浮,分别取1 mL菌悬液加入到20 mL的0.85%NaCl溶液(活菌组)和70%异丙醇溶液(死菌组)中,置于25 ℃培养箱中培养1 h(每15 min摇匀一次)。离心(10000×g,10 min,4 ℃),弃上清,使用0.85% NaCl洗涤2~3次,将两组菌悬液吸光度均调整至OD600 nm=0.5(两组误差不超过0.01)。添加百里酚或香芹酚于处理组菌液中,使其浓度为0、2MIC和4MIC,在37 ℃下放置30 min,离心,去除上清液,加入相同体积的0.85% NaCl溶液重新悬浮菌液。之后以不同体积活菌组菌悬液和死菌组菌悬液配制不同活菌比例(0%,10%,50%,90%,100%)的菌悬液作为标准曲线组,在96孔黑色酶标板中设置样品空白对照组(0.85%NaCl溶液)、样品处理组和标准曲线组,并向所有孔内加入100 μL SYTO/PI的2X染料,充分吹打混匀。将96孔酶标板置于25 ℃下培养10 min。使用多功能酶标仪检测荧光强度,SYTO染料的激发/发射波长为485/542 nm,PI染料的激发/发射波长为485/610 nm。
1.2.8 百里酚、香芹酚对阪崎克罗诺肠杆菌细胞形态的影响 阪崎克罗诺肠杆菌细胞形态的观察参照Li等[22]的方法,使用场发射扫描电镜进行观测,具体为:按照1.2.1制备菌悬液,将添加不同浓度百里酚或香芹酚(0、2MIC和4MIC)的菌液(OD600 nm=0.5)置于37 ℃培养箱中培养4 h。离心(5000×g,10 min,4 ℃),弃上清,用PBS缓冲溶液(pH=7.0)洗涤菌体两次,将菌体重新悬浮于2.5%戊二醛-PBS溶液中固定12 h(4 ℃)后,依次使用PBS、无菌水洗涤菌体,并将菌体置于1%(v/v)锇酸中固定5 h,随后使用不同体积分数的乙醇溶液(30%、50%、70%、80%、90%和100%)梯度洗脱,每次10 min。将样品滴加至专用圆形小玻片并贴附于场发射扫描电镜载物台,样品抽真空脱水2 h后喷金处理,使用场发射扫描电镜观测细菌细胞形态。
1.3 数据处理
所有数据均为3次重复的平均值,采用SPSS 20.0软件对实验数据进行方差分析(analysis of variance,ANOVA),采用Ducan法进行显著性检验,p<0.05表示显著,p<0.01表示极显著。
2 结果与分析
2.1 百里酚和香芹酚对阪崎克罗诺肠杆菌的最小抑菌浓度测定结果
百里酚和香芹酚对9株阪崎克罗诺肠杆菌的最小抑菌浓度结果如表1所示,均在0.1~0.2 mg/mL之间,其中两者对ATCC标准菌株ATCC 29544、ATCC 29004和ATCC 12868的最小抑菌浓度均为0.1 mg/mL。该结果表明,香芹酚和百里酚对阪崎克罗诺肠杆菌均有良好的抑制效果,且两者无明显差异。本实验选取ATCC 29544菌株进行后续的研究。

表1 百里酚和香芹酚对阪崎克罗诺肠杆菌的最小抑菌浓度Table 1 Minimum inhibitory concentrations of thymol and carvacrol against Cronobacter sakazakii
2.2 百里酚和香芹酚对阪崎克罗诺肠杆菌生长曲线的影响
图1表明,百里酚和香芹酚都能够明显降低阪崎克罗诺肠杆菌ATCC 29544的生长速率及最大菌体浓度,并且其效果随天然物质浓度增加而增强。在MIC浓度下,百里酚和香芹酚能够完全抑制阪崎克罗诺肠杆菌ATCC 29544的生长。两种物质的1/2MIC、1/4MIC浓度组与对照组相比,阪崎克罗诺肠杆菌在对数期的生长速率差别不大,但处理浓度越低,稳定期菌体浓度越大。由此可以看出,百里酚和香芹酚对阪崎克罗诺肠杆菌生长曲线的作用呈现明显的浓度依赖性。
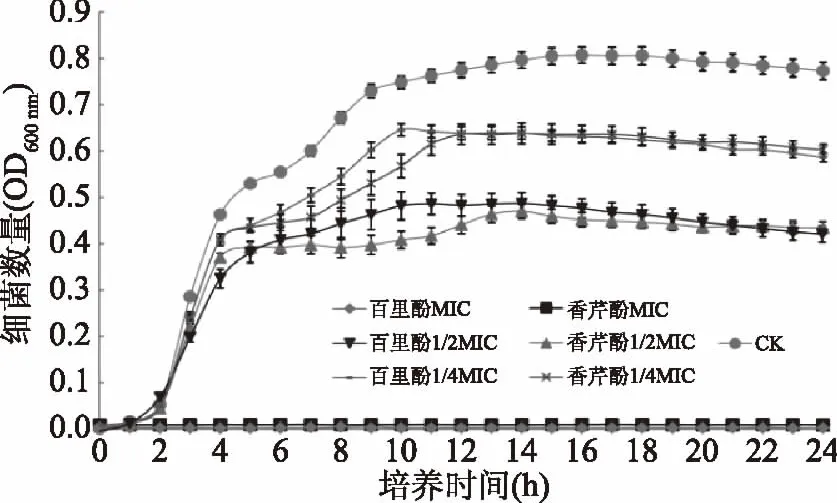
图1 阪崎克罗诺肠杆菌在含有不同浓度百里酚和香芹酚的TSB中的生长曲线Fig.1 Growth curves of C. sakazakii ATCC 29544 cultured in TSB with various concentrations of thymol and carvacrol
2.3 百里酚和香芹酚对阪崎克罗诺肠杆菌膜电位的影响
实验所使用的阴离子荧光染料DiBAC4(3)本身不发光,当进入细胞后与胞浆内的蛋白质结合可发出荧光。若DiBAC4(3)进细胞后发出的荧光通过键合激活而增强,说明细胞膜膜电位增加,则说明细胞出现去极化;反之则表示细胞超极化[23-24]。正常情况下,未经处理的阪崎克罗诺肠杆菌细胞膜呈现外负内正,钠钾离子的电压门控制通道关闭,该状态被称为膜的极化状态。而经过百里酚和香芹酚处理的菌体膜电位向膜内负值增大方向变化,钾离子流出细胞,荧光强度降低细胞出现超极化[25-26]。超极化已被报道是一种重要的细胞膜损伤类型[24,27]。从图2可知,百里酚及香芹酚处理后阪崎克罗诺肠杆菌膜电位均出现超极化(相对荧光强度负值)。经0.4 mg/mL香芹酚处理,细菌细胞膜电位显著改变(p<0.05),经0.2及0.4 mg/mL百里酚处理,细菌细胞膜电位均极显著改变(p<0.01)。且同浓度下,百里酚处理菌体得到的相对荧光强度的绝对值比香芹酚更大。由此可见,与香芹酚作用相比,百里酚对阪崎克罗诺肠杆菌膜电位的作用效果更加明显。
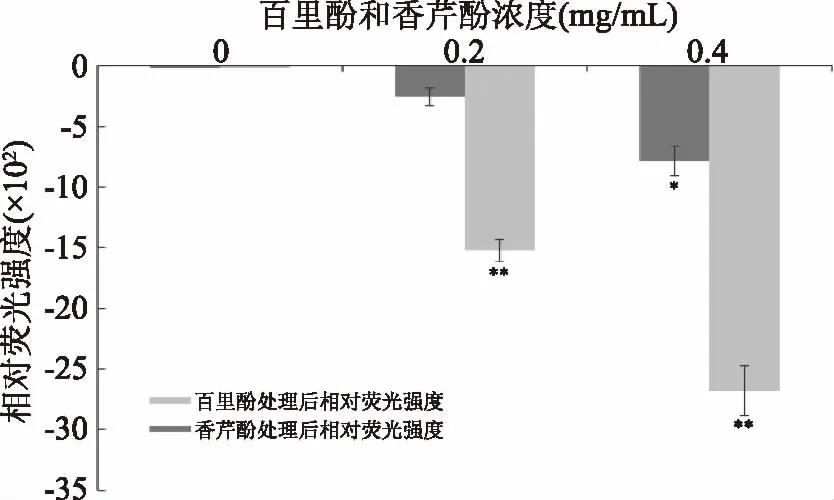
图2 百里酚和香芹酚对阪崎克罗诺肠杆菌ATCC 29544细胞膜电位的影响Fig.2 Effects of thymol and carvacrol on the membrane potentials of C. sakazakii ATCC 29544注:*表示与对照组相比,差异显著(p<0.05),**表示与对照组相比,差异极显著(p<0.01)。
2.4 百里酚和香芹酚对阪崎克罗诺肠杆菌胞内pH的影响
实验中用到的细菌胞内pH检测方法是基于cFDA-SE能被细胞胞浆中的酯酶催化为发出绿色荧光的cFSE,而过量未偶联到细胞蛋白质上的cFSE可在葡萄糖存在的条件下短时间孵育得以清除的原理[28]。实验结果表明,490 nm与440 nm的荧光比值与阪崎克罗诺肠杆菌的胞内pH有良好的线性关系,线性拟合方程为:y=-0.9085x+6.2556(R2=0.988),因此可通过荧光比值计算细菌胞内pH。由图3可知,经百里酚或香芹酚处理后,阪崎克罗诺肠杆菌胞内pH均极显著降低(p<0.01),表现为:未经处理的阪崎克罗诺肠杆菌胞内pH为5.45±0.06,经浓度为0.2和0.4 mg/mL的百里酚处理后,阪崎克罗诺肠杆菌胞内pH降低分别为5.16±0.05和4.96±0.06。经浓度为0.2和0.4 mg/mL的香芹酚处理后,阪崎克罗诺肠杆菌胞内pH降低分别为5.05±0.05和4.97±0.05。同时,结果也表明,相同浓度的百里酚和香芹酚对阪崎克罗诺肠杆菌胞内pH的影响效果无显著差异(p>0.05)。胞内pH对细菌的多种生理功能紧密相关,如DNA转录、蛋白质合成、酶活性、细胞运动性等[29-30]。胞内pH的改变表明百里酚和香芹酚使阪崎克罗诺肠杆菌的细胞膜受损。
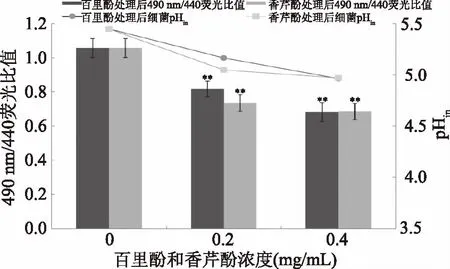
图3 百里酚和香芹酚对阪崎克罗诺肠杆菌ATCC 29544胞内pH的影响Fig.3 Effects of thymol and carvacrol on the intracellular pH of C. sakazakii ATCC 29544注:**表示与对照组相比,差异极显著(p<0.01);图4同。
2.5 百里酚和香芹酚对阪崎克罗诺肠杆菌胞内ATP浓度的影响
实验根据萤火虫荧光素酶需要ATP提供能量催化荧光素从而产生荧光,以及在一定浓度范围内荧光强度和ATP的浓度成正比的原理,构建标准曲线。经测定,细菌胞内ATP浓度与相对荧光强度有良好的线性关系(y=42891x+1647.9,R2=1),可通过相对荧光强度的变化确定细菌胞内ATP浓度的增减。实验结果显示,百里酚及香芹酚对阪崎克罗诺肠杆菌胞内ATP浓度均有极显著的降低作用(p<0.01)(图4)。未经处理的阪崎克罗诺肠杆菌胞内ATP浓度为0.584 μmol/L。经浓度为0.2和0.4 mg/mL百里酚处理后,阪崎克罗诺肠杆菌胞内ATP浓度分别降低至0.051 μmol/L和0.048 μmol/L。经浓度为0.2和0.4 mg/mL香芹酚处理后,阪崎克罗诺肠杆菌胞内ATP浓度分别降为0.030和0.027 μmol/L。由此可得,0.2 mg/mL的两种物质即可使阪崎克罗诺肠杆菌的胞内ATP浓度降至比较低的水平,浓度依赖效应不太明显,此外香芹酚比百里酚降低胞内ATP浓度的效果更加明显。ATP对细菌的生长、繁殖、代谢、酶反应等都至关重要,胞内ATP浓度也是一项评价微生物可利用能量的重要参数,因此是检测抑菌效果的重要目标参数之一[31-32]。ATP浓度的下降可能是由于细胞膜通透性改变,致使细胞质ATP流出[33]。
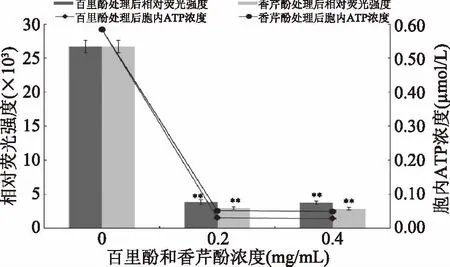
图4 百里酚和香芹酚对阪崎克罗诺肠杆菌ATCC 29544胞内ATP的影响Fig.4 Effects of thymol and carvacrol on intracellular ATP production by C. sakazakii ATCC 29544
2.6 百里酚和香芹酚对阪崎克罗诺肠杆菌细胞膜完整性的影响
本实验用到的LIVE/DEAD® BacLightTM细菌活性检测试剂盒中共包含PI和SYTO® 9两种核酸染料,其中SYTO 9是一种绿色荧光小分子染料,它可以穿透完整的细胞膜,能被用于识别具有完整细胞膜的菌体,PI为大分子红色荧光染料,仅能穿过不完整的细胞膜,可被用于识别细胞膜受损的菌体[34]。实验结果表明,绿色荧光强度与细胞膜完整的细菌百分比有着良好的线性关系,从荧光强度能够反映出含有完整细胞膜的细菌比例。由表2可知,与对照组相比,2倍MIC的百里酚对阪崎克罗诺肠杆菌细胞膜的完整性破坏作用不显著(p>0.05),4倍MIC的百里酚作用极显著(p<0.01)。经0.2和0.4 mg/mL百里酚处理后,阪崎克罗诺肠杆菌细胞膜完整性分别变为97.9%和15.0%。香芹酚处理对阪崎克罗诺肠杆菌细胞膜的完整性有极显著的破坏作用(p<0.01)。经0.2和0.4 mg/mL香芹酚处理后,细胞膜完整性分别为31.1%和11.9%。可见香芹酚对阪崎克罗诺肠杆菌细胞膜完整性的破坏作用比百里酚更加明显。

表2 百里酚和香芹酚对阪崎克罗诺肠杆菌ATCC 29544细胞膜完整性的影响Table 2 Effects of thymol and carvacrol on the membrane integrity of C. sakazakii ATCC 29544
2.7 百里酚和香芹酚对阪崎克罗诺肠杆菌细胞形态的影响
百里酚和香芹酚对阪崎克罗诺肠杆菌的细胞形态有明显的影响,如图5所示。未经处理的阪崎克罗诺肠杆菌(图5A)呈杆状,形态饱满,胞体光滑。经0.2 mg/mL百里酚处理后,部分细菌出现表面塌陷,菌体变形(图5B)。经0.4 mg/mL百里酚处理后,细菌细胞表面出现严重的皱缩和塌陷,细胞膜被分解,出现碎片(图5C)。香芹酚也呈现相似的结果。由此可得,百里酚、香芹酚都能改变阪崎克罗诺肠杆菌细胞形态,且其对细胞形态的影响随浓度升高而增大。

图5 扫描电镜图(20000×)Fig.5 Scanning electron micrographs(20000×)注:A.未经百里酚和香芹酚处理;B. 0.2 mg/mL百里酚处理4 h;C. 0.4 mg/mL百里酚处理4 h;D. 0.2 mg/mL香芹酚处理4 h;E. 0.4 mg/mL香芹酚处理4 h;标尺为2 μm。
3 结论与讨论
以琼脂稀释法测定百里酚、香芹酚对阪崎克罗诺肠杆菌的抑菌能力,结果表明,两种物质对9株阪崎克罗诺肠杆菌的MIC范围均在0.1~0.2 mg/mL之间。之后在此基础上,测定了百里酚和香芹酚对阪崎克罗诺肠杆菌ATCC 29544的生长曲线、膜电位、胞内pH、胞内ATP浓度、细胞膜完整性的影响。结果显示,0.1 mg/mL的百里酚和香芹酚均能在肉汤中完全抑制阪崎克罗诺肠杆菌ATCC 29544的生长繁殖,0.2 mg/mL的百里酚及0.4 mg/mL的香芹酚能够使细菌膜电位出现极显著的超极化(p<0.01),0.4 mg/mL百里酚和香芹酚可使阪崎克罗诺肠杆菌ATCC 29544胞内pH由5.45降低为4.96和4.97,并且0.4 mg/mL百里酚和香芹酚处理可使胞内ATP浓度由0.584 μmol/L降低为0.048、0.027 μmol/L,使细胞膜完整性分别降低85.0%和88.1%。最后实验通过场发射扫描电镜观察菌体细胞形态的改变,结果表明两者均使菌体干瘪皱缩,细胞膜出现孔洞甚至裂解成碎片。
一般认为,阪崎克罗诺肠杆菌的主要致病对象为婴幼儿,能够引起脑膜炎、菌血症等疾病,疾病控制和防治中心的数据曾指出,每年全球约有六例克罗诺菌的感染病例[2]。婴幼儿感染阪崎克罗诺肠杆菌的主要途径是婴幼儿配方奶粉,有研究指出被该菌污染的婴幼儿配方奶粉与克罗诺菌的感染具有流行病学上的直接联系[2,35]。日常生活中,人们通常使用热处理进行杀菌,世界卫生组织也建议使用70 ℃的热水冲调婴幼儿配方奶粉[36]。但高温可能会使奶粉中部分营养成分受到破坏[37],因此越来越多的研究者提出在食品中添加抗菌物质,从而达到预防和控制阪崎克罗诺肠杆菌等食源性致病菌的目的。
百里酚和香芹酚是百里香和牛至精油中的主要成分[38],也是美国食品药品监督管理局在调味剂和相关物质类别下认可的食品添加剂[39],具有较好的安全性以及在食品中较大的应用价值。目前已有研究表明,百里酚和香芹酚具有较强的抗菌能力,对两种物质的相关应用也十分丰富,例如基于两种物质制作微胶囊[40]、抗菌膜[41],与其他抑菌剂进行协同抑菌等[42]。
综上所述,百里酚和香芹酚对阪崎克罗诺肠杆菌具有明显的抗菌活性,且主要是通过损伤细菌细胞膜发挥其抑制作用。在本研究中,百里酚和香芹酚并未显示出因酚羟基位置及物理状态不同而造成的抑菌效果的差异。研究为百里酚和香芹酚作为天然抑菌剂应用到食品中,并有效控制阪崎克罗诺肠杆菌提供了一定的理论依据。然而这两种物质对食品感官品质的影响仍需在实际应用前进一步深入研究。
