miR-17在非小细胞肺癌放射抗拒细胞中的表达及作用研究
2018-10-24李万祯林晓辉张国前张书旭
李万祯 殷 俊 李 萍 林晓辉 张国前 张书旭
据最新的癌症统计数据显示,肺癌的发病率在中国排在首位,在美国排在第二位,而死亡率在两国均排在首位[1-2]。放疗作为晚期肺癌的主要治疗方式,然而只有10%患者能达到完全缓解,5年生存率不到15%[3],其中放射抗拒则是限制放疗疗效的关键因素[4]。因此,建立耐放射肿瘤细胞株,是研究放射抗拒机制的第一步。在X线下连续照射建立肿瘤放射抗拒细胞系,在乳腺癌[5]、喉癌[6]和鼻咽癌[7]等癌种已取得成功。目前肺癌放射抗拒的机制尚未明确,有几种分子机制被认为与其放射抗拒的形成有关,如DNA修复蛋白的改变、存活蛋白的失调、表皮生长因子受体(EGFR)的激活等[8]。microRNA(miRNA)是一类长度约为18~24个核苷酸的内源性非编码小分子单链RNA,参与调控细胞分化、生长、凋亡等功能[9]。miR-17-92基因簇位于人染色体13q31.3处,包括miR-17等6个成熟的miRNA,近年来被指通过调控几十种靶基因参与肿瘤的形成、转移和复发[10]。Jiang等[11]发现过表达miR-17-92水平明显提高了套细胞淋巴瘤Z138c细胞的放射抗拒性。但miR-17在肺癌放射抗拒机制的研究中鲜有报道。因此,本研究探索miR-17在肺癌放射抗拒中的作用,以期能成为非小细胞肺癌放射抗拒诊治的突破口。
1 材料与方法
1.1 主要仪器与试剂
直线加速器购自瑞典医科达公司Synergy;胎牛血清和培养基购自Gibco公司;CCK-8试剂盒购于日本同仁化学研究所;细胞周期试剂盒购于联科生物公司;RT-PCR试剂盒和细胞凋亡检测试剂盒购于美国Genecopoeia公司;miR-17引物和内参U6购自上海吉玛公司;Trizol试剂和Lipofectamine 2000转染试剂购自美国Introvigen公司;miR-17 mimic/NC和miR-17 inhibitor/NC购自广州锐博生物公司。
1.2 实验方法
1.2.1 细胞培养 肺腺癌细胞系H1975由广州医科大学附属肿瘤医院研究所保存。将在液氮中冻存的H1975细胞复苏,加入适量含10%胎牛血清的RPMI 1640培养基,置于37℃、5%CO2、饱和湿度的培养箱内培养,定期更换培养基。当细胞密度达到80%以上时进行胰酶消化和传代。
1.2.2 建立放射抗拒细胞系 取指数生长期H1975肺癌细胞,在直线加速器6 MV X线下垂直野照射,源皮距(SSD)100 cm,照射野为10 cm×10 cm,剂量率600 cGy/min,单次照射剂量为2 Gy,立即放回培养箱中培养,待细胞生长至80%以上,将适量细胞传代接种至新的培养瓶(剩余细胞冻存备用),待细胞再次进入指数生长期时,重复以上过程,依次按照2 Gy、4 Gy、6 Gy和8 Gy各3次进行照射,累积剂量为60 Gy。照射完成后的细胞常规传代10代,筛选得到放射抗拒细胞系,命名为H1975R,总耗时约为7个月。
1.2.3 细胞克隆形成实验检测放射敏感性 取指数生长期的H1975和H1975R细胞消化,计数,逐级稀释,根据照射剂量不同,在6孔板内接种不同数目细胞。待细胞贴壁12 h后,分别接受0 Gy、2 Gy、4 Gy、6 Gy和8 Gy X线照射,照射后放回培养箱培养,定期换液。直至照射后14天,甲醇固定,结晶紫染色,干燥后肉眼直接计克隆数或显微镜下计数≥50个细胞的集落数。计算集落形成率(Plating efficiency,PE)=集落数/接种细胞数,以接受0 Gy组PE作为对照组,计算各剂量组的细胞存活分数(Survival fraction,SF),SF=剂量照射组PE/对照组PE×100%。应用Graphpad Prism 5.0版软件,以多靶单击模型拟合细胞存活曲线,公式为SF=1-(1-e-kD)N,D0=1/K,logN=Dq/D0,计算H1975和H1975R细胞的放射生物学参数平均致死剂量(D0)、准阈剂量(Dq)、2 Gy照射后细胞存活分数(SF2)和外推数(N)。
1.2.4 RT-PCR检测miR-17表达 Trizol法提取待检测细胞总RNA,按照GeneCopoeia All-in-OneTMmiRNA PCR Kit说明书进行逆转录反应和实时PCR检测细胞miR-17的表达水平,以U6作为内参。逆转录反应条件为37℃孵育60 min,85℃温育5 min终止反应。PCR反应条件为95℃10 min预变性,95℃10 s变性,60℃退火20 s,72℃延伸10 s,共40个循环。检测完成后,计算机系统自动分析各样本Ct值,采用2-△△Ct计算基因的相对表达量。
1.2.5 细胞转染 取指数生长期的H1975和H1975R细胞消化,接种适量细胞于6孔板中,在培养箱中培养,待细胞密度达至80%即可用于转染。利用Lipofectamine 2000转染试剂将miR-17 inhibitor和NC转染至H1975R细胞中,将miR-17 mimic和NC转染到H1975细胞中(根据RT-PCR结果显示H1975R中miR-17表达量高于H1975),转染后6 h换液,转染24~48 h后,收集细胞用于后续实验。RT-PCR检测转染后细胞的miR-17表达和克隆形成实验检测转染后细胞放射敏感性,方法同前。
1.2.6 细胞增殖实验 取转染后24 h的细胞消化,计数,在96孔板中每孔接种200 μL细胞悬基(4 000个细胞),设3个副孔,于培养箱内继续培养,待细胞贴壁后0 h、24 h、48 h、72 h、76 h和120 h时,将细胞从培养箱内取出,弃去培养基,加入100 μL新培养基和10 μL CCK-8溶液,放回培养箱内继续培养2 h,应用酶标仪,设定波长为450 nm,测定各孔吸光度(OD450)值。以0 h的OD值作为对照组,其他各时间点为实验组,按照以下公式计算各时间点的细胞增殖率:增殖率(%)=实验组OD450/对照组OD450。
1.2.7 细胞凋亡检测 收集转染后48 h的细胞,用4℃预冷的PBS洗涤2次,离心弃上清,用1×Annexin-binding buffer重悬细胞,取100 μL细胞悬液于5 mL流式管中,加入5 μL FITC Annexin V和1 μL PI,轻轻混匀。在室温和避光的条件下反应15 min,再加入400 μL 1×Annexin-binding buffer,轻轻混匀,冰上放置。在1 h内通过流式细胞仪检测细胞凋亡率。
1.2.8 细胞周期测定 收集转染后48 h的细胞,用4℃预冷PBS洗涤1次,离心弃上清。加入1 mL DNA Staining solution和10 μL Permeabilization solution,涡旋振荡5~10秒充分混匀。室温避光孵育30 min后,通过流式细胞仪进行检测,分别读出G0/G1、S和G2/M期细胞的百分比。最终用Flowjo软件对细胞凋亡和细胞周期数据进行分析。
1.3 统计学处理
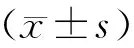
2 结果
2.1 细胞克隆形成实验检测放射敏感性
在不同的照射剂量下,H1975R细胞的克隆集落数均多于H1975(图1A)。从细胞存活曲线可知,随着照射剂量增大,细胞存活分数出现明显下降,但H1975细胞下降的幅度更大。由多靶单击模型得到各项放射生物学参数,H1975R的SF2为H1975的1.62倍(t=8.00,P<0.01),H1975R的D0为H1975的1.20倍(t=5.13,P<0.01),H1975R的Dq为H1975的2.56倍(t=5.87,P<0.01)。由此可知,H1975R比H1975细胞的放射抗拒性更强(图1B)。

图1 H1975和H1975R细胞克隆形成结果Figure 1 The colony formation in H1975 and H1975R cellsNote:A.A representative image of colony formation in H1975 and H1975R cells exposed to or not exposed to different doses of IR after 14 days;B.Survival fractions of H1975 and H1975R cells were obtained from the results of the colony-forming assay.
2.2 RT-PCR检测miR-17表达情况
H1975R的miR-17表达量是H1975细胞的2.68倍(t=12.86,P<0.01)。H1975细胞转染miR-17 mimic后,其miR-17的表达水平是阴性对照组的47.3倍(t=6.07,P<0.01);H1975R细胞转染miR-17 inhibitor后,其miR-17表达水平是阴性对照组的0.37倍(t=9.15,P<0.01)(图2)。
2.3 转染后细胞克隆形成实验
根据克隆形成实验通过多靶单击数学模型拟合细胞存活曲线,H1975 miR-17 mimic组的D0、Dq和SF2分别是阴性对照组的1.09倍、1.96倍和1.47倍,而H1975 miR-17 inhibitor组的D0、Dq和SF2分别是阴性对照组的0.85倍、0.64倍和0.75倍,差异均有统计学意义(P<0.05)。这表明了上调miR-17提高了H1975的放射抗性,下调miR-17则可提高H1975R的放射敏感性(图3)。
2.4 转染后细胞增殖能力
转染后细胞的增殖规律与阴性对照组大致相同。采用重复测量设计的方差分析,H1975转染miR-17 mimic后,即上调H1975细胞中的miR-17表达,其增殖能力显著增强,在不同时间点间的差异也有统计学意义(P<0.001)。同样地,H1975R转染miR-17 inhibitor后,即下调H1975R细胞中的miR-17表达,其增殖能力显著降低,在不同时间点间的差异也有统计学意义(P<0.001)。这表明上调miR-17表达促进细胞增殖,反之,下调miR-17表达抑制细胞增殖(图4)。

图2 PCR检测miR-17表达情况Figure 2 The expression of miR-17 in H1975 and H1975R cells by qRT-PCRNote:A.The results of qRT-PCR showed the expression of miR-17 in H1975 and H1975R;B.The results of qRT-PCR showed overexpression of miR-17 in H1975;C.The results of qRT-PCR showed downregulation of miR-17 in H1975R.** P<0.01,when compared with the control group.

图3 H1975和H1975R转染后细胞的存活曲线Figure 3 The curves of cell viability in H1975 and H1975R cells after transfectionNote:A.H1975 cell that transfect miR-17 mimic showed a curve of cell viability;B.H1975R cell that transfect miR-17 inhibitor showed a curve of cell viability.
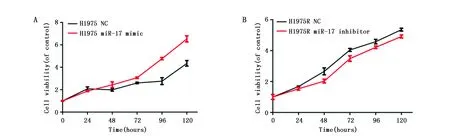
图4 H1975和H1975R转染后细胞增殖情况Figure 4 The proliferation of H1975 and H1975R cells after transfectionNote:A.The cell viability of H1975 that transfect miR-17 mimic was measured by CCK-8 assay;B.The cell viability of H1975R that transfect miR-17 inhibitor was measured by CCK-8 assay.
2.5 转染后细胞凋亡情况
本研究流式细胞仪检测转染后细胞的凋亡情况。H1975转染miR-17 mimic后,其凋亡率(9.66±0.27%)低于阴性对照组(13.43±0.45%)(t=12.49,P<0.01);H1975R转染miR-17 inhibitor后,其凋亡率(13.77±0.78%)高于阴性对照组(11.7±0.37%)(t=4.16,P<0.05)。由此可知上调miR-17抑制细胞凋亡,而下调miR-17则促进细胞凋亡(图5)。
2.6 转染后细胞周期分布
H1975转染miR-17 mimic后,G1期细胞比例(54.56±0.67%)低于阴性对照组(60.90±0.57%)(t=10.95,P<0.01),G2/M细胞比例(31.57±0.35%)高于阴性对照组(25.45±0.08%)(t=23.28,P<0.01)。H1975R转染miR-17 inhibitor后,G1期细胞比例(64.18±0.48%)高于阴性对照组(52.65±0.69%)(t=16.90,P<0.01),G2/M细胞比例(25.57±1.37%)低于阴性对照组(32.12±0.20%)(t=6.37,P<0.01)。这表明了miR-17通过影响细胞周期再分布参与肺癌细胞放射抗性的调控(图6)。
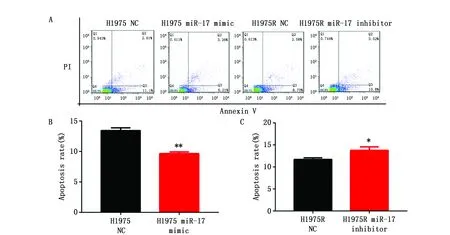
图5 H1975和H1975R转染后细胞凋亡情况Figure 5 The apoptotic rates of H1975 and H1975R cells after transfectionNote:A.A representative image of apoptosis was detected by flow cytometry(FCM);B.H1975 cells that transfected miR-17 mimic demontrates an induced apoptotic rate;C.H1975R cells that transfected miR-17 inhibitor demontrate an increased apoptotic rate.* P<0.05,**P<0.01,when compared with the control group.
图6 H1975和H1975R转染后细胞周期分布情况Figure 6 The distribution of cell cycle in H1975 and H1975R cells after transfectionNote:A.A representative image of cell cycle distribution was detected by flow cytometry(FCM);B.The cell cycle of H1975 that transfected miR-17 mimic was measured by FCM;C.The cell cycle of H1975R that transfected miR-17 inhibitor was measured by FCM.* P<0.05,** P<0.01,when compared with the control group.
3 讨论
放射治疗在肺癌治疗中扮演不可或缺的角色,然而放射抗拒是放疗过程中出现的最棘手的问题,严重影响放疗疗效,往往是导致肺癌患者治疗失败的重要原因[12]。因此,体外建立肺癌放射抗拒细胞系是研究放射抗拒的首要任务,目前常见建立方法有常规剂量和高剂量连续照射。常规剂量照射诱导方法认为放射抗拒的细胞亚群是经过常规剂量连续照射后突变而形成[13];高剂量照射诱导方法则认为肿瘤细胞本身存在不同放射敏感性的细胞亚群,经过高剂量连续照射后,只有放射抗拒性强的细胞才能存活下来[14]。
本研究所采用的梯度剂量照射诱导方法,实质上是综合上述两种方法的优点,既有低剂量照射诱导突变,又有高剂量照射筛选,实现高效建立放射抗拒模型。细胞放射敏感性通常采用克隆形成实验进行验证,并通过多靶单击模型拟合细胞存活曲线,获得各项放射生物学参数,其中D0、Dq和SF2越大,代表放射抗拒性越强,对射线越不敏感[15]。我们的结果显示,H1975R的D0、Dq和SF2均比H1975大,表明了本研究所得到的细胞亚群H1975R的放射抗拒性明显比亲本细胞强。Lou等[5]通过连续X线诱导照射成功建立乳腺癌放射抗拒细胞MCF-7R和T-47DR,以及Li等[7]用同样的方法成功建立鼻咽癌放射抗拒细胞CNE-2-Rs,它们的D0、Dq和SF2均比亲本细胞大,与本研究的结果相似。由此表明,我们也成功建立了肺癌放射抗拒细胞H1975R,为后续研究其放射抗拒机制提供必备的实验工具。
近年来不少证据表明miRNA的失调与肿瘤细胞的发生、复发及远处转移有密切相关[16]。有研究表明miR-17参与肿瘤放射抗拒的调控,Jiang等[11]通过上调套细胞淋巴瘤Z138c细胞的miR-17表达明显提高了其耐放射的能力,而Wu等[17]下调口腔癌OC3细胞的miR-17表达大大增强了其放射敏感性。然而miR-17是否参与肺癌放射抗拒的调控不得而知。本研究PCR结果提示肺癌放射抗拒细胞H1975R的miR-17表达量显著高于亲本细胞。为进一步探究miR-17在肺癌放射抗拒中的作用,我们通过下调放射抗拒细胞系H1975R的miR-17的表达,从克隆形成实验结果可知,其D0、Dq和SF2均减小,意味着其放射敏感性升高;相反地,通过上调亲本细胞系H1975的miR-17的表达,其耐放射能力得到提高,与Jiang等[11]和Wu等[17]的研究结论相吻合。因此,我们认为miR-17表达升高是导致肺癌放射抗拒的重要因素。此外,本研究的增殖结果表明上调miR-17表达促进肺癌细胞增殖。Hayashita等[18]也发现miR-17-92促进小细胞肺癌细胞增殖,与本研究结论一致。细胞凋亡是肿瘤细胞受照射后的主要死亡方式,其凋亡率越高,放射敏感性越强[19]。我们通过下调肺癌细胞miR-17表达后,其凋亡率升高,意味其放射敏感性会相应升高,与我们的克隆形成实验结果相符。Yao等[20]在肺癌细胞中也发现细胞放射敏感性与凋亡率呈正相关。细胞周期紊乱是肿瘤细胞恶化和无限增殖的原因之一[3]。我们下调放射抗拒细胞H1975R的miR-17表达后,G1期比例升高,G2/M期比例下降,反之则得到相反结论。Wu等[17]同样通过下调口腔癌OC3细胞的miR-17表达后,细胞周期变化规律与我们的结论相一致。G1期细胞减少,而G2/M期细胞增多,意味着miR-17促使更多细胞进入分裂状态,促进细胞增殖,抑制细胞凋亡,提高了肿瘤细胞的恶性程度和对抗治疗能力,这与我们的细胞增殖、凋亡结果和克隆形成实验结论相吻合。
综上所述,本研究推测miR-17可通过促进细胞增殖,抑制细胞凋亡,调控细胞周期再分布,从而使肺癌细胞获得更强的耐放射能力。但究竟miR-17在肺癌细胞中具体的调控方式还有待进一步探讨。miR-17在肺癌细胞放射抗拒中发挥重要的作用,有望为肺癌放疗疗效的预测及放射抗拒的分子靶向治疗提供新的策略。
