Leptin、VEGF及不同麻醉方式对子宫内膜癌患者预后生存的影响
2018-10-24李美艳陈永学侯俊德
李美艳 陈永学 侯俊德
子宫内膜癌(Endometrial carcinoma,EC)是女性生殖道最常见恶性肿瘤之一,对女性健康造成极大威胁[1]。EC一经诊断,手术切除仍然是EC治疗的首选,目前多采用腹腔镜下全子宫切除+双附件切除+盆腔淋巴结切除术。术中麻醉可导致EC患者血流动力学异常,因而合适的麻醉方式有望减少手术过程中的不良反应及改善患者预后。肥胖作为子宫内膜癌的“三联征”之一,与EC发生密切相关,瘦素(Leptin)作为重要的脂肪因子扮演着重要的角色[2]。血管内皮生长因子(Vascular endothelial growth factor,VEGF),可促进内皮细胞的活化与迁移,是一种重要的促血管生成蛋白[3]。Leptin、VEGF的表达均对EC等肿瘤的预后判断提供重要思路,本文分析Leptin、VEGF及不同麻醉方式在治疗临床预后的影响,给今后的临床治疗EC提供理论依据。
1 资料与方法
1.1 一般资料
回顾性分析2012年1月—2013年11月期间的河北省邯郸市中心医院有关子宫内膜的病历资料共345例:经病理检查为EC并进行了手术治疗的患者197例、不典型增生患者85例、正常子宫内膜患者63例,收集患者资料包括年龄、手术病理分期、组织学分级、肌层浸润深度、组织学类型、淋巴结转移、麻醉方式和EC术后随访的预后生存数据等。
选取样本中EC患者年龄范围24~72岁,平均年龄50.19±9.54岁。按照50岁分组:≥50岁104例,<50岁93例;根据国际妇产科联盟(FIGO 2009)手术病理分期标准:Ⅰ~Ⅱ期170例,Ⅲ~Ⅳ期27例;组织学分级:G1~G2为144例,G3为53例;肌层浸润深度:≥1/2肌层51例,<1/2肌层146例;按组织学类型分型:Ⅰ型155例,Ⅱ型42例;术后证实是否有淋巴结转移:有转移25例,无转移172例。实验标本均来自于诊刮及手术切除子宫的内膜标本,排除有心、脑、肾重要器官功能障碍、凝血系统障碍、出血疾病者,且就诊前均未行放射、化学治疗,EC患者均为初次手术且肿瘤均为原发。
1.2 麻醉方式
197例EC患者按照采用的麻醉方式进行分组,方式A:采取连续硬膜外阻滞+静吸复合全身麻醉99例;方式B:采取静吸复合全身麻醉98例。具体麻醉过程如下:两组患者进入手术室后均进行常规监测无创血压、心电图、脉搏氧饱和度及脑电双频指数(BIS),并建立左上肢静脉通道。方式A入室后先进行L1~2硬膜外穿刺并置管,予1.5%利多卡因注射液5 mL试验剂量,测出麻醉平面后,再静脉快速诱导插管,术中硬膜外每小时注入1%利多卡因注射液5 mL,全麻药物使用同方式B。患者术中BIS值范围为45~55,根据需要补液,必要时可使用血管活性药维持循环稳定。方式B麻醉诱导:依次静脉注射咪唑安定注射液(0.05~0.1)mg/kg、芬太尼4 μg/kg,0.15 mg/kg顺式阿曲库铵,以及丙泊酚1 mg/kg;待肌松完善后,可视插入气管导管,术中使用间歇正压通气(Intermittent positive pressure ventilation,IPPV)保持呼吸,持续静脉泵注丙泊酚及瑞芬太尼,同时持续吸入七氟醚。
1.3 实验方法和结果判定
采用免疫组织化学SP法检测Leptin和VEGF蛋白的表达情况,兔抗体Leptin多克隆抗体购自北京中山生物技术有限公司,鼠抗人VEGF单克隆抗体、免疫组织化学SP试剂盒、PBS缓冲液、DAB试剂盒均购自福州迈新生物技术公司,各实验步骤均严格按相应试剂的说明书进行操作。免疫组化SP法步骤和判定评分标准参见文献[4],Leptin蛋白阳性细胞染色为细胞质中出现棕黄色或黄色颗粒;VEGF蛋白阳性染色大多数定位于癌细胞胞浆或胞膜中,阳性着色呈淡黄色至棕黄色颗粒。
1.4 术后随访
手术结束后通过复查记录、微信、电话等方式对197例EC患者进行按期随访,每3个月随访1次,随访内容主要记录患者的生存状态及死亡原因。手术时间即为生存起始时间,患者术后死亡为终止时间,末次随访时间为2017年12月31日。随访率98.48%(194/197),中位生存期28.00个月(95%CI:28.92,33.11)。
1.5 统计学处理
采用统计软件IBM SPSS StatisticsVersion 19.0对数据进行计算处理,计数资料以率表示,组间比较采用χ2检验,用Pearson法和连续校正公式计算χ2值。生存分析中将年龄处理为分类变量,采用Kaplan-Meier法和Log-rank来检验评价各因素与EC患者生存时间的关系,用Cox风险模型进行多因素分析,回归方法选择Enter法(年龄处理为均值为界的分类变量),P<0.05为差异有统计学意义。
2 结果
2.1 Leptin、VEGF在各组内膜组织中的表达情况
免疫组化SP法染色结果提示(图1~2),子宫内膜癌组Leptin阳性155例,阴性42例;VEGF阳性134例,阴性63例。子宫内膜癌组Leptin、VEGF蛋白的阳性表达率高于不典型增生组和正常子宫内膜组,差异均有统计学意义(P<0.05)(表1)。
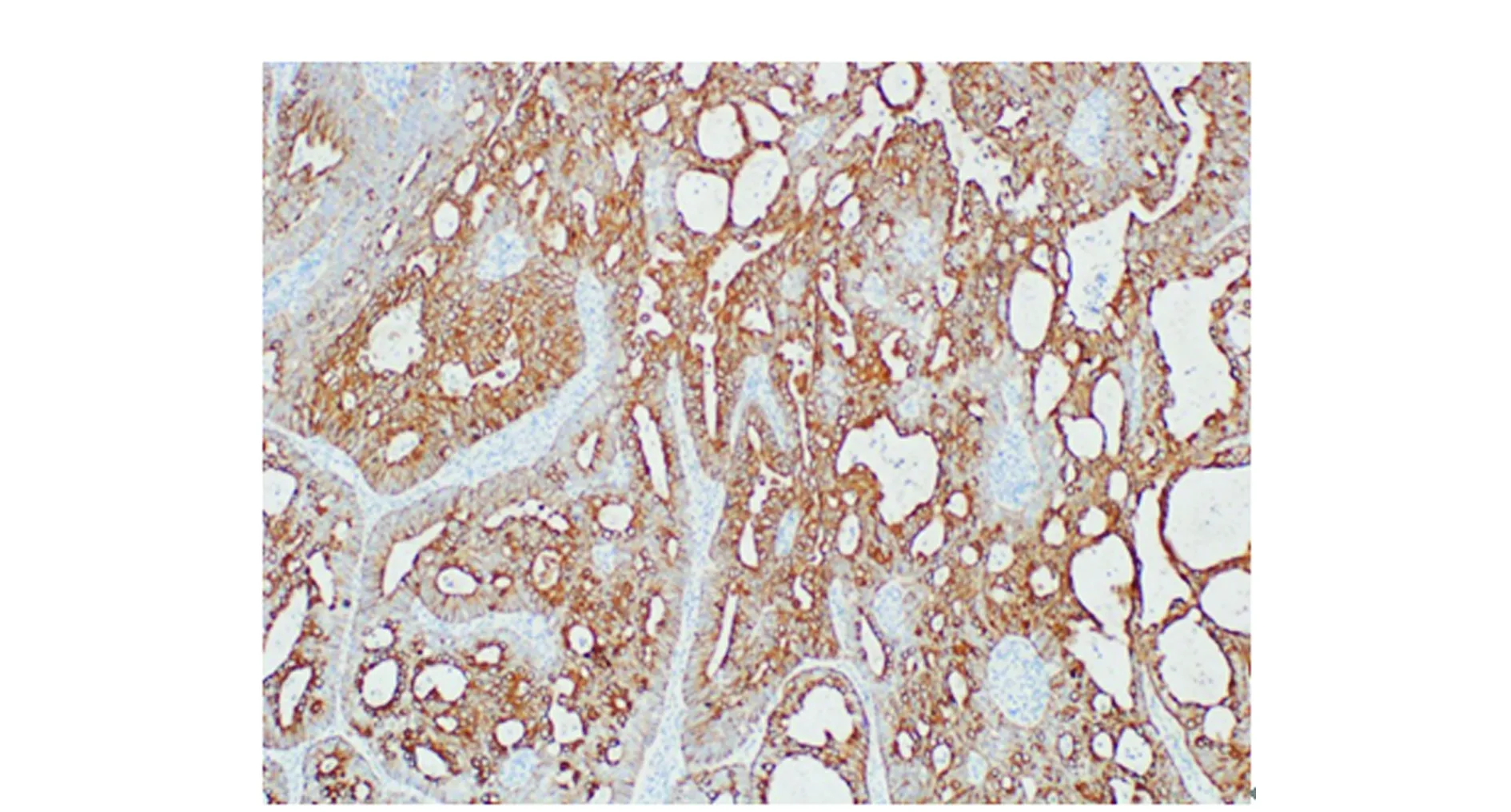
图1 Leptin蛋白在低分化子宫内膜癌中的表达(SP法200×)Figure 1 Expression of Leptin protein in low differentiated endometrial carcinoma(SP method 200×)

图2 VEGF蛋白在低分化子宫内膜癌中的表达(SP法200×)Figure 2 Expression of VEGF protein in low differentiated endometrial carcinoma(SP method 200×)

GroupsCasesLeptin-++++++Positive rate(%)VEGF-++++++Positive rate(%)Normal endometrium632730429.523426214.76Atypical hyperplasia852829151332.94*323581021.18*EC1972517668978.68#△3627567868.02#△χ2113.883102.916P<0.001<0.001
Note:*Compared with normal endometrium group,#Compared with normal endometrium group,△Compared with atypical hyperplasia group;Leptin*:χ2=11.213,P=0.001;#:χ2=96.824,P<0.001;△:χ2=54.528,P<0.001;VEGF*:χ2=8.007,P=0.005;#:χ2=76.629,P<0.001;△:χ2=54.439,P<0.001.
2.2 不同麻醉方式、Leptin和VEGF表达对EC中的预后生存影响分析
2.2.1 EC预后影响单因素分析 手术病理分期、组织学分级、淋巴结转移、麻醉方式、Leptin阳性和VEGF表达阳性6项因素与EC患者的预后有关,差异均有统计学意义(P<0.05),而年龄、肌层浸润及组织学类型则与EC患者的生存期无关(P>0.05)(表2,图3-5)。
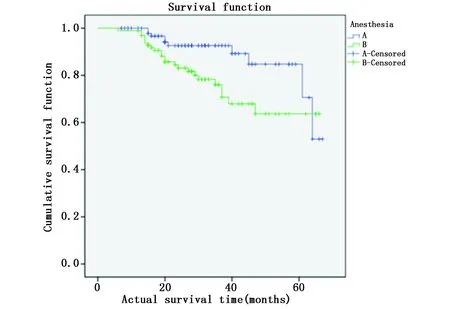
图3 不同麻醉方式下的生存曲线Figure 3 Survival curves of different anesthetic methods
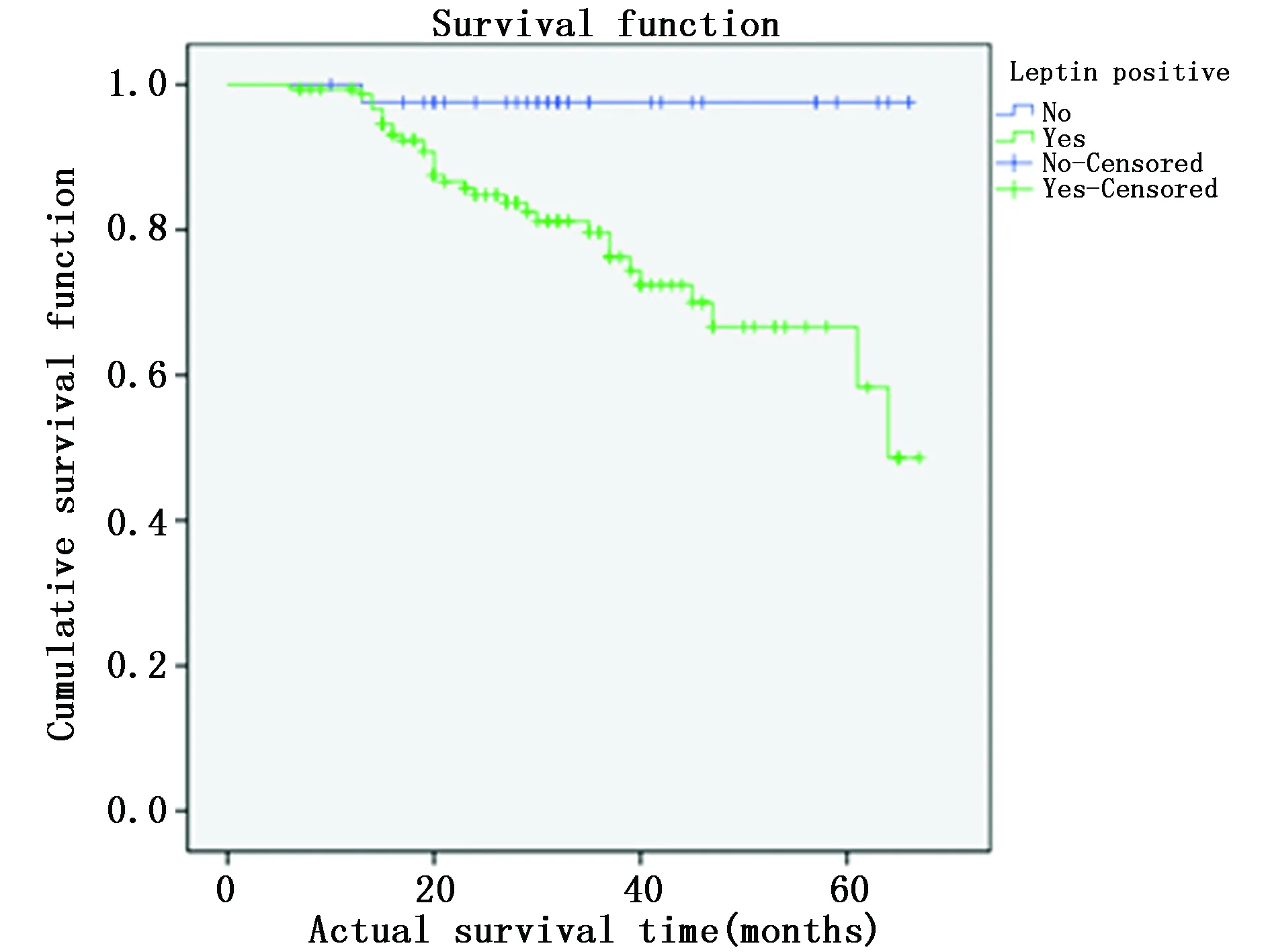
图4 Leptin表达情况的生存曲线Figure 4 Survival curve of Leptin expression
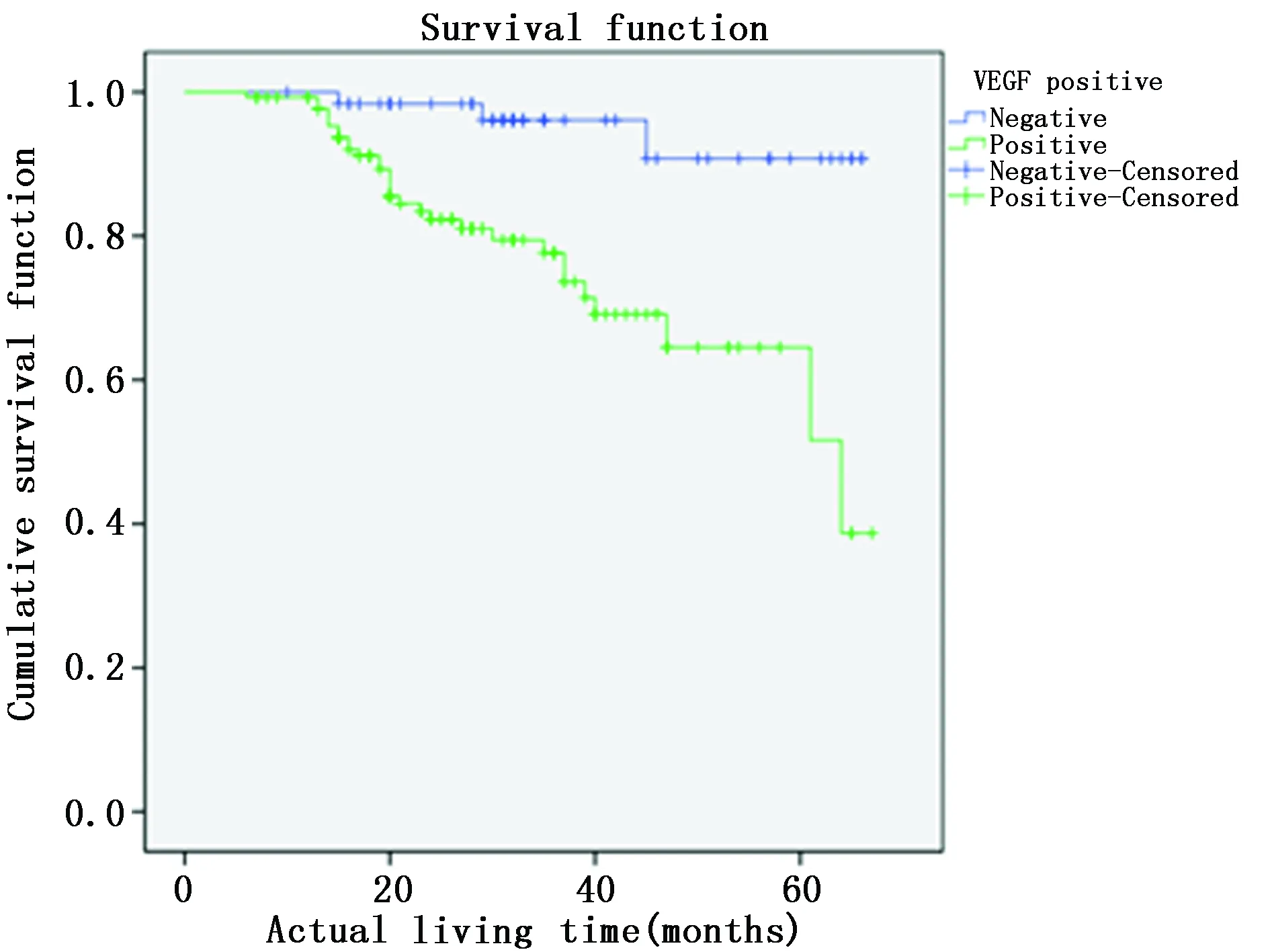
图5 VEGF表达情况的生存曲线Figure 5 Survival curve of VEGF expression
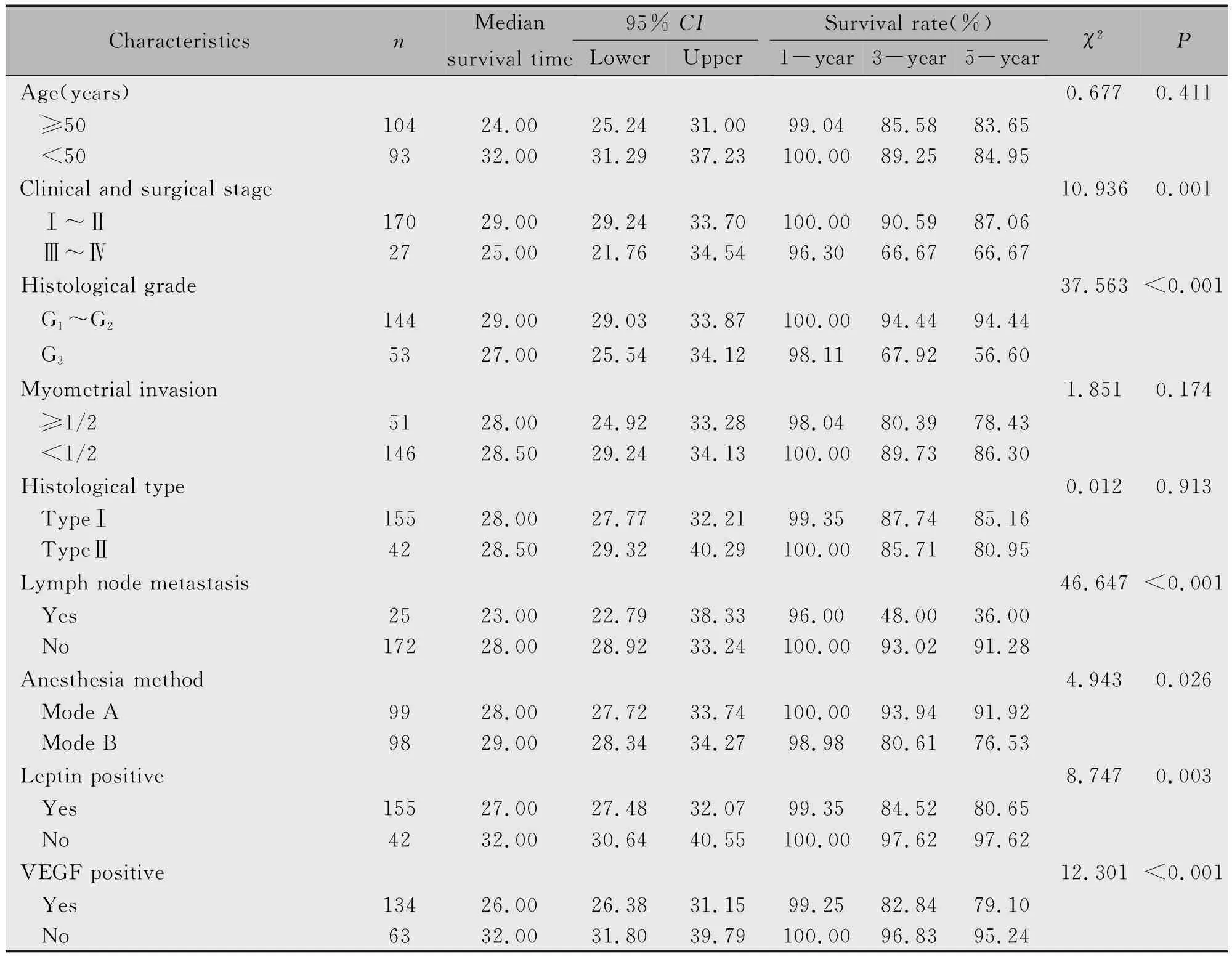
CharacteristicsnMediansurvival time95% CILowerUpperSurvival rate(%)1-year3-year5-yearχ2PAge(years)0.6770.411≥5010424.0025.2431.0099.0485.5883.65<509332.0031.2937.23100.0089.2584.95Clinical and surgical stage10.9360.001Ⅰ~Ⅱ17029.0029.2433.70100.0090.5987.06Ⅲ~Ⅳ2725.0021.7634.5496.3066.6766.67Histological grade37.563<0.001G1~G214429.0029.0333.87100.0094.4494.44G35327.0025.5434.1298.1167.9256.60Myometrial invasion1.8510.174≥1/25128.0024.9233.2898.0480.3978.43<1/214628.5029.2434.13100.0089.7386.30Histological type0.0120.913TypeⅠ15528.0027.7732.2199.3587.7485.16TypeⅡ4228.5029.3240.29100.0085.7180.95Lymph node metastasis46.647<0.001Yes2523.0022.7938.3396.0048.0036.00No17228.0028.9233.24100.0093.0291.28Anesthesia method4.9430.026Mode A9928.0027.7233.74100.0093.9491.92Mode B9829.0028.3434.2798.9880.6176.53Leptin positive8.7470.003Yes15527.0027.4832.0799.3584.5280.65No4232.0030.6440.55100.0097.6297.62VEGF positive12.301<0.001Yes13426.0026.3831.1599.2582.8479.10No6332.0031.8039.79100.0096.8395.24
2.2.2 EC预后影响Cox多因素分析 对于手术麻醉方式、Leptin和VEGF蛋白以及各临床病理因素进行Cox多因素生存分析,分析结果显示,影响EC手术预后的显著因素分别为:组织学分级、手术病理分期、VEGF阳性、淋巴结转移。197例观察数据Cox模型分析结果见表3。
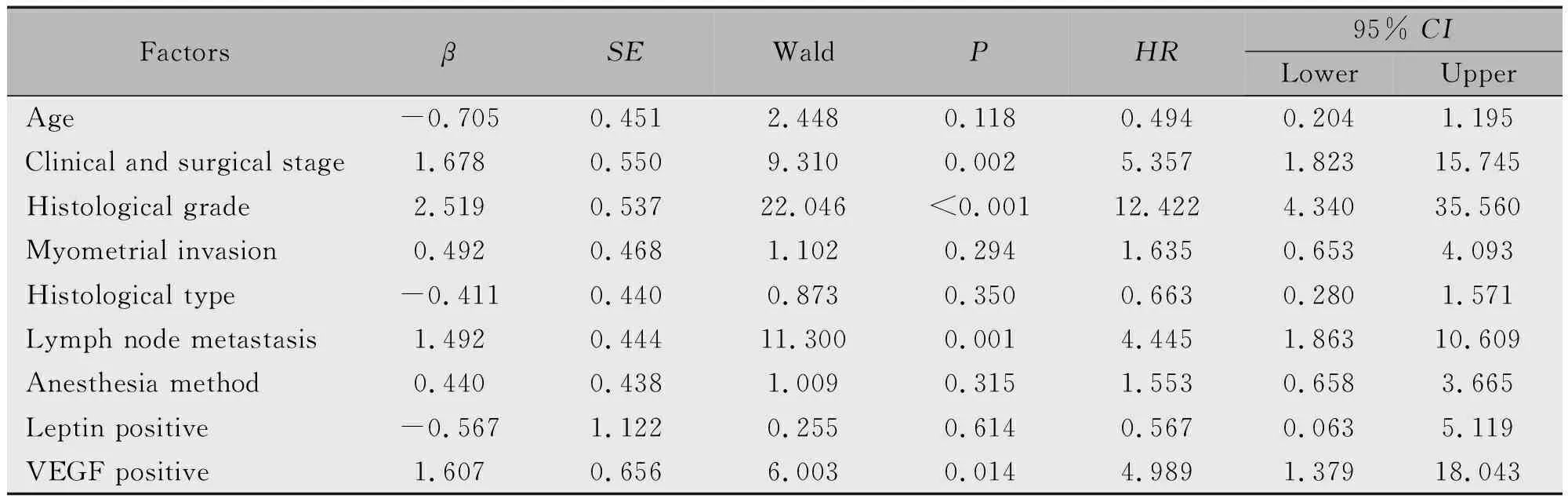
表3 EC患者预后Cox多因素分析
3 讨论
EC手术麻醉方式很多,过去临床主要采用连续硬膜外腔阻滞麻醉,现在逐渐转变为静吸复合全身麻醉、连续硬膜外阻滞+静吸复合全身麻醉为主。麻醉方式不同,手术刺激引起的应激反应程度亦不同。本研究旨在探讨EC手术预后的影响因素及不同麻醉方式与EC术后生存率的关系,及其对EC肿瘤患者术后转归的影响。
报道提出[5],全身麻醉手术患者可耐受各种体位,方便监测,能充分发挥EC患者的生理调控作用,相对安全可靠,与腰麻相比,全身麻醉更有利于患者康复。在影响EC患者预后生存方面,因EC手术主要在患者的下腹部及会阴部进行操作,对麻醉方式、药物的要求严格,必须具有充分的镇痛及肌肉松弛作用,使骶神经阻滞完全。
本研究结果显示,静吸复合全身麻醉(方式B)的EC患者1年、3年和5年生存率分别为98.98%、80.61%和76.53%,平均生存期为52.10个月,明显低于连续硬膜外阻滞+静吸复合全身麻醉(方式A)的患者的100.00%、93.94%、91.92%和平均生存期的60.12个月,在Kaplan-Meier生存曲线中亦可见,麻醉方式为A的EC患者的生存曲线明显高于麻醉方式为B的EC患者,Log-rank检验表明两组生存差异有统计学意义。提示连续硬膜外阻滞+静吸复合全身麻醉与静吸复合全身麻醉方式相比,前者更有利于EC患者术后康复,预后较好。可认为,方式A连续硬膜外阻滞+静吸复合全身麻醉更适合EC手术治疗,更有利于EC肿瘤患者术后恢复。
Leptin是一种分泌型蛋白质,是第一个被发现的脂肪细胞分泌的激素,Leptin作为肥胖基因编码的产物,与妇科肿瘤、前列腺癌、胃癌等多种肿瘤的发生相关[6]。有研究表明[7],Leptin的表达在恶性肿瘤的发病过程中扮演着重要角色。近年临床流行病学研究发现,Leptin通过多种机制参与EC的发生,高Leptin水平和EC发病风险密切相关[2,8]。Zhang等[9]对80例EC和50例正常子宫内膜组织标本研究发现,EC中Leptin的阳性表达明显较高。本研究子宫内膜癌组Leptin蛋白染色结果显示,Leptin阳性155例(78.68%),Leptin阴性42例(21.32%),而在不典型增生子宫内膜和正常子宫内膜中分别仅为32.94%和9.52%,说明子宫内膜癌组Leptin蛋白表达阳性率显著增高,子宫内膜癌组较其他组差异有统计学意义。这提示高Leptin表达水平可能促进EC的发生发展,Leptin可能促进肿瘤增殖和抑制细胞凋亡。
对EC等肿瘤预后生存的影响方面,Ma等[2]研究指出,高Leptin水平是EC发病一独立危险因素,能促进EC的发生发展,临床上可能作为明确EC高危人群、实施早期干预及预防EC有意义的检测指标。国外Luhn等[10]研究显示,Leptin与EC的发生风险呈正相关。本研究结果显示,Leptin阳性的EC患者1年、3年和5年生存率分别为99.35%、84.52%和80.65%,明显低于Leptin表达阴性患者相应参数,Leptin阳性组患者的生存曲线明显低于Leptin阴性组,Log-rank检验表明两组生存差异有统计学意义。提示Leptin可能是EC的一个危险因素,影响EC的预后。
VEGF是一种具有较强促进血管内皮细胞分裂的因子,可促进细胞的活化与迁移。近期Mirzaei Bavil等[11]研究发现,EC组织中VEGF表达明显高于子宫内膜不典型增生、正常子宫内膜患者,VEGF能刺激肿瘤血管生长,增加血管通透。本实验VEGF蛋白表达检测结果显示,197例EC患者中VEGF表达阳性134例(68.02%),阴性63例(31.98%),而在不典型增生子宫内膜和正常子宫内膜中分别仅为21.18%和4.76%,VEGF在EC组较其他组表达差异有统计学意义,提示VEGF的高表达和EC的形成发展过程密切相关。
对EC等肿瘤预后生存的影响,有研究表明VEGF高水平可预测患者的不良预后,其高表达可视为影响病人预后的不利因素[12]。VEGF在肿瘤疗效评估和预后判断方面均有积极意义[3]。本研究结果显示,VEGF阳性表达的EC患者1年、3年和5年生存率分别为99.25%、82.84%和79.10%,明显低于VEGF阴性表达患者的100.00%、96.83%和95.24%,VEGF阳性组患者的生存曲线也明显低于VEGF阴性组,Log-rank检验显示VEGF表达阳性与阴性患者的生存差异有统计学意义。提示VEGF阳性表达可作为EC预后不良的生物学标志之一。
应用Cox风险比例模型提示,影响EC患者预后的因素有:手术病理分期、组织学分级、淋巴结转移和VEGF阳性。本研究数据中Ⅲ~Ⅳ期的死亡危险度是Ⅰ~Ⅱ期的5.357倍,分期愈晚,预后愈差;组织学分级G3者死亡危险度是G1~G2者的12.422倍,组织学分级越高,预后越差;有淋巴结转移者死亡危险度是无淋巴结转移者的1.863倍,预后相对也较差。VEGF阳性的死亡风险是阴性者的4.989倍,VEGF表达阳性者,EC手术预后也更差。因此,可以认为手术病理分期、组织学分级、淋巴结转移和VEGF阳性是影响EC手术预后的风险因素,可作为预测EC预后的指标之一。
Cox多因素分析显示对EC预后有不利影响的4个因素,与单因素分析结果一致,再次表明其均为影响EC的负性预后因子之一。但Kaplan-Meier分析中,麻醉方式、Leptin阳性表达作为预后影响因素之一,而在多因素分析未能入选,这一结果可能是由于多因素分析是多种因素对预后结局的综合作用,这种相互作用引起二者对EC预后的作用可能体现不出来或是通过别的相关因素体现了,Leptin与VEGF的正相关性可能就是一个解释。但麻醉方式、Leptin阳性表达在单因素分析时显著,提示Leptin阳性表达的影响也应予以注意。下一步有必要在诊断治疗过程中收集更多的病例,展开EC预后整体影响更加深入的研究。
综上所述,本研究表明Leptin和VEGF蛋白在EC中的表达与正常组和不典型增生组差异均有统计学意义,二者表达呈正相关,具有正向协同作用。实验结果综合提示不同麻醉方式、Leptin和VEGF蛋白可预估EC患者的预后,均可用于指导EC肿瘤临床工作,对EC肿瘤患者术后转归具有较重要临床意义。
