蒿鳖养阴软坚方对TGF-β1诱导的肝纤维化的作用
2018-10-24唐诗慧方步武
唐诗慧,张 丽,方步武
(天津医科大学药理学系,天津300070)
肝纤维化是细胞外基质过度沉积的动态进行性过程,是由多种慢性肝病共同作用的结果,其发病率在全世界范围内呈现不断上升的趋势[1]。肝星状细胞(hepatic stellate cells,HSCs)活化并增殖,导致细胞外基质(extracellular matrix,ECM)合成与降解失衡并最终导致肝纤维化[2]。转化生长因子(transforming growth factor-β,TGF-β1) 是介导肝纤维化最重要的细胞因子,与细胞外基质的代谢和肝纤维化的发生发展有着密切的关系[3]。TGF-β1对HSCs的激活、增殖、转化具有极其重要的意义,是最强的促纤维化细胞因子[4]。本实验采用的蒿鳖养阴软坚方是由青蒿、鳖甲、知母、白花蛇舌草、虎杖、大黄等九味中药组成,此中药复方配伍有良好的益气活血、清热利湿、软坚散结功效,对治疗慢性肝病、肝纤维化有良好的疗效[5]。本课题组前期工作已证明蒿鳖养阴软坚方先水后醇(60%)提取方案对LX-2细胞具有良好的抑制作用,本实验进一步优化复方提取工艺。以TGF-β1刺激LX-2细胞,给予蒿鳖养阴软坚方治疗,初步探讨进一步优化提取工艺后的蒿鳖养阴软坚方对LX-2细胞的影响,旨在揭示蒿鳖养阴软坚方抗纤维化的药物作用机制。
1 材料与方法
1.1 实验材料
1.1.1 细胞株LX-2细胞株由北京地坛医院提供。
1.1.2 主要试剂 Recombinant Human TGF-beta1-Mammalian购于美国PeproTech公司,产品编号100-21-10。Anti-α-Smooth Muscle Actin antibody购于美国Cell Signaling Technology公司,产品编号19245T。Rabbit Anti-Collagen I antibody购于北京博奥森生物技术有限公司,产品编号:bs-0578R。BCA蛋白浓度测定试剂盒(增强型)购于江苏碧云天生物技术研究所,产品编号:P10010。Anti-β-actin、山羊抗兔抗体、LDH试剂盒以及ECL化学发光试剂盒购自碧云天生物技术有限公司。DMEM以及胎牛血清均购于美国Gibco公司。
1.1.3 主要仪器 680酶标仪(美国BIO-RAD公司),CO2恒温培养箱(美国 NAPCO series5400),DL-CJ-2NDI洁净工作台(北京东联哈尔仪器制造公司),WD-9405A型脱色摇床(北京六一仪器厂),湘仪L420低速自动平衡离心机(湖南湘仪离心机仪器有限公司),垂直电泳槽(美国BIO-RAD公司)。
1.2 实验方法
1.2.1 细胞培养及分组处理 从液氮中取出细胞并复苏,将细胞置于含有10%胎牛血清和1%双抗的DMEM中,置于37℃,5%CO2饱和湿度培养箱中进行细胞培养。细胞密度长至培养瓶底90%时,弃去培养液,PBS冲洗3次,加入1 mL 0.25%胰酶,消化1 min,离心后按照1:3的比例进行传代,取对数期细胞进行后续实验。本实验分成5组,分别为(1)control组:细胞对照组;(2)TGF-β1 刺激组(2 ng/mL),作用24 h;(3)不同浓度蒿鳖养阴软坚方处理组(0.5、1、2 mg/mL),作用 24 h。
1.2.2 复方提取 将鳖甲、青蒿、地黄等九味中药按照特定比例称取,复方总重141.6 g。先将鳖甲用840 mL三蒸水在微沸状态下回流提取2 h,加入其它剩余药材浸泡2 h,然后在微沸状态下再回流提取1 h,收集水提取液。840 mL的95%乙醇继续回流提取2次,每次0.5 h,收集醇提取液,并与水提取液混合后旋蒸浓缩,浓缩液冷冻干燥至恒重,备用。
1.2.3 MTT比色法检测LX-2细胞增殖情况 取处于对数期的LX-2细胞接种于96孔板中,根据细胞实验设计分别对每组细胞进行处理,每组设5个副孔。24 h后,每孔加入20 μL MTT,混匀后放回培养箱中继续孵育4 h,弃去培养液,每孔加入20 μL DMSO,振荡10 min,在490 nm处测定各孔吸光度值(A值),计算细胞抑制率(inhibition rate,IR)。抑制率计算公式:抑制率(%)=[(对照组吸光度值-实验组吸光度值)/对照组吸光度值]×100%。
1.2.4 细胞培养液中Hyp含量测定 根据实验设计处理后,收集96孔板中细胞培养液。空白管中加入0.5 mL双蒸水,标准管中加入0.5 mL标准液,每个测定管中加入0.5 mL的待测样本,所有管中加入0.05 mL的消化液,混匀,37℃水浴3h。所有管加入试剂盒中试剂一0.5mL室温静置10min,试剂二0.5 mL室温静置5 min,试剂三1 mL 60℃水浴15 min,流水冷却后3 500 r/min,离心10 min,取上清在550 nm处测定各管吸光度。羟脯氨酸含量(μg/mL)=(测定OD值-空白OD值/标准OD值-空白OD值)×标准品浓度(5 μg/mL)×样品测试前稀释倍数。
1.2.5 细胞培养液中LDH活性测定 根据实验设计处理后,收集细胞培养液备用。按照碧云天生物研究所乳酸脱氢酶细胞毒性检测试剂盒说明书进行操作。LDH活性=(样品孔吸光度-背景空白对照孔吸光度)/(标准管吸光度-标准空白管吸光度)×标准品浓度(mU/mL)。
1.2.6 Western blot法检测 collagen Ι、α-SMA 蛋白的表达 取对数期细胞以5×104个/mL单个细胞悬液接种于6孔板中,每孔2 mL。根据实验设计处理后,弃去培养液,PBS冲洗3遍,每孔加入80μLRIPA蛋白裂解液,冰浴条件下使其充分裂解提取细胞总蛋白并用BCA试剂盒测定蛋白浓度。蛋白变性后取20 μg蛋白上样,8%SDS-PAGE电泳分离蛋白,将蛋白转移至PVDF上,室温条件下5%的脱脂奶粉封闭2 h。4 ℃下摇床孵育一抗(collagen Ι 1∶500、α-SMA 1∶1000)过夜。次日,TBST洗膜3次,每次5min,室温下孵育二抗2 h。ECL化学发光试剂盒显色,采用Image J软件对蛋白条带的光密度值进行分析。
2 结果
2.1 蒿鳖养阴软坚方对LX-2细胞增殖的影响 与对照组相比,2 ng/mL的TGF-β1作用于细胞24 h,细胞明显增殖(P<0.05)。与 TGF-β1刺激组相比,不同浓度的蒿鳖养阴软坚方(药物终浓度为0.5、1、2 mg/mL)作用24 h后,对LX-2细胞增殖有明显的抑制作用(P<0.05),且随着浓度增大,抑制作用越明显,表现出一定程度的剂量依赖性(表1)。
表1 蒿鳖养阴软坚方对LX-2细胞增殖的影响(±s,n=5)Tab 1 Effects of HBYYRJF on the proliferation of LX-2 cells(±s,n=5)

表1 蒿鳖养阴软坚方对LX-2细胞增殖的影响(±s,n=5)Tab 1 Effects of HBYYRJF on the proliferation of LX-2 cells(±s,n=5)
与对照组比较,*P<0.01;与 TGF-β1 处理组比较,#P<0.05;与HBYYRJ(0.5 mg/mL)组比较,ΔP<0.05;与 HBYYRJ(1 mg/mL)组比较,◇P<0.05
组别/(mg/mL)对照组TGF-β1刺激组HBYYRJ 0.5 HBYYRJ1 HBYYRJ 2抑制率/%--15.59±0.97*21.11±0.86*#33.15±1.54#Δ 49.611±1.86#Δ◇
2.2 蒿鳖养阴软坚方对细胞培养液LDH活性的影响 不同浓度的蒿鳖养阴软坚方作用于LX-2细胞24 h后,与对照组相比,上清中LDH活性无明显改变,差异无统计学意义(P>0.05,表2、图 1)。
表2 蒿鳖养阴软坚方对细胞上清中LDH活性的影响(±s,n=3)Tab 2 Effects of HBYYRJ on the activity of LDH(±s,n=3)

表2 蒿鳖养阴软坚方对细胞上清中LDH活性的影响(±s,n=3)Tab 2 Effects of HBYYRJ on the activity of LDH(±s,n=3)
与对照组比较,*P>0.05
组别/(mg/mL)对照组HBYYRJ 0.5 HBYYRJ 1 HBYYRJ 2 LDH活性/mU/mL 0.09±0.009 0.095±0.015*0.103±0.019*0.101±0.018*
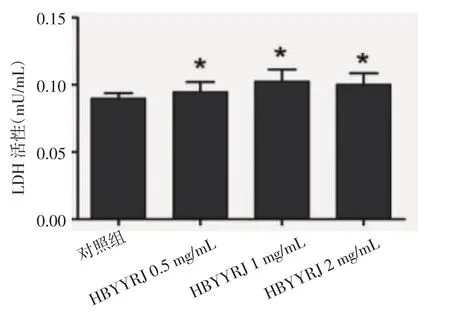
图1 蒿鳖养阴软坚方对细胞上清中LDH活性的影响(±s,n=3)Fig 1 Effects of HBYYRJ on the activity of LDH(±s,n=3)
2.3 蒿鳖养阴软坚方对细胞培养液Hyp含量的影响 不同浓度蒿鳖养阴软坚方作用于LX-2细胞24 h后,与模型组相比,各剂量组细胞上清液中羟脯氨酸含量明显降低,且剂量越大,羟脯氨酸含量越低,差异具有统计学意义(P<0.05,表3、图2)。
表3 蒿鳖养阴软坚方对Hyp含量的影响(±s,n=3)Tab 3 Effects of HBYYRJ on the content of Hyp(±s,n=3)

表3 蒿鳖养阴软坚方对Hyp含量的影响(±s,n=3)Tab 3 Effects of HBYYRJ on the content of Hyp(±s,n=3)
与对照组比较,*P<0.01;与 TGF-β1 刺激组比较,#P<0.05
组别/(mg/mL)对照组TGF-β1刺激组HBYYRJ 0.5 HBYYRJ 1 HBYYRJ 2 Hyp(μg/mL)1.34±0.15 2.10±0.31*1.69±0.13#1.56±0.14#1.50±0.18#

图2 蒿鳖养阴软坚方对Hyp含量的影响(±s,n=3)Fig 2 Effects of HBYYRJ on the content of Hyp(±s,n=3)
2.4 蒿鳖养阴软坚方对collagen Ι和α-SMA蛋白水平的影响 见图3、4。

图3 蒿鳖养阴软坚方对LX-2细胞collagenΙ表达的影响(±s,n=3)Fig 3 Effects of HBYYRJ on the expression level of collagen Ι(±s,n=3)

图4 蒿鳖养阴软坚方对LX-2细胞α-SMA表达的影响(±s,n=3)Fig 4 EffectsofHBYYRJontheexpressionlevelof α-SMA(±s,n=3)
3 讨论
肝纤维化大多发生在各种慢性肝损伤后,是肝脏对于各种慢性刺激损伤进行自我修复的病理过程。肝纤维化的过程是可逆的,但如果不控制肝纤维化任其发展,将会形成肝纤维结节及肝脏结构和功能异常,最终导致肝硬化甚至肝癌[6]。肝纤维化发生最为关键的一步是HSC的活化和增殖[7]。TGF-β1是目前已知最强的促肝纤维化细胞因子[8]。HSCs在TGF-β1的作用下活化增殖,并且促进细胞外基质Ⅰ型胶原和Ⅳ型胶原的产生进而使得肝纤维化进一步发生发展[9]。本实验应用蒿鳖养阴软坚方能显著抑制LX-2细胞的增殖,表明蒿鳖养阴软坚方可通过抑制LX-2细胞增殖发挥抗纤维化的作用。羟脯氨酸是胶原蛋白中特有的有效成分,肝纤维化时,活化的HSCs合成大量以胶原纤维为主的细胞外基质,测定培养液上清中羟脯氨酸含量可换算成HSCs产生胶原蛋白的含量,以反映肝纤维化的程度[10]。蒿鳖养阴软坚方能显著降低羟脯氨酸含量。α-SMA是HSCs活化的标志,在肝纤维化研究中被广泛应用,α-SMA的表达随着肝纤维化的加重而增加[11]。本实验通过测定LX-2细胞中α-SMA的表达来反映肝纤维化的程度。实验结果显示,蒿鳖养阴软坚方降低α-SMA蛋白水平,表明蒿鳖养阴软坚方能抑制LX-2细胞活化,从而发挥抗肝纤维化的作用。
中药在治疗肝纤维化方面有其独特的优势,中药复方多成分、多靶点的特点正好应对肝纤维化复杂的发病机制。蒿鳖养阴软坚方主要是由鳖甲、青蒿、地黄等九味中药构成,具有多种药理作用。本实验探究蒿鳖养阴软坚方对LX-2细胞增殖,细胞产生羟脯氨酸含量以及相关蛋白表达的影响,发现蒿鳖养阴软坚方具有良好的抗肝纤维化作用。
本研究结果显示,蒿鳖养阴软坚方通过抑制HSCs的激活增殖和细胞外基质的沉积减轻TGF-β1诱导的肝纤维化,为临床治疗肝纤维化提供了新的理论依据。
