吡非尼酮抑制肿瘤相关成纤维细胞促进结肠癌细胞系HT29上皮间质转化的作用及机制
2018-10-24马博昭王小东王金淼
马博昭,王小东,王金淼,戚 峰
(天津医科大学总医院普通外科,天津300052)
近年来肿瘤微环境在肿瘤发生发展中的关键作用被越来越多的人认识,肿瘤微环境由多种细胞成分构成,包括肿瘤相关成纤维细胞(cancer-associated fibroblasts,CAFs)、免疫细胞、内皮细胞及间充质细胞。在这种异质性环境中,CAFs是最主要的细胞,在肿瘤进展、侵袭及迁移过程中起着重要的作用[1]。有些研究认为CAFs在大多数的肿瘤中通过分泌多种细胞因子如TGF-β、IL-6等从而起到促进肿瘤发生发展的作用[2-3]。吡非尼酮(PFD)是一个有效的抗纤维化药物,很多研究已经证实,吡非尼酮可以改变成纤维细胞分泌的多种细胞因子及生长因子[4-7]。本研究旨在探讨吡非尼酮在结肠癌CAFs诱导的HT29结肠癌细胞系侵袭、增殖、上皮-间质转化(EMT)中的作用及机制,为结肠癌的治疗提供新的思路。
1 材料与方法
1.1 实验材料
1.1.1 材料 人结肠癌源性肿瘤相关成纤维细胞系(江苏齐氏生物公司),人结肠癌细胞系HT29(本实验室保存)。
1.1.2 主要试剂 CCK-8试剂盒(日本同仁化学研究所),吡非尼酮 (adamas-beta公司),2×RT MasterMix及总RNA提取试剂盒(天根生物科技(北京)有限公司);高容量cDNA反转录试剂盒和SYBR Select Master Mix(Invitrogen公司,美国);E-cadherin、Vimentin、β-actin 单克隆抗体和辣根过氧化物酶标记山羊抗兔抗体(Cell Signaling TechnologY,美国);Western blot发光液(Millipore公司,美国),TGF-β1、IL-6细胞因子 ELISA 试剂盒(北京达科为生物技术有限公司)。
1.2 研究方法
1.2.1 筛选药物浓度 结肠癌细胞系HT29以5×103个/孔接种于96孔板,吡非尼酮以0、0.25、0.5 mg/mL不同浓度分别培养HT29细胞,每组10个复孔,培养 72 h,加入 10 μL CCK8 溶液,37℃孵育 1 h,450nm处检测吸光度。
1.2.2 细胞培养 在以下几种条件下培养结肠癌细胞系HT29:含10%FBS的DMEM标准培养基培养(control);含 0.5 mg/mL吡非尼酮(PFD)培养基培养(PFD-CM);CAFs上清条件培养(CAF-CM);加入吡非尼酮(PFD)处理CAFs细胞后的条件培养(PFD-CAF-CM)。
1.2.3 CCK8实验 结肠癌细胞HT29以5×104个/孔接种于 24 孔板,Transwell上室以 1×104个/室接种CAF细胞。分为3个对照组:标准培养基培养(control),CAFs与 HT29 Transwell共培养 (CAF-CM);含0.5 mg/mL PFD的培养基CAFs与HT29 Transwell共培养(PFD-CAF-CM)。每组4个复孔,培养60 h,弃培养液,每孔加入10%CCK8溶液500 μL,37℃孵育40 min,每个复孔吸出100 μL置于96孔板,450 nm处检测吸光度。
1.2.4 Transwell实验
1.2.4.1 Transwell侵袭实验:Matrigel胶1:6稀释后以50 μL包被Transwell上室底部膜,在Transwell下室内加入含10%FBS细胞培养基600 μL,上室内加入各组细胞的无胎牛血清培养基悬浮液200 μL,上室内加入各组处理后的HT29细胞,细胞数为1×105,37℃培养24 h后,用棉签拭去Matrigel胶,将Transwell上室置于4%多聚甲醛固定,0.1%结晶紫染色10 min,倒置显微镜下计数移至微孔膜下层每视野的细胞数,随机计数5个高倍视野,求平均值。
1.2.4.2 Transwell迁移实验:在Transwell下室中加入含10%FBS的培养基600 μL,在上室中加入各组处理后的HT29细胞,细胞数目为1×105个/室,细胞悬液体积200 μL,37℃培养12 h,用棉签拭去小室上面细胞,将Transwell上室置于4%多聚甲醛固定,0.1%结晶紫染色10 min,倒置显微镜下计数移至微孔膜下层每视野的细胞数,随机计数5个高倍视野,求平均值。
1.2.5 ELISA 取生长状态良好的对数生长期细胞,按每孔3×104个细胞种于24孔板,置于37℃,待细胞贴壁后以 0、0.25、0.5、1.0、1.5 mg/mL 吡非尼酮浓度加药,每组3个复孔。提取细胞上清,采用ELISA法检测IL-6、TGF-β1的分泌量。
1.2.6 RT-PCR及 Western blot检测 HT29细胞Vimentin、E-cadherin表达水平Trizol法分别提取结肠癌细胞各组中总RNA,需测定基因引物序列,E-cadherin,上游:5′-CCTGGGACTCCACCTACAGA-′,下游:5′-TGGATTCCAGAAACGGAGGC-3′(扩增片段长度 196 bp);Vimentin 上游:5′-CCGGGAGAAA TTGCAGGAGGAG-3′,下游:5′-CGGGCTTTGTCG TrGGTTAG-3′(扩增片段长度 178 bp);GAPDH(内参基因),上游:5′-GAAGGTGAAGGTCGGAGTC-3′,下游:5′-AGGTCAAGACGTGCCAGAGAC-3′,2-ΔΔCt法计算mRNA的相对表达量,采用蛋白印迹法(Western blot)检测Vimentin和E-cadherin基因蛋白表达水平。
1.3 统计学方法 运用统计软件SPSS17.0进行数据处理,多组间均数比较采用单因素方差分析,组内两两比较采用LSD法,所有统计结果以P<0.05为差异有统计学意义标准。每个实验均进行了3次独立实验。
2 结果
2.1 药物浓度筛选结果 结肠癌细胞HT29接种于96孔板,吡非尼酮以0、0.25、0.5 mg/mL不同浓度分别培养HT29细胞,培养72 h,CCK8试剂检测吸光度。统计结果显示0.25、0.5 mg/mL均对HT29细胞增殖无抑制作用(P>0.05),选取0.5 mg/mL作为PFD-CAF-CM组药物浓度(表1)。
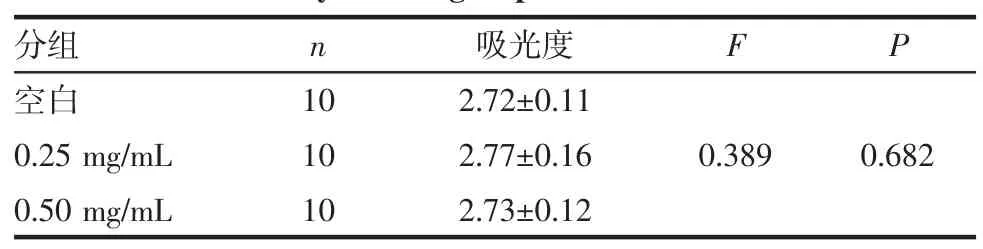
表1 各组细胞吸光度Tab 1 The absorbency in each group
2.2 CCK8实验检测增殖作用 PFD-CAF-CM组分别与对照组、CAF-CM组比较增殖效率受抑制,差异有统计学意义(P<0.01),表明PFD可以抑制CAFs与HT29协同增殖作用;对照组与CAF-CM组比较无明显差异(P>0.05)(图 1,表2)。
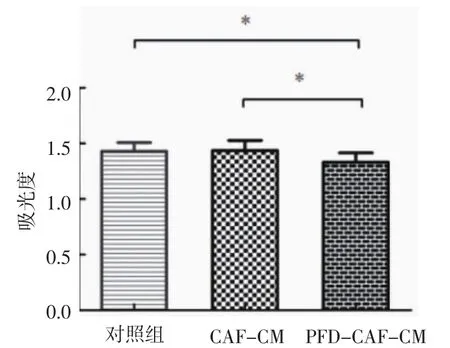
图 1CCK8检测增殖作用Fig 1 CCK8 detection of proliferation
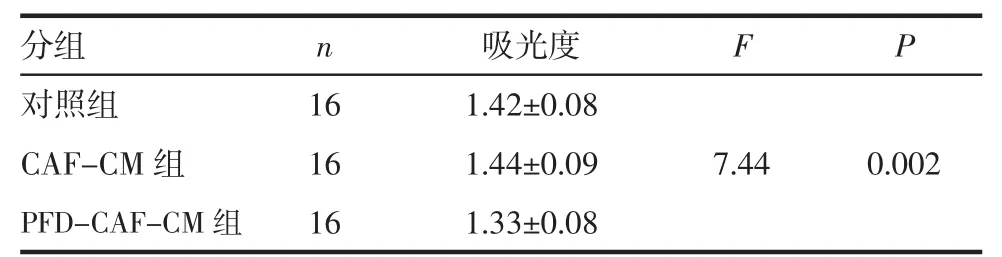
表2 CCK8检测增殖作用Tab 2 CCK8 detection of proliferation
2.3 Transwell实验
2.3.1 Transwll侵袭实验 CAF-CM组与PFDCM、PFD-CAF-CM组、对照组相比,侵袭细胞数目明显增多,差异有统计学意义(P<0.01),表明CAF使HT29细胞侵袭性增强;PFD-CM组与对照组比较差异无统计学意义(P>0.05),表明PFD不影响HT29细胞侵袭能力;PFD-CAF-CM组与对照组相比差异无统计学意义(P>0.05),表明PFD可以抑制CAF对HT29细胞侵袭能力的影响(图2,表3)。
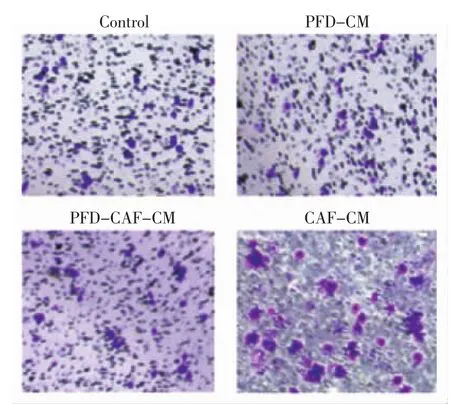
图2 各组细胞侵袭结果Fig 2 The invasion results of each cell line in each group
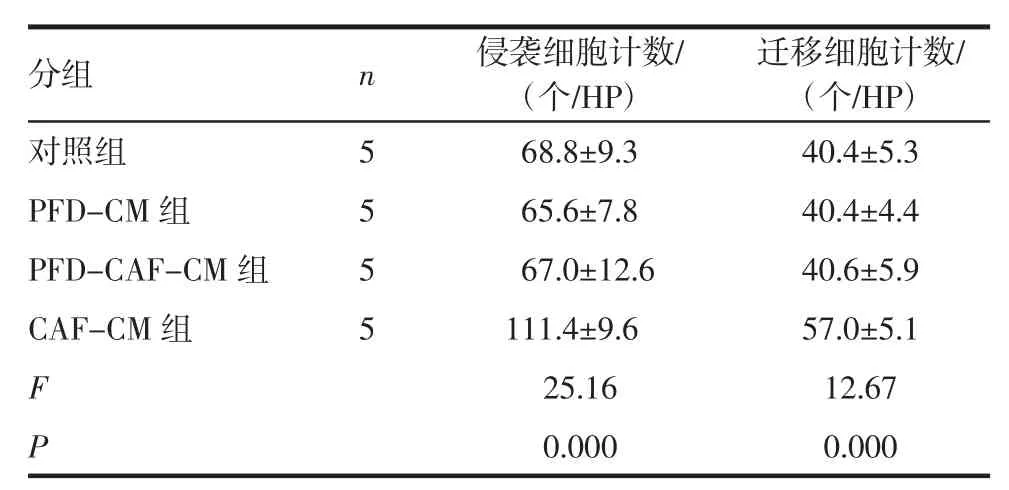
表3 各组细胞侵袭/迁移结果Tab 3 The invasion/migration results of each cell lines in each group
2.3.2 Transwell迁移实验 CAF-CM组与PFDCAF-CM组、对照组相比,迁移细胞数目明显增多,差异有统计学意义(P<0.01),表明CAF使HT29细胞迁移能力增强;PFD-CM组与对照组比较差异无统计学意义(P>0.05),表明PFD不影响HT29细胞迁移能力;PFD-CAF-CM组与对照组相比差异无统计学意义(P>0.05),表明PFD可以抑制CAF对HT29细胞迁移能力的影响(图3,表3)。
2.4 ELISA实验检测PFD对CAFs分泌TGF-β1、IL-6因子的作用 经0.25、0.5、1.0、1.5 mg/mL吡非尼酮药物干预后,CAFs分泌TGF-β1显著减少,且随PFD剂量增加TGF-β1浓度递减,各组与对照组比较差异显著(P<0.01),说明PFD抑制CAFs分泌TGF-β1且存在剂量依赖关系(表4,图4)。不同药物浓度组IL-6含量无明显差异。
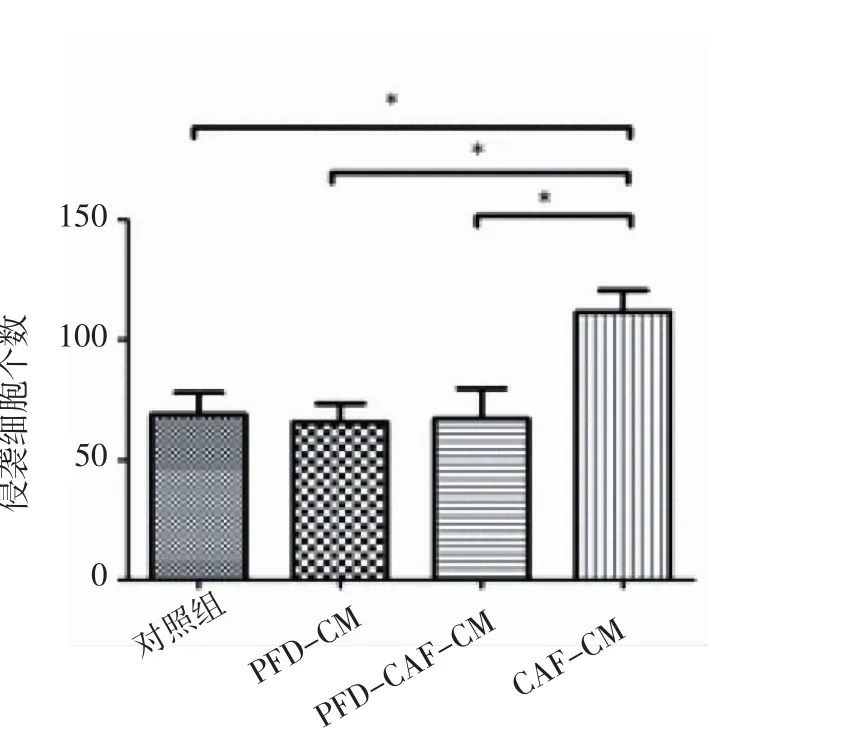
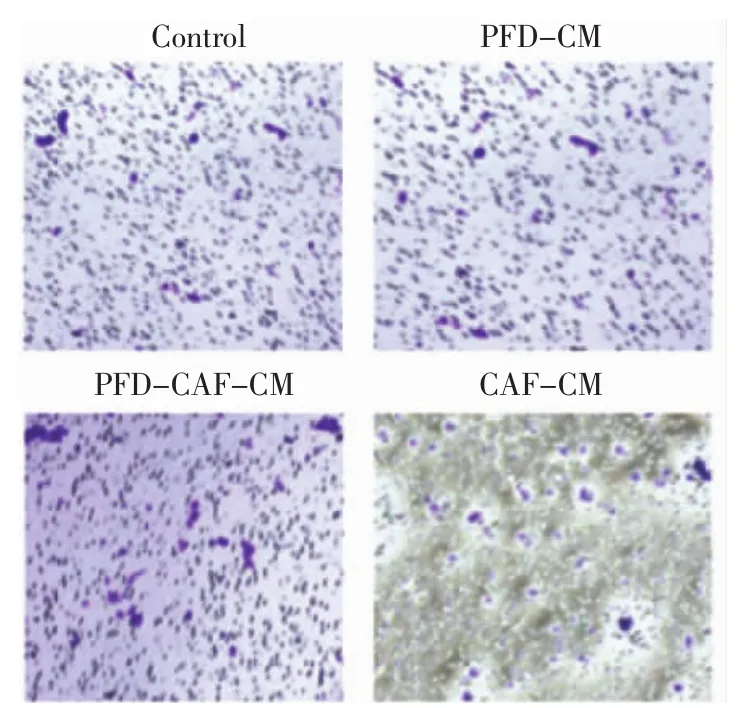
图3 各组细胞迁移结果Fig 3 The migration results of each cell line in each group
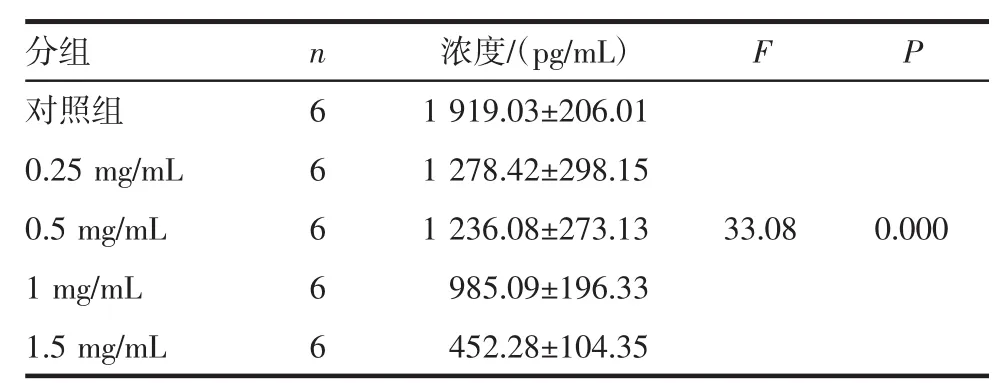
表4 ELISA检测TGF-β1Tab 4 ELISA detection of TGF-β1
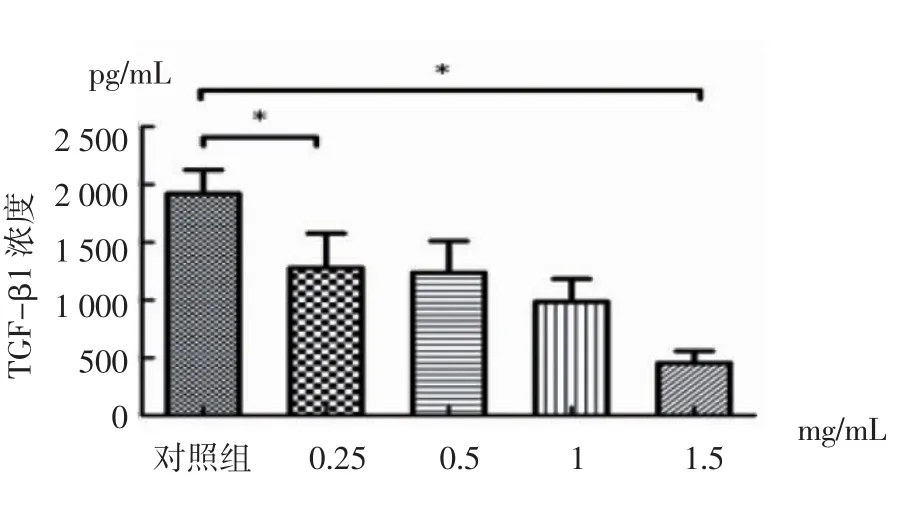
图4 ELISA检测TGF-β1Fig 4 ELISA detection of TGF-β1
2.5 RT-PCR及Western blot检测HT29细胞Vimentin、E-cadherin表达水平 与对照组、PFDCM组和PFD-CAF-CM组比较,CAF-CM组Vimentin的mRNA和蛋白表达水平升高,差异有统计学意义(P<0.05),E-cadherin的mRNA和蛋白表达水平降低,差异有统计学意义(P<0.05);PFD-CM组与对照组比较差异无统计学意义(P>0.05),表明PFD不影响HT29细胞Vimentin、E-cadherin表达;对照组和PFD-CAF-CM组比较Vimentin的mRNA和蛋白及E-cadherin的mRNA和蛋白表达水平无显著性差异(P>0.05),说明PFD可以抑制CAF诱导HT29上皮间质转化(表5,图 5、6)。
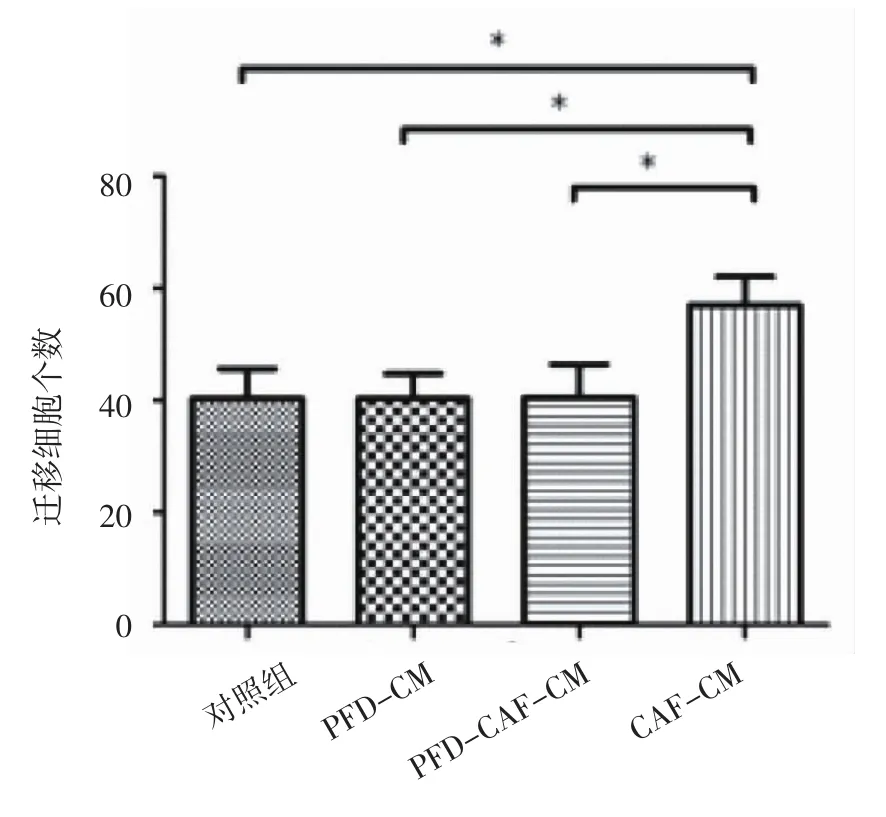

表5 各组细胞中Vimentin、E-cadherin的mRNA表达水平Tab 5 The expression levels of mRNA of Vimentin and E-cadherin in each group
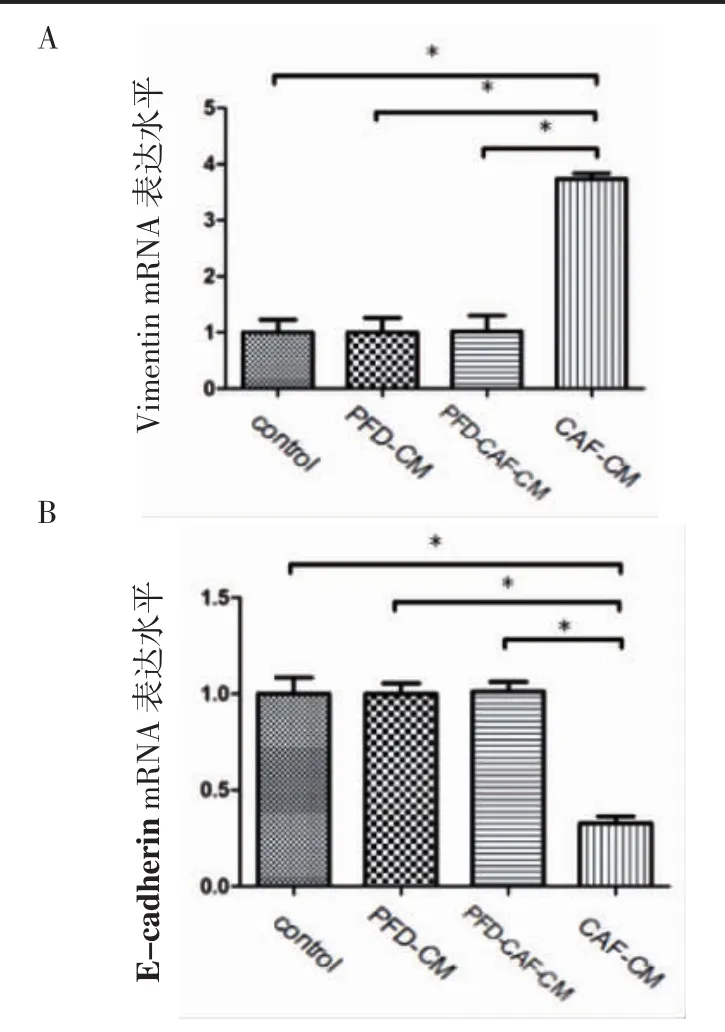
图A、B示各组细胞Vimentin、E-cadherin mRNA表达量;*P<0.01图5 各组细胞中Vimentin、E-cadherin的mRNA表达水平Fig 5 The expression levels of mRNA of Vimentin and E-cadherin in each group
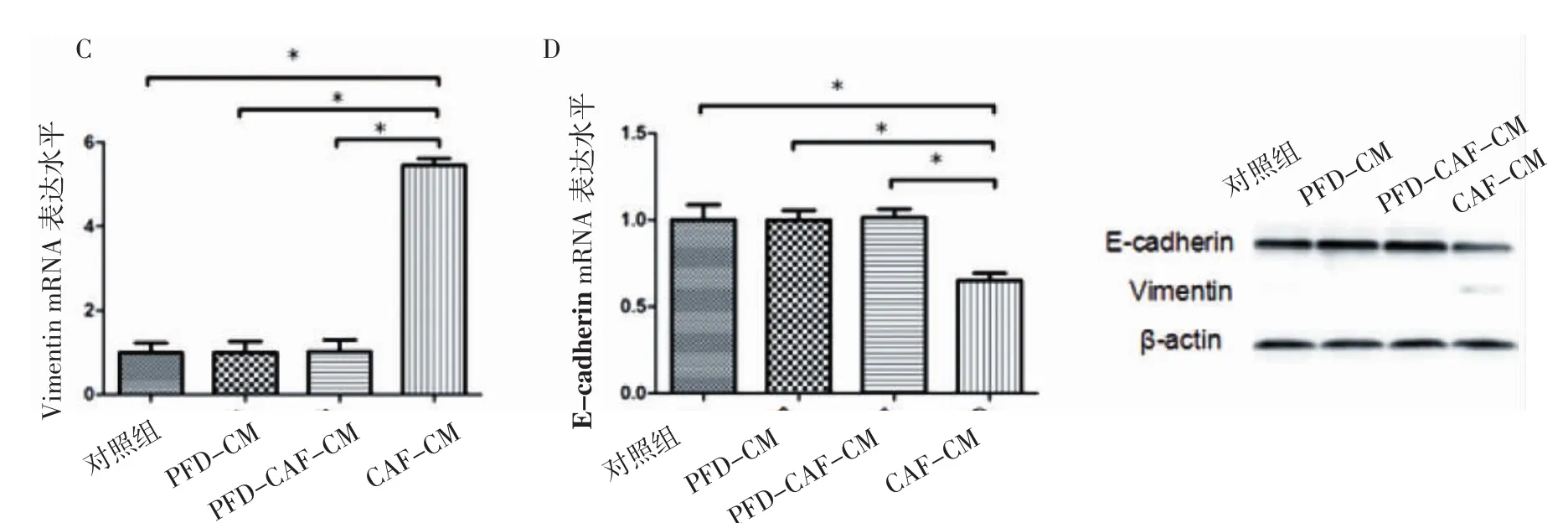
图6 各组细胞中Vimentin、E-cadherin的蛋白表达水平Fig 6 The expression levels of Vimentin and E-cadherin protein in each group
3 讨论
近年来肿瘤微环境在肿瘤发生发展中的关键作用被越来越多的人认识,其众多的细胞成分如内皮细胞、淋巴细胞、成纤维细胞等也被逐渐认知[1]。尽管目前针对肿瘤微环境的免疫治疗已经取得了相当的成效,但是炎症细胞如淋巴细胞,单核-巨噬细胞及中性粒细胞的可塑性和异质性严重阻碍了免疫治疗的效果。在这种情况下,肿瘤微环境中另一种重要的细胞CAFs,可能成为改变肿瘤微环境并治疗肿瘤的新靶点。有些研究认为CAFs通过提供结构支架和通过分泌大量的生长因子从而起到促进肿瘤发生发展的作用,有助于肿瘤组织内稳态和组织重塑[2-4]。
临床上部分结肠癌患者就诊时已处于中晚期,己经失去手术治疗机会。而且有些患者手术后很快发生复发与转移。恶性肿瘤最主要的特征之一是转移,肿瘤的转移是一个复杂的多级的生物学过程,而肿瘤细胞获得侵袭转移能力的关键一步便是EMT[8]。EMT的主要特征是上皮细胞表型标记物的表达下调或缺失(如E-cadherin),而间质细胞表型标记物(如 Vimentin、N-cadherin等)表达上调[9-10]。TGF-β能介导EMT发生的现象首先在细胞培养中发现[11]。TGF-β分子主要通过β-整合素信号传导途径促进Smad(主要是Smad3)分子依赖的细胞转录过程的发生,也可通过非Smad分子依赖信号传导途径和调控转录因子发挥作用引起EMT[12]。吡非尼酮是一个有效的抗纤维化药物,但作用机制尚不清楚。目前研究显示吡非尼酮可以减弱成纤维细胞受到细胞生长因子如TGF-β刺激后的细胞增殖、纤维化相关蛋白和细胞因子产生[5-6]。目前,吡非尼酮对结肠癌相关CAFs的作用还需要进一步研究。
吡非尼酮作为一种细胞因子抑制剂可以改变成纤维细胞分泌的多种细胞因子及生长因子[7]。本实验中,利用CAFs诱导结肠癌细胞HT29后发现,HT29增殖能力增加,间质表型标志物Vimentin表达水平显著升高,上皮表型标志物E-cadherin表达水平显著降低,差异具有统计学意义。这表明CAFs可能通过分泌细胞因子促进HT29细胞EMT的发生。条件培养基培养HT29细胞后发现,与对照组相比,吡非尼酮处理后CAFs条件培养基促进HT29细胞增殖能力明显减弱。ELISA检测细胞培养上清,结果显示,使用吡非尼酮干预CAFs后TGF-β1分泌量显著降低,但是IL-6的分泌量在各组之间并未发生明显的变化。同时,Western blot及PCR结果显示,吡非尼酮处理后CAFs条件培养基与HT29细胞共培养以后,相对于对照组,间质表型Vimentin表达水平明显受抑制。Transwell实验表明,吡非尼酮干预CAFs后,与未干预组相比肿瘤细胞的侵袭性和迁移性明显减弱。吡非尼酮通过抑制结肠癌相关CAFs分泌TGF-β1,抑制HT29细胞发生EMT可能是吡非尼酮的作用机制之一。
综上所述,随着对肿瘤微环境研究的深入,吡非尼酮抑制肿瘤相关成纤维细胞(CAFs)诱导的结肠癌细胞上皮-间质转化(EMT)可能作为结肠癌治疗及预后新思路。
