糜子抗白粉病基因(Mlo)编码蛋白的序列特征及表达分析
2018-10-22石甜甜何杰丽秦明月陈凌王海岗王瑞云乔治军
石甜甜,何杰丽,秦明月,陈凌,王海岗,王瑞云,*,乔治军*
(1.山西农业大学 农学院,山西 太谷 030801;2.山西农业大学 文理学院,山西 太谷 030801; 3.山西省农业科学院 农作物品种资源研究所/农业部黄土高原作物基因资源与种质创制重点实验室/杂粮种质资源发掘与遗传改良山西省重点实验室,山西 太原 030031)
糜子(PanicummiliaceumL.)属于禾本科黍属,是地球上最古老的粟类作物之一,为中国古代北方局域重要性主粮[1,2],也是远东地区(中国、日本、俄罗斯和印度)的主要粮食作物。在水稻和小麦引入之前,糜子是整个欧亚大陆的主粮,至今仍然是半干旱地区的重要作物[3~5]。糜子在欧美各国主要用于饲鸟和禽畜育肥。糜子是C4植物,蒸腾速率低,可以在干旱、高温等恶劣条件下快速成熟,可作为干旱、半干旱地区的稳产作物。中国是糜子的起源中心,种质资源丰富多彩[6],研究糜子抗病基因特性可以为抗性品种育种及其高效利用提供理论基础。
白粉病(powdery mildews)由白粉菌引起,该菌属于专化活体营养寄生菌,分布广泛,可以侵染大部分粮食作物,阻碍植物生长发育,影响粮食产量[7]。作为植物抗病基因中的重要成员,白粉病基因Mlo(Mildewresistancelocuso)最早在大麦中发现并分离[8,9]。迄今,已经在大麦[10]、拟南芥[11]、葡萄[12]和黄瓜[13]中发现了Mlo基因家族的特异性同源物,并将其用于研究白粉病真菌的发病机制。Mlo基因作为植物特有的基因家族,在调控植物非生物和生物胁迫方面起重要作用。目前,Mlo基因已经在大麦等植物中被克隆,并且明确了其分子结构和功能,通过转基因手段将其导入其他植物的研究正在展开[14]。大麦、拟南芥、番茄等植物中的Mlo型抗病蛋白都由Mlo基因编码[15]。
研究发现一些作物的Mlo基因家族成员具有抗白粉病特性,其在高等植物基因组中较小,在单子叶和双子叶植物中基因数为8到39个[16]。Mlo基因的缺失突变对绝大多数大麦白粉病菌具有广谱抗性,对其他植物的病原菌也具抗性[16, 19,20]。功能丧失型Mlo等位基因由核苷酸的取代、插入、缺失或异常剪接导致[21~24]。Mlo突变体也存在有害的多效性效应(如早衰或株高降低)[19]。Mlo位于质膜上,包含几个跨膜域,研究发现叶片Mlo与衰老、形态发育和应激反应等有关,但其功能尚不明确[25]。
Mlo基因家族成员具有较强的抗病性,使其越来越成为育种研究的热门话题。从育种角度考虑,首要工作就是Mlo基因的发掘。糜子为小宗粮豆作物,其Mlo基因尚未克隆。为了揭示糜子Mlo基因对白粉病的抗性,本研究基于前期糜子转录组测序中发现的一段Mlo基因的cDNA序列为研究对象,利用一系列生物信息学方法鉴定与分析Mlo基因编码蛋白的序列特征,并利用qRT-PCR 技术评估了糜子叶片接菌后,Mlo基因表达量的变化。
1 材料与方法
1.1 试验材料
试验材料为黄糜子(00005272),由山西省农业科学院农作物品种资源研究所提供。室内种植培育至三叶期,待后续处理。
1.2 方法
1.2.1 糜子材料处理及总 RNA 提取
糜子叶片白粉病菌的接种采用病叶片压片法[26]。选取糜子叶长度约 7.0 cm的幼叶,压片前预先喷雾无菌水使叶片上有微小液滴,但无明显露滴出现。采集甜瓜白粉病发病症状严重的感病叶片,对糜子叶片压片接种,并在接种后 0、3、6、9、12、15 d 采集叶片液氮冻存。糜子叶片总 RNA 的提取采用Trizol法。
1.2.2 Mlo基因编码蛋白的生物信息学分析
在NCBI中,利用在线软件ORF Finder预测开放阅读框并翻译蛋白质序列、ProtParam预测蛋白质理化性质、SignalP4.1预测信号肽序列、TMHMM分析跨膜结构、ProtComp和TargetP进行亚细胞定位、NetNES分析核输出信号、Phyre2预测蛋白二级和三级结构、TM HMM-2.0预测跨膜螺旋结构、DNAMAN 8.0 和进行序列多重比较、MEGA 7.0.21构建系统进化树、MEME预测蛋白的保守结构,各软件具体网址见何杰丽等[27]。
1.2.3Mlo基因的实时荧光定量表达分析
采用TRIzon总RNA提取试剂盒(CW0580S)提取不同时间处理下的黄糜子叶片RNA,并通过1%琼脂糖凝胶电泳检测RNA质量。采用PrimeScript® RT Master Mix试剂盒(TaK aRa,大连)反转录合成第一链cDNA,保存于-20 ℃ 冰箱。用Primer5软件设计特异引物“(F: 5’- CTCAGTCAGCGAGGTTAT-3’,R:5’-ACGAGAACAG ACCATAGC-3’)与内参引物ACT(F:5’-ACCGAAGCCCCTCTTAACCC-3’,R:5’-GTAT GGCTGACACC ATCACC-3’)”[28]并由上海生工生物工程技术服务有限公司合成。
以 cDNA为模板进行实时荧光定量PCR 扩增,反应体系与PCR反应程序同何杰丽[27],反应结束后确认实时定量PCR的扩增曲线和熔解曲线,利用2-△△CT法[29]计算基因在不同样品中的相对表达量。在DPS软件中根据3次生物学重复及3次技术重复,利用Duncan多重比较对不同样品间差异显著性进行统计分析。
2 结果与分析
2.1 核酸及氨基酸序列分析
由在线软件对糜子Mlo基因进行开放阅读框预测,结果见图1,其核酸序列见图2。由图1和图2可以看出,ORF4最长,cDNA序列包含1 827 bp的完整开放阅读框,编码609个氨基酸,5’端有一个起始密码子ATG,编码甲硫氨酸(M),3’端有一个终止密码子 TGA,不编码氨基酸。

图1 糜子Mlo基因开放阅读框结构图Fig.1 Structure of open reading frame of Mlo gene in common millet

图2 糜子Mlo蛋白的核苷酸和预测的氨基酸序列Fig.2 Nucleotide and predicted amino acid sequences of Mlo protein in common millet
2.2 蛋白质理化性质分析
分析Mlo蛋白的理化特性,结果见表1。从表1可以看出,Mlo蛋白的不稳定系数为55.55,属于不稳定蛋白;总平均亲水性为0.973,属于疏水蛋白;Mlo蛋白中,丙氨酸(Ala)含量最高(28.9%),半胱氨酸(Cys)含量次之(27.9%),甘氨酸(Gly)和苏氨酸(Thr)含量分别为19.2%和24.0%。

表1 糜子Mlo蛋白的理化特性Table 1 Physicochemical properties of Mlo protein of common millet
2.3 蛋白质保守结构域结构分析
糜子Mlo蛋白质保守结构域预测见图3。从图3可以看出,该蛋白属于Mlo超基因家族,含有一个保守结构域,保守结构域位于第1~348位氨基酸之间。

图3 糜子Mlo的保守结构域Fig.3 Conserved structural domain of Mlo protein in common millet
2.4 Mlo蛋白信号肽及跨膜结构分析
分析糜子Mlo蛋白的信号肽和跨膜结构,结果见图4~图6。由图4可知,Y值来预测信号肽的剪切位点,通过S值判断该蛋白是否为分泌蛋白,若S值大于0.5,则为分泌蛋白,具有信号肽。结果表明S值存在于超过0.5的区域,故该蛋白为分泌蛋白,具有信号肽。由图5可知原子吸收光谱为0.431 43,该蛋白没有跨膜螺旋结构。由图6可知该蛋白存在42位氨基酸到57位氨基酸的跨膜肽链,且N-末端在膜外,C-末端在膜内。

图4 糜子Mlo蛋白信号肽预测Fig.4 Signal peptide prediction of Mlo protein in common millet
图5 糜子Mlo蛋白跨膜结构分析Fig.5 Transmembrane structure analysis of Mlo protein in common millet

图6 糜子Mlo蛋白跨膜肽链分析Fig.6 Transmembrane peptide chain analysis of Mlo protein in common millet
2.5 亚细胞定位
利用ProtComp在线软件进行亚细胞定位预测,结果见图7。由图7可以看出,质膜位置预测值为9.6,说明该蛋白质定位于细胞质膜上。

图7 糜子Mlo蛋白亚细胞定位Fig.7 Subcell localization of Mlo protein in common millet
2.6 核输出信号分析
由图8可知该蛋白质的第38位的异亮氨酸(I)的NES-Score超过阈值,表明该异亮氨酸为糜子Mlo核输出信号。

图8 糜子Mlo蛋白核输出信号预测Fig.8 Nuclear output signal prediction of Mlo protein in common millet
2.7 糜子Mlo蛋白二级和三级结构预测
利用软件预测Mlo蛋白的二级和三级结构,结果见图9和图10。由图9可知,该蛋白有4个α螺旋结构和3个β折叠结构。由图10可以看出,该蛋白的三级结构也包括4个α螺旋(红、橙、绿和青)和3个β折叠结构。
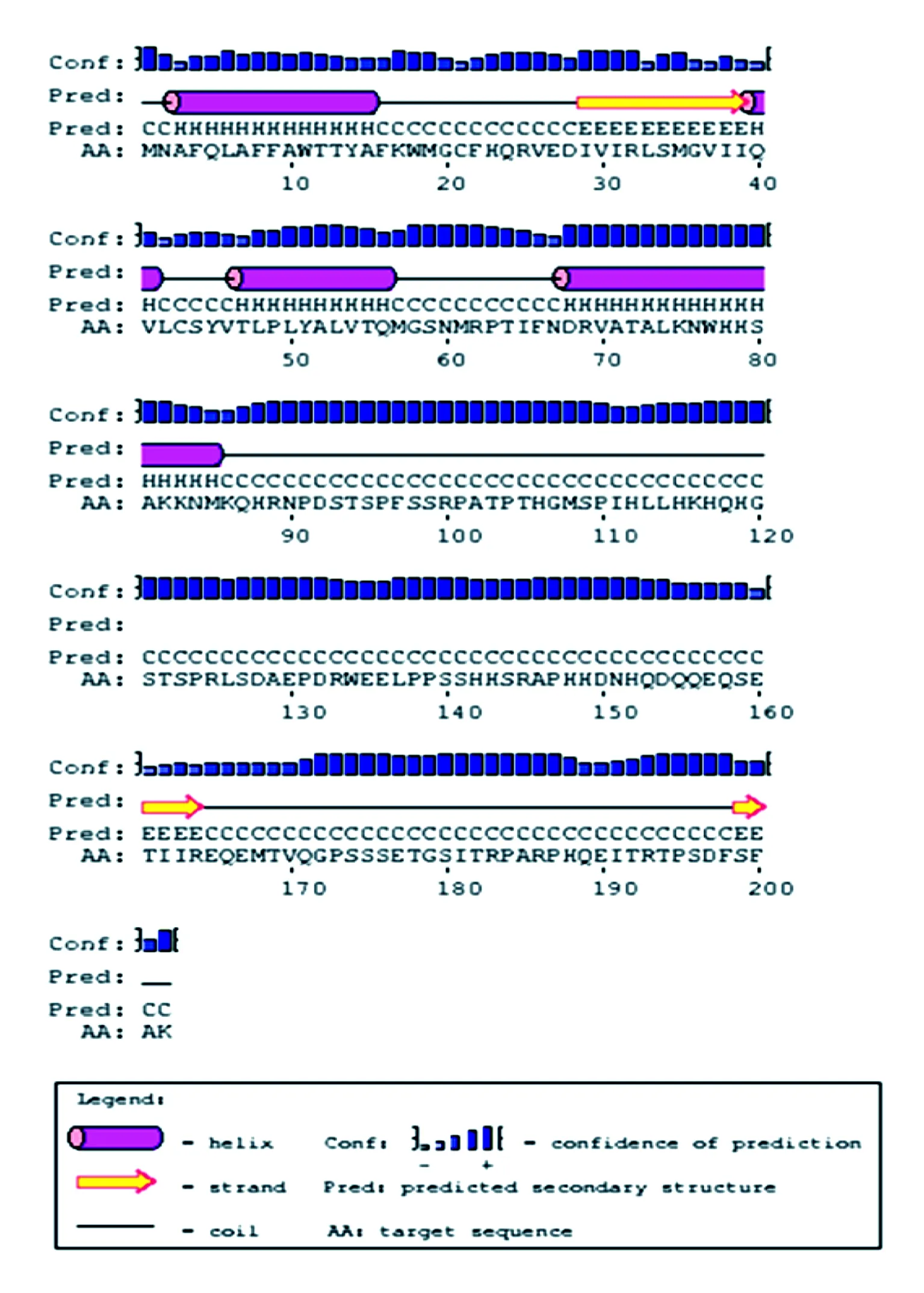
图9 糜子Mlo蛋白的二级结构预测Fig.9 Secondary structure prediction of Mlo in common millet

图10 糜子Mlo蛋白的三级结构预测Fig.10 Three-level structure prediction of Mlo in common millet
2.8 Mlo进化树的构建
7种植物Mlo蛋白序列的进化树和多重序列比对结果见图11和图12。从图11和图12可以看出,糜子与黄瓜Mlo蛋白的序列一致性的为100%,与其他3种葫芦科植物(西葫芦、苦瓜和南瓜)的序列一致性超过80%,而与陆地棉的序列的一致性较低(65%),与大豆的一致性最低(59%)。
2.9 糜子Mlo基因的表达特性分析
对糜子叶片进行活体白粉病菌接种,利用实时定量 PCR技术每隔3 d检测Mlo基因表达量,结果见图13。从图13可以看出,糜子Mlo基因mRNA表达水平在接菌不同时间后存在差异。糜子叶片接菌后,随着时间增加,Mlo基因mRNA相对表达量呈先升后降的趋势。接种3 d时,mRNA表达量仅在0.05水平上显著高于对照;接种6、9和12 d时,mRNA表达量在0.05和0.01水平上均显著高于对照; 9 d时mRNA表达量最高,为对照的4.33倍;15 d时,mRNA表达量与对照相比,差异不显著。

图11 7种植物Mlo蛋白氨基酸序列的进化树Fig.11 Evolutionary tree of amino acid sequence of Mlo in 7 species

图12 7种植物Mlo蛋白氨基酸序列多重序列比对结果Fig.12 Multiple sequences comparison results of Mlo amino acids in 7 species
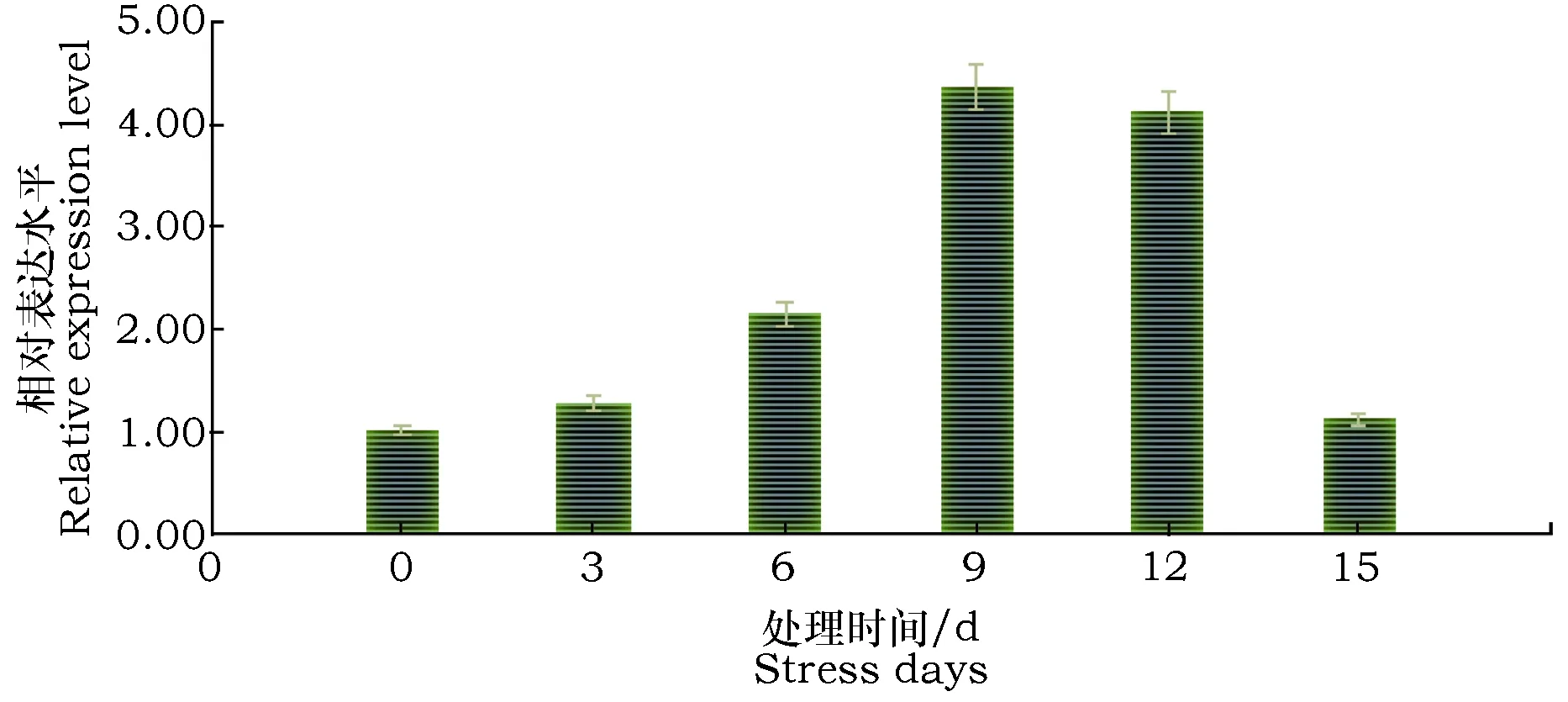
图13 糜子叶片Mlo基因表达水平Fig.13 Expression level of Mlo gene in common millet leave
3 讨论与结论
植物在自身的进化演变过程中形成了一系列复杂而严密的保护机制,以使自身免受病原物侵害,其中涉及一系列抗病相关基因的表达与调控[30,31]。本研究结果发现,白粉菌侵染糜子叶片能够导致Mlo基因相对表达量升高,随着接菌天数增加,Mlo基因相对表达量呈先增加后降低的趋势。9 d时表达量最高,为对照的4.33倍,15 d时与对照相比,基因表达量差异不显著。因此,Mlo基因相对表达量与糜子接菌处理后的不同时间有关。
夏礼如等[15]以黄瓜的全基因组序列为基础,运用生物信息学方法来研究黄瓜Mlo型基因家族成员,对其进行鉴定及生物信息学分析,结果在黄瓜全基因组中鉴定得出14条Mlo型基因序列。徐坚等[13]发现大部分Mlo基因来源于拟南芥、黄瓜、甜瓜和西瓜,本研究也发现类似现象,进化树分析表明糜子和黄瓜的Mlo序列一致性为100%。目前,糜子研究多集中于遗传多样性评估、分子标记开发等方面[2,5,6,32~34]。近来,王瑞云对糜子的遗传多样性、栽培驯化和传播途径等进行了详细阐述[33];Wang等评估了中国糜子waxy等位变异的遗传多样性,在132份糜子材料中发现了5种waxy基因型及其所占比例,分别为S-15/LF(45%)、 S0/LF(25%)、 S0/LY(12%)、S0/LC(11%)和S-15/LY(7%)[34]。然而,糜子中已克隆的基因较少,多为抗旱相关基因,包括PmNCED1和SAMS的克隆,Ty1-copia基因的表达[1,27,35,36]。白粉病作为作物生产上最重要的病害之一,鉴定白粉病基因是实现抗病育种的前提。本研究首次分析了糜子Mlo基因编码蛋白的生物信息学特性,为抗白粉病基因的克隆及新品系的筛选提供了理论参考。
