栅藻贴壁培养供氮策略研究
2018-10-22季春丽刘天中李润植
季春丽,刘天中,李润植*
(1.山西农业大学 分子农业与生物能源研究所,山西 太谷 030801;2.中国科学院 青岛生物能源与过程研究所,山东 青岛 266101)
随着人类文明不断发展以及对能源需求的与日俱增和化石燃料日益枯竭,当今世界正在面临能源危机。大力发展太阳能、风能、生物质能和核能等清洁能源是解决能源危机的有效途径,生物质能源由于具有可再生、安全、无CO2净释放等优点备受关注,尤其是应用微藻生产生物柴油等生物燃料被认为是唯一有潜力替代化石燃油的绿色能源[1, 2]。微藻为原核或真核单细胞或简单细胞群体的光自养微生物,种类繁多,分布广泛。与传统的生物质原料相比,微藻具有更高的光合作用效率和固碳能力以及富集油脂的特性[3, 4],生长快速且生长周期短[5],不受季节限制,不占用耕地,还可以利用废水、再生水及海水进行规模化培养,无需消耗有限的淡水资源[6]。除了用作能源生产外,微藻在食品、医药、化妆品、肥料、饲料和功能农业等其它领域也被广泛应用,具有很高的经济、环境和社会价值[7, 8]。
然而,大规模获得微藻生物质和微藻生物能源产品成本过高是目前微藻生物能源技术面临的两大瓶颈[1]。因此,提高微藻的培养效率和产油率以及降低其大规模培养成本是微藻生物燃油研发领域的重要任务。现今工业化微藻培养均采用液体悬浮式培养,主要包括开放式培养池(open pond)与密闭式光生物反应器(closed photobioreactor, PBR)2种形式。开放式培养池的建造和运行成本较低,但藻细胞生长速度与培养密度均较低,且占地面积大,易被杂藻污染。PBR培养可显著提高藻细胞生长速度与培养密度,但造价昂贵、运行成本高、维护困难、难以规模化[9]。这些传统液体悬浮式培养方式的共同特点是水分占整个液体培养体系的90%以上,大量的水环境不利于CO2传质和微藻对光和CO2的吸收利用。因为光源进入水中都会有不同程度的衰减,为了更好的气液接触和培养液的混合以利于微藻光合固碳,需要使用搅拌等装置,这不仅增加了微藻培养成本,也带来了能耗、散热等一系列问题,而且机械搅拌产生的剪切力也会对藻细胞产生损伤。此外,大量水介质也给微藻的收获造成困难,增加了生产成本。新近建立的微藻半固定化生物膜贴壁培养方法呈现诸多优点,如涉水量小、细胞密度大、生长快速和采收便捷等,能克服传统悬浮培养方式耗水量大、能耗高、藻体采收和规模化培养困难等问题[10~13],因此,应用该方法规模化培养微藻有望显著提高微藻生物质原料供给量,从而推动能源微藻产业及耦合环境治理等的发展。
前期研究结果证明栅藻(Scenedesmusobliquus)、葡萄藻(Botryococcusbraunii)、雨生红球藻(Haematococcuspluvialis)、螺旋藻(Spirulinaplatensis)、紫球藻(Porphyridiumcruentum)等均可在贴壁培养系统上较好地生长并积累目标代谢产物[10, 14~17]。而且,与传统的培养方法相比,贴壁培养用水量可减少90%,能耗显著降低,采收简便易行[18, 19]。然而,与传统液体悬浮培养类似,贴壁培养亦需要精准调控营养元素供给以获得高目标产物生产量。通常在营养充足和环境条件比较理想时,微藻生物量大,但油脂积累少。相反,在营养胁迫情况下,微藻生物量低,但能大量积累油脂等目标产物。营养盐胁迫中,氮胁迫是最重要的影响油脂合成的因素,大多数微藻在缺氮条件下可大量积累油脂,尤其是甘油三脂(TAG)[20, 21]。TAG是中性脂的主要成分,是真核生物细胞中重要的储能物质,也是将碳转变为食品和生物柴油等高值产品的主要来源[22],还是生产符合ASTM标准的生物柴油的主要原料[23, 24]。因此,建立优化的氮元素供给策略对规模化应用贴壁培养技术养殖微藻,特别对提高富油微藻产油量和生产效率至关重要。
本文以一种淡水绿藻栅藻(Scenedesmusobliquus)为模式藻,分别研究在贴壁培养条件下,氮元素供给包括恒定氮浓度和总氮量(不同培养基体积)对栅藻生长和产油的影响,进一步制定了微藻贴壁培养条件下氮供给优化策略,旨在为建立低耗、高效、可持续的微藻规模培养工艺体系提供理论依据。
1 材料和方法
1.1 藻种与培养
藻种:试验所用的栅藻(Scenedesmusobliquus)为实验室从青岛水域筛选所得,保藏于本实验室中。
培养:将栅藻藻种接种于长0.8 m,直径为0.05 m的玻璃管中,玻璃管中加入700 mL BG-11培养基使接种浓度大约为0.1 g·L-1,含有2% CO2(v∶v)的压缩空气以0.25 v·v-1·min-1(通气速率(L·min-1)与培养液体积(L)的比值)的速率通入玻璃管藻液中提供碳源并混匀藻液。将藻液放在连续光照强度为(100±5)μmol·m-2·s-1和温度为(25±1)℃的环境中培养7 d后收获并留作后续贴壁培养接种用。
BG-11培养基组成为:1 L BG-11培养基中含有1.5 g NaNO3、0.075 g MgSO4·7H2O、0.036 g CaCl2·2H2O、0.047 5 g K2HPO4·3H2O、0.02 g Na2CO3、6.562×10-3g一水柠檬酸、1.0×10-3g Na2EDTA、6.0×10-3g柠檬酸铁铵、2.22×10-4g ZnSO4·7H2O、6.9×10-5g CuSO4·5H2O、1.81×10-3g MnCl2·4H2O、3.9×10-4g Na2MoO4·2H2O、4.94×10-5g Co(NO3)2·6H2O和2.86×10-3g H3BO3。
1.2 贴壁培养系统
贴壁培养系统为单层竖直板系统(single layer vertical plate system)[10],接种密度约为10 g·m-2,试验装置图如图1所示。为了测定培养基中的营养元素恒定氮浓度对栅藻贴壁生长和油脂积累的影响,培养基从体系中流出后一般直接废弃(图1 B),而为了测定培养基中氮总量(培养基体积)对一定量的藻细胞生长和产油影响则培养基会在体系中利用蠕动泵循环使用(图1 C)。将贴壁培养体系放在(25±1)℃的环境中进行微藻贴壁培养,含有2%浓度CO2的压缩空气以0.17 v·v-1·min-1(通气速率(L·min-1)与反应器体积(L)的比值)速率直接通入反应器中,并在反应器上方放置灯管使培养光强为(100±5) μmol·m-2·s-1。
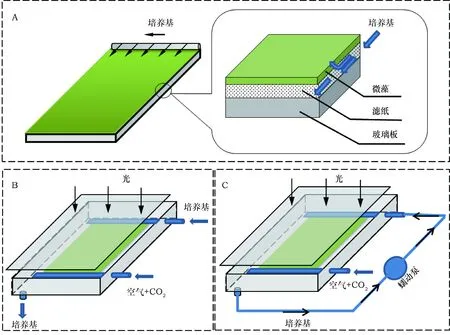
图1 贴壁培养装置图Fig.1 Schematic diagram of the attached photobioreactor
1.3 生物量测定方法
在贴壁系统接种前,将一定量的藻液(V/L)用抽滤装置过滤到预先称重(W1/g)的混合膜上,然后用清水冲洗2~3次以除去藻细胞中残留的营养盐成分等,将滤膜放到烘箱里105 ℃下烘至恒重(W2/g),通过细胞干重和藻液的体积来确定藻液的浓度(Ct/g·L-1)以便于接种工作。
Ct=(W2-W1)/V
(1)
当细胞收获时,将滤膜上的藻细胞冲洗下来并按上述方法抽滤烘干称干重(DW/g),由于藻细胞在滤膜上的接种面积为1×10-3m2,则滤膜上的细胞浓度(DWt/g·m-2)为:
DWt=DW/0.001
(2)
收获时,相应的生物量产率(P/g·m-2·d-1)为:
P=(DWt-DW0)/t
(3)
其中,DW0为接种时的细胞浓度/g·m-2,t为培养时间/d。
1.4 藻细胞中总脂含量的测定
将待测藻细胞用水从滤膜上冲洗下来,反复离心弃上清,将藻渣冷冻干燥后称取0.05 g左右的藻粉(Wc/g)放入研钵并加入约200 mg石英砂一起研磨,用7.5 mL甲醇-氯仿混合液(甲醇∶氯仿=2∶1,v∶v)将研磨后的藻粉和石英砂的混合物分数次全部转移到50 mL离心管中并高速震荡5 min使其均匀混合,然后将其密封置于37 ℃摇床24 h后取出离心,将上清置于新管中,并在藻渣混合物中再加入7.5 mL甲醇-氯仿混合液,振荡均匀后置于37 ℃摇床2 h,取出后再次离心并将上清与上次的合并,然后向合并液中再加入5 mL 氯仿和9 mL 1% 的NaCl溶液,使得最终混合液中的甲醇、氯仿、水相比例为2∶2∶1.8,将此混合液混合均匀后离心收集下层有机相,并将有机相转移到预称重的玻璃小管中,在60 ℃下用氮气吹干,再将小玻璃瓶放在60 ℃真空干燥箱中烘干3 h称重得到总脂重量(W/g),则藻细胞中总脂含量(TL)为:
TL=W/Wc
(4)
1.5 总脂中TAG含量的测定
将上述烘干后的总脂加入一定量的氯仿进行溶解,使总脂浓度约为5 g·L-1,然后用微量进样器吸取1 μL样品在棒状薄层色谱的层析棒原点处分4~5次进行点样,待晾干后将层析棒先放入一展溶液(苯∶氯仿∶乙酸=150∶60∶2)中进行展开,晾干后放入二展溶液中(苯∶正已烷=1∶1)再进行展开,待展开都完成后,将层析棒在70 ℃烘箱中烘干3 min,最后将层析棒放入棒状薄层色谱仪器中进行分析,设定色谱中空气流速为2 L·min-1,氢气流速为160 mL·min-1。对待测样品进行分析时,可根据样品中的组分保留时间以及样品峰面积与标准品的进行对照从而确定TAG的含量。
1.6 溶液中硝态氮浓度和细胞中氮含量的测定
溶液中硝态氮的测定采用紫外分光分度法[25],取5 mL待测溶液离心,取3 mL上清液放入石英比色皿并用紫外分光光度计测量其在波长为220 nm下的吸收值(OD220),为了使结果准确可信,每次测量值的范围应该在0.1~0.8之间,如超过这一量程,应该对待测溶液进行适当的稀释。在测量前先用标准品配制一系列不同浓度硝酸盐溶液,并用此方法测量各不同浓度对应的OD220并作标准曲线,然后待测溶液中硝态氮浓度(C/mmol·L-1)可以通过标准曲线和其紫外吸收值进行计算,标准曲线计算公式为:
C=0.2763 ×OD220+ 0.0055 (r2>0.99)
(5)
细胞中氮元素含量占细胞干重的百分比用元素分析仪在1 140 ℃的燃烧温度下并用氦气作为运载气体的设定条件下进行测定。
2 结果与分析
2.1 恒定氮浓度对栅藻生长和油脂积累的影响
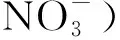

图2 恒定氮浓度对栅藻(培养7 d)(A)生物量浓度和(B)生物量产率的影响Fig.2 The biomass concentration(A) and biomass productivity(B)of S. obliquus under different constant nitrate concentrations after 7 days cultivation
由图2A可以看出,各恒定氮浓度下栅藻生物量随培养时间的增加而增加,而且藻的生物量产量和产率在一定范围内与恒定氮浓度呈正相关,说明氮浓度是影响栅藻生长的一个因素。图2B显示,当氮浓度为17.65 mmol·L-1(正常BG-11中氮浓度)时,生物量产率达到最大,为10.48 g·m-1·d-1,当氮浓度为1.76 mmol·L-1(为正常BG-11氮浓度的1/10)时,对应生物量产率为9.17 g·m-1·d-1,当氮浓度大于这一值时,栅藻的生物量产率增长并不明显,说明在正常BG-11中的氮浓度对栅藻生长是过量的。
恒定氮浓度对栅藻中总脂含量和产率的影响如图3 A所示,总脂积累会随着氮浓度的增加呈减少的趋势,尤其是当氮浓度高于1.76 mmol·L-1时,油脂含量下降较明显,而且氮浓度偏高或偏低都会降低藻中的油脂产率,只有当在一个合适的氮浓度时,生物量和油脂含量均较高,而油脂产率达到最大值。当氮浓度为1.76 mmol·L-1时,油脂产率达到最大值(3.80 g·m-2·d-1)。由此结果可知,在贴壁条件下,“一步法”产油是可行的,即生物量和油脂积累同时进行。恒定氮浓度对栅藻中TAG含量和产率的影响如图3 B所示,TAG积累情况与总脂的类似,即其含量会随着氮浓度的增加而减少,而氮浓度偏高或偏低均会降低其产率。当氮浓度为1.76 mmol·L-1时,TAG产率达到最大,为2.01 g·m-2·d-1。试验结果表明,缺氮会导致藻中TAG含量增长,说明氮浓度是影响TAG含量的一个重要因素,所以调控溶液中氮浓度是实现调控TAG含量的一个重要途径。
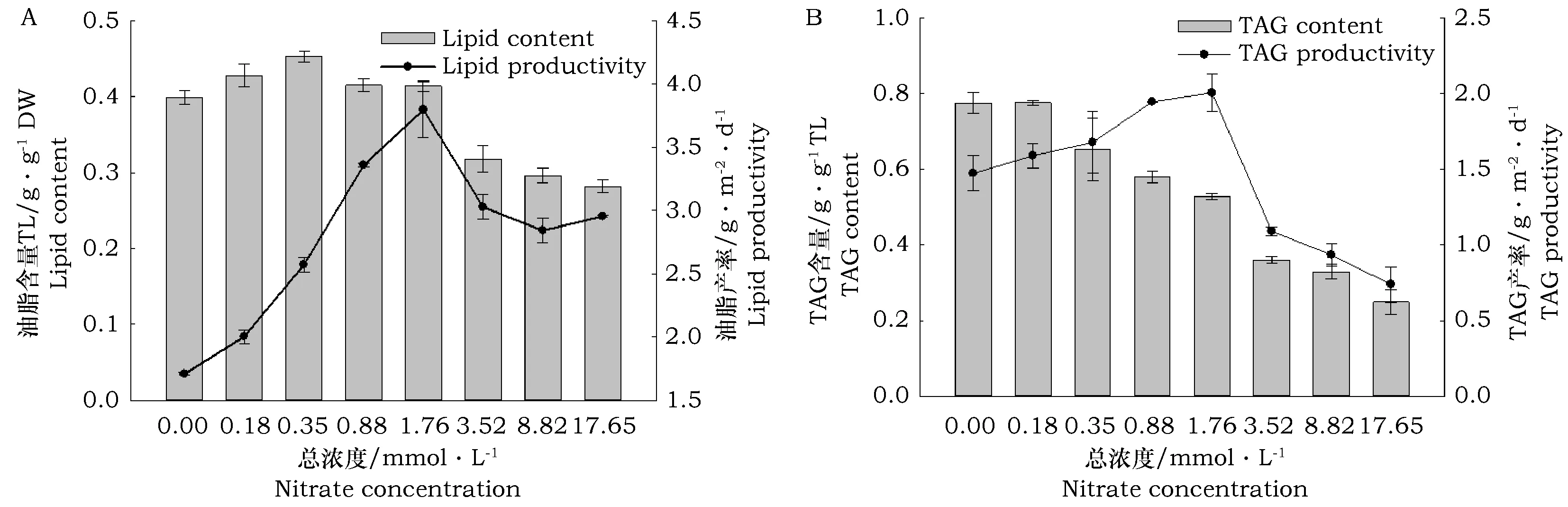
图3 恒定氮浓度对栅藻(培养7 d)(A)总脂和(B)TAG含量及产率的影响Fig.3 The(A)total lipid and(B)TAG accumulation of S. obliquus under different constant nitrate concentrations after 7 days cultivation
各恒定氮浓度下培养7 d后细胞形态如图4所示(图中右下角标尺为10 μm),在接种时(生长第0天),细胞很绿且呈梭状,四聚体较多。7 d后,细胞在各氮浓度下均有一定程度的变黄、聚集、衰老和裂解,且这种现象随氮浓度的减少而加重,而且氮浓度很低时,变黄细胞中有的有油滴存在,说明缺氮更利于诱导藻细胞产油。
本试验证明了氮浓度对栅藻的生长和油脂积累有重要影响,对一定接种量的藻细胞,多少氮支持多大的生物量和油脂产量以及以怎样的方式提供氮源最为合适有待进一步考察。
2.2 总氮量对栅藻生物量和油脂积累的影响
确定了最佳氮浓度(1.76 mmol·L-1)后,考察不同体积(0.1、0.3、0.5、1、3 L)1.76 mmol·L-1的培养基即对应氮总量为0.176、0.528、0.88、1.76、5.28 mmol NaNO3对一定接种量(~10 g·m-2, ~160 cm2)栅藻的影响,试验装置如图1 C,培养基采取循环方式,流出液回收并循环用于培养,从而确保培养基总量一定,试验结果如图5所示。
由图5 A可以看出,溶液中总氮量越少,氮消耗速度越快。但是各组中的氮几乎都在第5天消耗完,第5天后,各组溶液中的氮浓度波动不大,波动范围在0.062~0.166 mmol·L-1。由图5 B可以看出,生物量与溶液中的总氮量呈正相关关系,当溶液中总氮含量大于0.88 mmol 时,生物量增长缓慢。当溶液中总氮量分别为1.76和5.28 mmol时,对应生物量产率为10.12和10.55 g·m-2·d-1,与恒定氮浓度1.76 mmol·L-1条件下的结果相差不大,由于该试验中培养基为循环利用,因此试验结果表明,在不明显影响生物量营养盐的浪费,而且也不能进一步提高生物量和油脂产量。
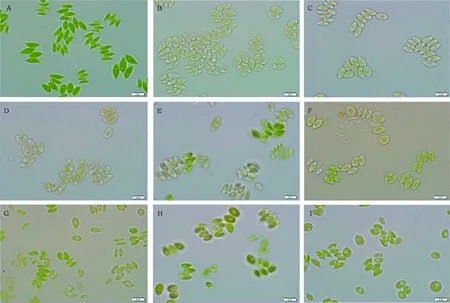
图4 恒定氮浓度对栅藻细胞形态(A:接种时,B~I:栅藻分别在0、0.18、0.35、0.88、1.76、3.52、8.82和17.65 mmol·L-1恒定氮浓度下培养7 d后)的影响Fig.4 The morphology of S. obliquus under following conditions(A)inoculation(B)-(I)on the 7th day and the nitrate concentrations were 0, 0.18, 0.35, 0.88, 1.76, 3.52, 8.82 and 17.65 mmol·L-1, respectively
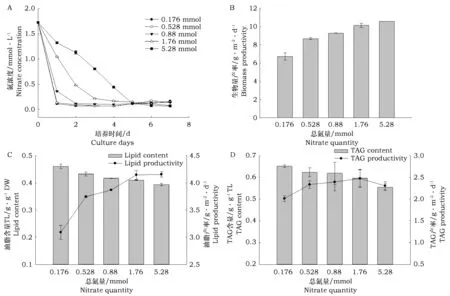
图5 不同总氮量条件下(A)培养基中氮浓度变化以及总氮量对栅藻(培养7 d)(B)生物量、(C)总脂和(D)TAG 积累的影响Fig.5 (A)Variation of nitrate concentration during 7 days cultivation, the(B)biomass,(C)total lipid and(D)TAG accumulation of S. obliquus under different nitrate quantities after 7 days cultivation
产率的前提下,减少总氮量和用水量是可行的。图5 C显示栅藻中的油脂含量与总氮量呈负相关关系,总氮量越少,油脂含量越高,油脂产率会随着溶液中总氮量的升高而升高,但当总氮量大于0.176 mmol时,油脂产率上升幅度并不大。图5 D显示TAG含量变化与油脂含量变化相似,即随着总氮量的增加呈下降趋势,但这种趋势并不十分明显。而且除了第一组(0.176 mmol)外,TAG产率随总氮含量的变化也不明显,大约都在2.3 g·m-2·d-1附近波动。上述试验结果表明,1.76 mmol 的总氮量可以使得160 cm2的微藻贴壁生长总脂和TAG培养7 d的产率达到峰值,溶液中过量的氮不仅造成
栅藻在不同总氮量条件下对培养液中的氮利用情况见表1。氮利用率(η)为培养7 d后细胞中的氮含量增量与初始培养基中的氮含量总量的比值,培养基氮损失率(σ)是描述培养基中既没有被藻细胞同化吸收也没有在培养基中残留的参数。氮利用率和培养基氮损失率计算公式如下:
η=(Mend×Wend-Mini×Wini)/14/(Cini×V)
(6)
σ=1-η-Cend/Cini
(7)

表1 栅藻在不同总氮量条件下对氮的利用情况Table 1 The nitrogen utilization property of S. obliquus under different nitrate quantities
其中,Wini和Wend分别为培养开始与结束时反应器中细胞总生物量干重/mg,Mini和Mend分别为培养开始与结束时细胞中氮元素占细胞干重的比例,Cini和Cend分别为培养开始与结束时培养基中氮浓度/mmol·L-1,V为培养基体积/L。本试验中Wini、Mini和Cini分别为(150.08±1.13)mg、(9.42%±0.05%)DW和(1.73±0.01)mmol·L-1。
由表1可以看出,溶液中总氮量的变化会引起藻细胞中氮含量也发生变化,在所有试验组中,细胞中氮含量都有所下降,而且溶液中总氮量越少,下降幅度越大。细胞中氮含量下降可能是由于细胞在缺氮环境下会消耗自身的氮来维持生长或积累代谢产物。当溶液中总氮量为0.528 mmol时,细胞对氮的利用率最高,由此说明,在一定范围内,溶液中总氮量升高或降低也会降低细胞对氮的利用率,而且所有试验组中都有不同程度的氮损失。
由以上试验可知,1 L含1.76 mmol总氮量的培养基可以足够支撑160 cm2栅藻贴壁生长和油脂积累。
3 讨论与结论
氮元素在光合作用中起着至关重要的作用,参与氨基酸、嘌呤、嘧啶、胺化合物和叶绿素等的合成。对于光合自养的微藻一般可以利用硝酸盐、亚硝酸盐和铵盐等无机盐作为氮源,氮源的浓度对微藻的生长和油脂积累有显著影响[26]。一般情况下,提高氮源浓度会促进藻类快速生长积累大量生物量而油脂含量较低,虽然降低氮源浓度不利于生物量的增加,但是却会刺激微藻大量积累油脂[27]。鉴于这种情况,很多前期的研究会采用“两步法”提高微藻中的油脂产量,具体方法为先将微藻置于合适的氮源且氮源浓度较高的培养基中积累大量生物量,等生物量积累到一定程度再降低培养基中的氮源浓度刺激微藻产油,但是这种方法一般周期较长,不利于大规模微藻生物柴油制备。为了缩短产油周期同时又可以获得较高的油脂产量,“一步法”即选择合适的氮浓度使得在不明显影响微藻生物量的前提下又可以大量积累油脂被广泛采用,这种方法的可行性和优势也被许多研究证实,但是选取合适的氮浓度是这种方法里最关键的因素,需要进行优化试验才能获取。由本文试验结果可知,在贴壁条件下,“一步法”产油是可行的,当氮源(NaNO3)浓度为1.76 mmol·L-1时,栅藻生物量和油脂积累可同时进行,且在该浓度下,栅藻的总脂和TAG产率达到最大值。
在传统的微藻液体悬浮式培养模式中耗水量巨大,研究结果显示使用开放池系统生产1 kg生物量需要2 857 L水[28],开放池和平板密闭式光生物反应器培养微藻单位面积需水量分别为300和 100 L·m-2[28]。本文研究结果证实微藻在贴壁培养培养时,在不明显影响生物量产率的前提下,减少总氮量和用水量是可行的。而且有研究表明微藻贴壁培养的单位面积需水量(60 L·m-2)有望在继续优化后降低到< 2 L·m-2[29, 30]。
在研究总氮量对栅藻生物量和油脂积累影响的所有试验组中都有不同程度的氮损失(表1),其原因可能是滤纸和滤膜中有残留氮,或者是溶液中存在一些反硝化细菌等能通过反硝化作用将溶液里的部分硝酸盐转化为氨、氮气或氮氧化物排走[31~33]。
本研究证明贴壁培养模式下,培养基中氮元素对栅藻细胞生长有重要影响,生物量积累随恒定氮浓度的升高而升高,而油脂却相反,但是在某一特定氮浓度下(1.76 mmol·L-1)油脂产率会达到最高值。最佳供氮策略为:在培养基循环的方式下,60 L氮浓度为1.76 mmol·L-1(为正常BG-11中氮浓度的1/10)的BG-11可使1 m2接种量为10 g·m-2的栅藻的总脂和TAG产率达到最大,同时生物量产率也可达到一个较高值。这个策略不仅可以达到“一步法”产油的目的,而且如果应用于多层贴壁培养模式的话,可成倍提高油脂产率。本研究是最终实现微藻贴壁培养产业化的重要基础,能为设计和建造高效的、适合规模生产的贴壁培养系统和营养元素调控及利用和水耗节约等方面调控工艺提供理论支撑。
