IL-12重组质粒联合骨髓间充质干细胞对MCF-7人乳腺癌细胞侵袭及裸鼠移植瘤生长的影响分析
2018-10-22张睿崔乐
张睿 崔乐
作者单位:438200 黄冈,浠水县人民医院甲乳外科1;430000 武汉,华中科技大学同济医学院附属普爱医院甲乳外科2
白细胞介素-12(IL-12)是目前发现的一种对免疫活性细胞诱导以及调节作用较强的细胞因子,研究显示,IL-12能够有效促进NK细胞以及T细胞的活化,促进干扰素-γ(IFN-γ)的产生,从而对肿瘤血管生成具有抑制作用,因此IL-12对多种肿瘤的治疗均具有重要的作用[1-2]。近些年来,骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSC)相关研究已经成为了生物医学研究领域的研究热点,BMSC目前已经广泛应用于神经系统、心血管系统、自身免疫疾病、消化系统以及肿瘤等方面的基础研究[3]。在肿瘤治疗方面,BMSC作为一个新兴的载体受到了越来越多研究者的关注,BMSC具有着较低的免疫原,作为基因治疗载体,外源性基因转染至BMSC操作较为简单且转染率高[4-5]。本研究探讨分析IL-12重组质粒(pcDNA6/ IL-12)联合BMSC对MCF-7人乳腺癌细胞侵袭及裸鼠移植瘤生长的影响,现报道如下。
材料与方法
一、材料
1.实验动物:MCF-7人乳腺癌细胞株购于中国科学院上海细胞库。BALB/c裸鼠,4周龄,雌性,SPF级,购自中国人民解放军军事医学院卫生学环境医学研究所。pcDNA6/IL-12质粒由华中科技大学同济医学院创建并保存。
2.主要试剂及仪器:1640(美国Hyclon公司);DMEM-F12培养基(美国Hyclone公司);澳洲胎牛血清(美国Gibco公司);胰蛋白酶(美国Gibco公司);青霉素-链霉素(美国Hyclone公司);CCK-8细胞增殖检测试剂盒(日本同仁);Annexin V-FITC/PI双染细胞凋亡检测试剂盒(碧云天生物技术有限公司);倒置相差显微镜(日本Olympus公司);流式细胞仪(美国Becton Dickinson公司)。
二、实验方法
1.BMSC原代培养:参照文献方法[6],取3 ~ 4周龄雄性昆明种小鼠,处死后剥离股骨和胫骨,剪开骨两端后使用含有150 ml/L胎牛血清、双抗的DMEM-F12完全培养基反复冲洗骨髓腔。冲洗后的培养基接种于培养瓶内,置于培养箱内培养。间隔8 h换液1次,连续3次后,每3天半量换液1次,直至细胞达到70﹪左右融合,进行传代培养。BMSC经细胞形态学及茜红素染色鉴定。
2.BMSC条件培养基制备:经上述培养分离,纯化至第三代的小鼠BMSC,生长至70﹪融合时,弃去上层培养液,使用无血清的DMEM-F12培养基清洗1遍,然后加入DMEM-F12完全培养基继续培养48 h,收集上清液,9.18×g离心5 min,吸取上清液,使用0.22 μm滤器过滤后备用。
3.脂质体Lip 2000转染:脂质体 Lip 2000 转染重组质粒pcDNA6/IL-12将培养后的BMSCV细胞消化离心,缓慢吹打,制成密度为1×105个/ ml的细胞悬液,而后将细胞悬液中细胞接种于DMEM-F12培养皿内,在细胞达到50﹪~ 80﹪融合后,将培养基换成无血清培养基,后续操作在转染前1 d,换无血清培养基培养1 d,按脂质体Lip 2000转染试剂盒操作说明进行操作。具体为:分别取4 μg 质粒、10 μl脂质体 Lip 2000 溶于 200 μl无血清无双抗培养基中为A、B液,孵育5 min后混匀,室温继续孵育25 min,经过转染前准备后,将混合液缓慢加入BMSC细胞培养液中,摇匀37 ℃孵育10 ~ 20 h。
4.BMSC对MCF-7细胞增殖的影响:取对数生长期的MCF-7细胞,将其接种于96孔细胞培养板内,常规培养24 h,然后将制备的BMSC条件培养基与1640完全培养基按照1 : 1比例混合。每孔加入100 μl,每组设置3个复孔,继续培养24、48和72 h后,参照CCK-8试剂盒说明书检测MCF-7细胞增殖情况。
5.BMSC对MCF-7细胞凋亡的影响:取对数生长期的MCF-7细胞,将其接种于6孔培养板内,培养24 h。将制备的BMSC条件培养基与1640完全培养基按照1:1比例混合,每孔加入混合培养基1 ml,培养24、48和72 h后收集细胞进行检测,每个实验重复3次。采用流式细胞技术检测各组细胞凋亡情况,参照Annexin V-FITC/PI双染细胞凋亡检测试剂盒使用说明书进行。
6.BMSC、pcDNA6/IL-12MCF-7细胞侵袭能力影响:将MCF-7细胞悬液37 ℃培养过夜后,于第2天观察细胞贴壁生长状态,如果细胞贴壁生长,则用移液枪头在贴壁生长的孔中间划痕,而后用PBS将被划下的细胞清洗干净,而后使用PBS、BMSC、BMSC联合pcDNA6/IL-12分别加入划痕两侧细胞中,培养24 h后拍照观察。
7.BMSC联合pcDNA6/IL-12对裸鼠转移瘤的影响:取对数生长期MCF-7细胞,调节细胞数为5×107个/ml,与裸鼠右前腋窝部皮下接种0.1 ml,待肿瘤直径达到5 ~ 8 mm时,将裸鼠随机分为4组,每组6只。分别为对照组、BMSC组、IL-12组以及联合组,其中对照组裸鼠瘤内注射100 μl PBS,每3天注射1次,共注射3次;BMSC组裸鼠瘤内注射 100 μl的 1×106BMSC,每 3天注射 1次,共注射3次;IL-12组裸鼠瘤内注射pcDNA6/IL-12质粒60 μg,每3天注射1次,共注射3次;联合组裸鼠瘤内分别注射100 μl的1×106BMSC+pcDNA6/ IL-12质粒60 μg,每3天注射1次,共注射3次。每隔2天测量裸鼠肿瘤短径(a)以及长径(b),计算肿瘤体积,并绘制各组小鼠肿瘤生长曲线,肿瘤体积 (mm3) = a2b/2。15 d后处死裸鼠,取出裸鼠肿瘤以及脾脏,称量各组裸鼠肿瘤以及脾脏重量,并计算各组脾指数,脾指数=脾质量/体质量。
三、统计学分析方法
采用统计学软件SPSS 22.0对数据进行处理分析,细胞增殖抑制率、细胞凋亡率、肿瘤体积、肿瘤质量、脾指数采用± s表示,两组间细胞增殖抑制率、细胞凋亡率、肿瘤体积、肿瘤质量、脾指数比较采用独立t检验,3组及以上细胞增殖抑制率、单因素细胞凋亡率、肿瘤体积、肿瘤质量、脾指数比较采用单因素方差分析,以P< 0.05为差异具有统计学意义。
结 果
1.BMSC对MCF-7细胞增殖的影响:24、48、72 h BMSC条件培养基对MCF-7细胞增殖抑制 率 分 别 为(13.42±1.93)﹪,(16.83±1.77)﹪,(20.21±2.01)﹪。BMSC条件培养基能够抑制MCF-7细胞增殖,且随着作用时间的延长其抑制作用升高(F= 6.271,P< 0.001)。
2.BMSC对MCF-7细胞凋亡的影响:24、48、72 h BMSC条件培养基对MCF-2细胞凋亡率 分 别 为(10.82±2.18)﹪,(18.73±2.95)﹪,(28.15±3.52)﹪,BMSC条件培养基处理MCF-7细胞,可有效促进MCF-7细胞凋亡,且随着作用时间的延长细胞凋亡率升高(F= 9.215,P< 0.001,图 1)。
3.细胞划痕实验:与仅用PBS处理的MCF-7乳腺癌细胞相比,使用BMSC以及联合BMSC和pcDNA6/IL-12处理MCF-7细胞后,细胞迁徙能力降低(图 2)。
4.BMSC联合pcDNA6/IL-12对裸鼠转移瘤的影响:与对照组比较,BMSC组、IL-12组以及联合组裸鼠肿瘤体积生长速度减慢(P< 0.05,表1,图3)。处死各组裸鼠后,BMSC组、IL-12组以及联合组裸鼠肿瘤质量低于对照组(P< 0.05),且联合组裸鼠肿瘤质量最低(P< 0.05);而 BMSC 组、IL-12组以及联合组裸鼠脾指数高于对照组(P< 0.05),且联合组裸鼠脾质量最高(P< 0.05,表 2,图 4)。
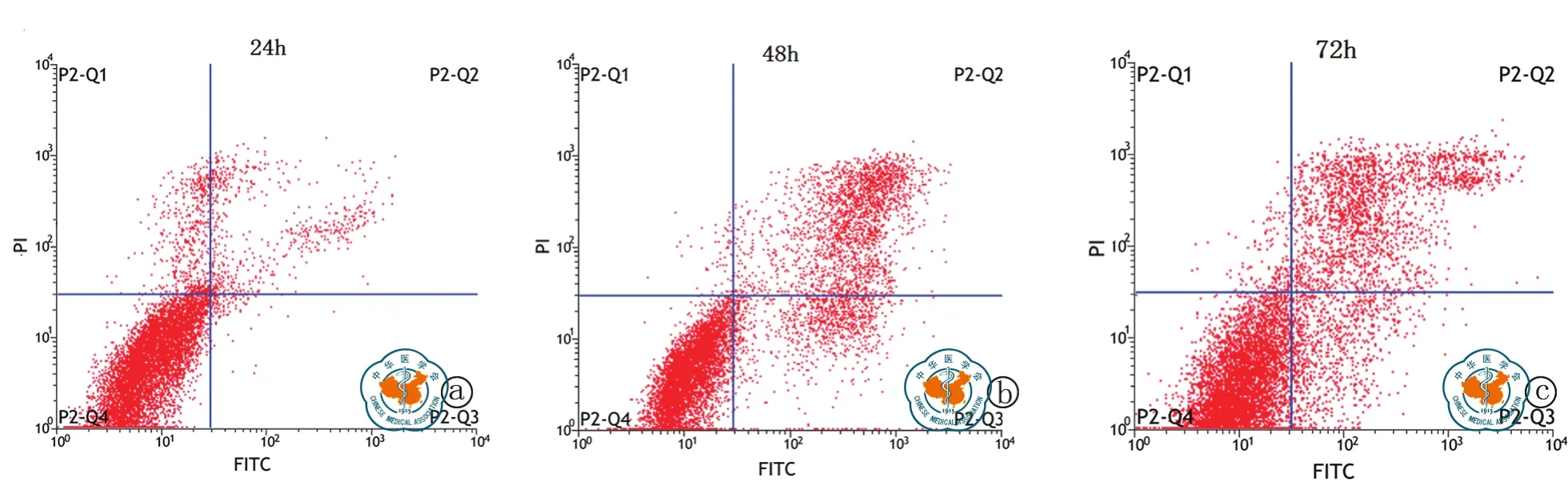
图1 BMSC条件培养基不同时间处理MCF-7细胞凋亡率

图2 倒置相差显微镜下观察细胞划痕实验(×200)
图3 正常视野下的三组裸鼠肿瘤

图4 正常视野下的三组裸鼠脾脏
表1 不同时间内各组裸鼠肿瘤体积变化 (mm3,± s)
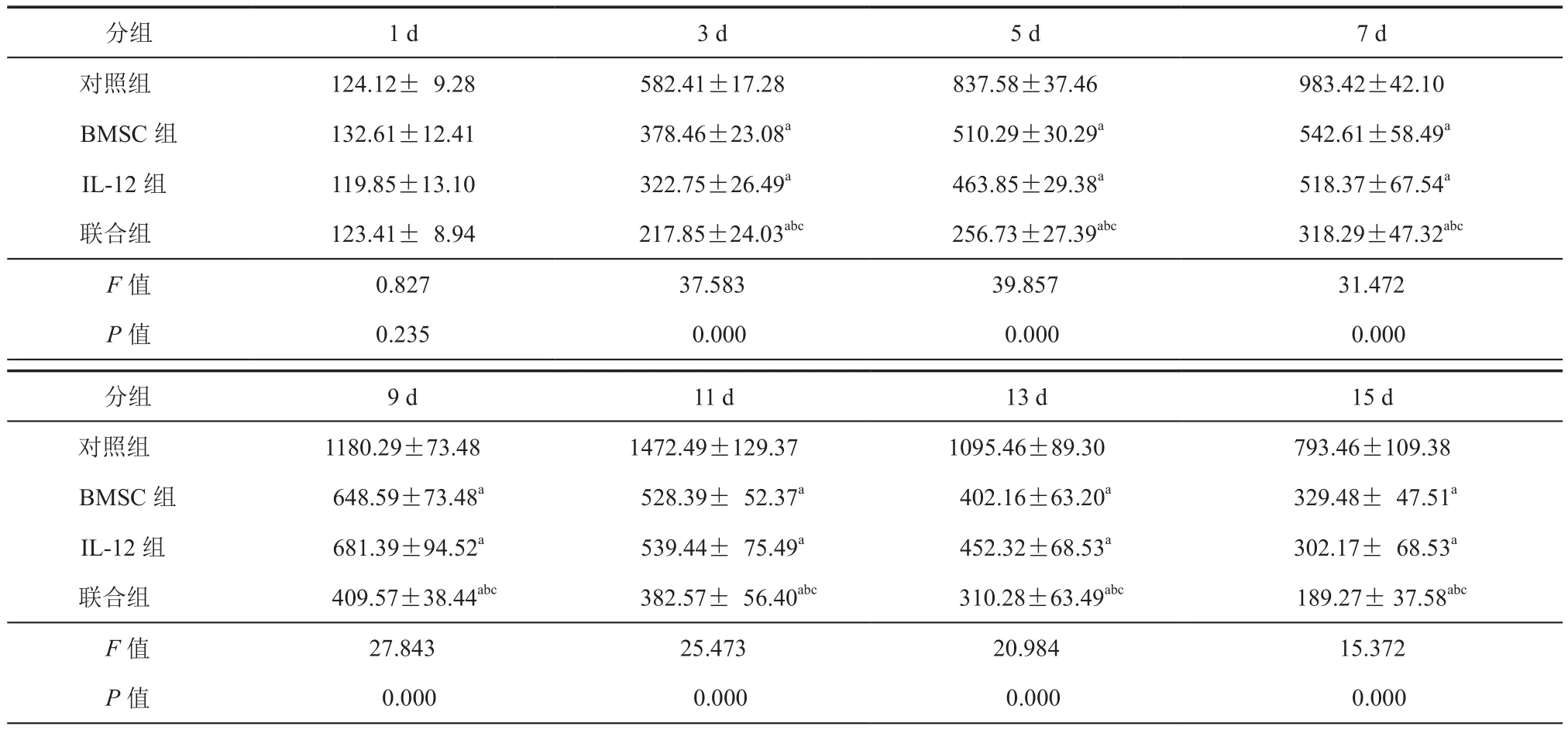
表1 不同时间内各组裸鼠肿瘤体积变化 (mm3,± s)
注:与同期对照组比较,aP < 0.05;与同期 BMSC 组比较,bP < 0.05;与同期 IL-2 组比较,cP < 0.05
分组 1 d 3 d 5 d 7 d对照组 124.12± 9.28 582.41±17.28 837.58±37.46 983.42±42.10 BMSC组 132.61±12.41 378.46±23.08a 510.29±30.29a 542.61±58.49a IL-12 组 119.85±13.10 322.75±26.49a 463.85±29.38a 518.37±67.54a联合组 123.41± 8.94 217.85±24.03abc 256.73±27.39abc 318.29±47.32abc F值 0.827 37.583 39.857 31.472 P值 0.235 0.000 0.000 0.000对照组 1180.29±73.48 1472.49±129.37 1095.46±89.30 793.46±109.38 BMSC 组 648.59±73.48a 528.39± 52.37a 402.16±63.20a 329.48± 47.51a IL-12 组 681.39±94.52a 539.44± 75.49a 452.32±68.53a 302.17± 68.53a联合组 409.57±38.44abc 382.57± 56.40abc 310.28±63.49abc 189.27± 37.58abc F值 27.843 25.473 20.984 15.372 P值 0.000 0.000 0.000 0.000
表2 各组裸鼠肿瘤质量及脾指数比较( ± s)

表2 各组裸鼠肿瘤质量及脾指数比较( ± s)
注:与对照组比较,aP < 0.05;与 BMSC 比较,bP < 0.05;与 IL-12组比较,cP < 0.05
分组 肿瘤质量(mg) 脾指数对照组 877.42±120.11 5.37±0.89 BMSC 组 529.42± 98.74a 7.58±1.21a IL-12组 544.01±117.85a 7.63±1.09a联合组 327.55±78.56abc 10.03±1.52abc F值 10.821 13.411 P值 0.000 0.000
讨 论
乳腺癌是全世界女性最为常见的一种恶性肿瘤,根据世界卫生组织国际癌症研究中心相关统计数据显示,我国女性乳腺癌标化发病率为21.6/10 万,标化死亡率为5.7/10万,我国每年女性乳腺癌新增病理多达16.9万,占全球总发病例数的12.25﹪,列居世界第二[1]。目前常规的治疗方法包括手术治疗、化疗、放疗以及生物治疗等,虽然随着现代医疗技术不断提高,但患者仍存在严重的不良反应而影响疗效[8]。
BMSC是一种中胚层多能干细胞,BMSC主要存在于结缔组织以及器官间质中[9]。近年来,学者研究显示[10-13],BMSC具有明显的抗肿瘤作用,可抑制结肠癌、肝癌、卵巢癌、乳腺癌和黑色素瘤等肿瘤细胞增殖。本研究制备BMSC条件培养基,分析BMSC对MCF-7人乳腺癌细胞增殖的影响,结果显示,BMSC条件培养基对MCF-7细胞增殖具有抑制作用及促凋亡作用。与相关研究结果相似[14],表明BMSC可促进乳腺癌细胞凋亡而发挥其肿瘤抑制作用,可能由于BMSC条件培养基中存在抑制肿瘤细胞增殖及促进肿瘤细胞凋亡的相关因子,但是其具体影响机制,还需要进一步研究分析。但是关于BMSC对肿瘤作用机制,仍然存一定的争议,学者提出,BMSC对肿瘤的抑制作用可能依赖免疫机制的参与,而IL-12是重要的免疫细胞因子之一,研究证实,pcDNA6/IL-12具有明显的抗肿瘤作用[15-17],本研究探讨分析pcDNA6/IL-12联合BMSC对MCF-7乳腺癌转移瘤的影响作用。研究结果显示,二者联合使用,能够有效抑制裸鼠转移瘤的生长,且促进裸鼠脾指数的提高,表明pcDNA6/IL-12联合BMSC肿瘤抑制具有协同作用,同时其作用机制可能与免疫机制影响有关。学者报道显示[18],转染IL-12后的人源骨髓干细胞能够促进特异性T细胞活性的增强,且其抗肿瘤效果比转染IL-12的重组腺病毒更佳,这与本研究结果相似。
间充质干细胞在肿瘤治疗过程中,具有一定的损伤修复功能。在肿瘤损伤的部位,间充质干细胞可以发生类似于基质细胞样的分化,如内皮细胞、纤维细胞等,同时间充质干细胞能够分泌某些基质蛋白以及细胞因子促进血管的生成,从而发挥损伤修复作用[19]。但是也有学者认为[20],这种损伤修复作用存在着促进肿瘤生长与肿瘤转移的风险,但是其具体的机制和影响作用目前尚无统一的认识,还需要更进一步的研究分析。
综上所述,BMSC在体内外均具有抑制MCF-7肿瘤增殖作用,对于裸鼠MCF-7转移瘤模型,BMSC条件培养基联合pcDNA6/IL-12具有着明显的协同抑制作用,关于BMSC对肿瘤的影响机制,还需要进一步研究深入分析。
