NGF及其受体在雄鸡睾丸组织中的定位及表达
2018-10-20李丽芳贾球锋李嘉威张瑞强
李丽芳,贾球锋,乔 琳,张 晋 ,李嘉威 ,张瑞强
(1.山西农业大学信息学院,山西太谷030800;2.山西农业大学动物科技学院,山西太谷030801)
神经生长因子(Nerve Growth Factor,NGF)是大约在60 a前首次被发现可诱导神经生长的蛋白质,对产前感觉神经和交感神经的生长必不可少[1]。许多资料报道,NGF除具有对神经元的作用外,还具有多方面的生物学效应,目前也有研究表明,NGF还与阿尔茨海默病和顽固性疼痛有关[2],其广泛分布于神经系统、生殖系统、内分泌系统、循环系统和免疫系统等。而NGF发挥效应是通过NGFR(神经生长因子受体)介导的,已发现NGF有2种受体,Trk为高亲和力受体,P75为低亲和力受体。P75受体在细胞生殖及凋亡中有双重作用[3-4]。研究发现,在雄性动物的生殖系统中NGF及NGFR均有不同程度的表达,它们可以通过自分泌和旁分泌途径对生殖器官的生长、发育及功能起重要的调控作用[5]。通过对不同物种的研究发现,NGF的表达在物种间存在一定的差异性。有关NGF在生殖系统中的研究主要以哺乳动物为主[6-9],禽类相关的研究内容报道较少。
本研究采用Western blot技术及免疫组织化学技术对雄鸡睾丸组织NGF及其受体P75的定位及表达情况进行研究,探讨NGF及P75蛋白在雄鸡睾丸组织中的表达规律及其在雄性生殖系统机能调节中所起的作用。
1 材料和方法
1.1 材料
1.1.1 试验动物 分别于14,20,24,35周龄时对山西省太谷县回马村一养鸡场同批次饲养的雄鸡采样,每次取4只重复,共取16只。宰杀后取睾丸组织,一部分经液氮速冻处理后,暂存于-80℃冰箱,用于提取总蛋白;另取一部分立刻投入Bouins固定液中,用于组织切片的制作。
1.1.2 试剂 组织裂解液RIPA(含PMSF),购自北京Solarbio公司。一抗(多克隆兔抗NGF和P75抗体)、二抗,均购自北京博奥森生物技术有限公司。DAB试剂盒购自天津灏洋生物制品科技有限责任公司,ECL显色液购自上海碧云天生物技术有限公司,其余为常规试剂。
1.2 方法
1.2.1 总蛋白提取及Western blot鉴定 称取组织样品约0.1 g,加入液氮研磨成粉末,之后加入1 mL RIPA裂解液,冰上裂解约30 min,期间多次振荡混匀,12 000 r/min,4℃离心5 min后取上清,吸取50 μL用微量蛋白测定仪测定蛋白含量。每孔加入约20 μg蛋白样品进行SDS-PAGE电泳分离,然后再经100 mA,100 min冰浴作用将蛋白转移至NC膜上,封闭液封闭2 h。加入兔抗NGF及P75蛋白抗体(1∶1 000),4℃孵育过夜。次日TBS-T洗膜3次,每次 8 min。二抗(1∶5 000)室温孵育 2 h,TBS-T洗膜3次,每次8 min。最后用ECL显色液显色并拍照保存。
扫描NC膜,应用FluorChem Q SA软件对结果进行分析,以β-actin为内参与目的比较进行半定量分析,计算公式如下。

1.2.2 免疫组织化学技术 取经Bouins固定的睾丸组织,石蜡包埋,切片脱蜡至水,PBS缓冲液漂洗3次,每次5 min,滴加3%H2O2在室温条件下孵育15 min,以消除组织中存在的内源性过氧化物酶,PBS缓冲液冲洗3次,每次3 min,用A液(正常山羊血清工作液)封闭后滴加一抗(均为1∶300),阴性对照用PBS缓冲液代替一抗,4℃过夜,PBS缓冲液冲洗3次,每次3 min,再滴加B液(生物素标记的山羊抗兔IgG工作液),PBS缓冲液冲洗3次,每次3 min,滴加C液(辣根酶标记链霉卵白素工作液),PBS缓冲液冲洗3次,每次3 min,DAB显色,苏木精复染,常规石蜡切片脱水、树胶封片。显微镜下观察、拍照。
2 结果与分析
2.1 Western blot检测结果分析
Western blot结果显示,雄鸡睾丸组织总蛋白中存在能与兔抗NGF和兔抗P75抗体发生免疫阳性反应的蛋白条带,P75分子质量大小约为75 ku,NGF分子质量大小约为26 ku(图1)。本试验结果显示,NGF及其受体在雄鸡睾丸内不同发育阶段均有表达,所用一抗特异性好。
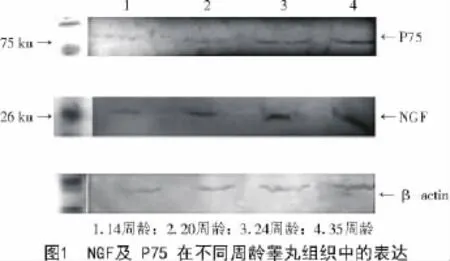
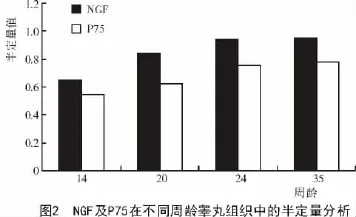
通过FluorChem Q SA软件分析灰度值,由图2可知,NGF及P75受体蛋白含量随日龄增加呈递增趋势,但P75受体蛋白增加的阶段性不如NGF明显,且在35周龄左右接近峰值。
2.2 免疫组织化学检测结果分析
NGF及其受体P75免疫组织化学染色结果如图3所示,雄鸡睾丸组织的曲细精管在性成熟前以圆筒形为主,性成熟后以椭圆型为主。支持细胞呈不规则形,曲细精管与间质细胞的联系并不紧密,且间质细胞不发达。NGF及P75蛋白在各发育阶段均有阳性反应,且均匀分布于核周细胞质中,对照组未观察到阳性细胞。
14周龄雄鸡睾丸组织内曲细精管腔不明显,主要为精原细胞、支持细胞及少量间质细胞所构成。精原细胞大多成群排列,精原细胞和支持细胞的界限不明显。NGF及P75蛋白特异性免疫产物主要集中在支持细胞和精原细胞,间质细胞含量较少。
20周龄开始随着睾丸组织发育,曲细精管直径增加,开始出现空腔。NGF及P75蛋白特异性免疫产物主要集中在各级生精细胞、支持细胞及间质细胞。
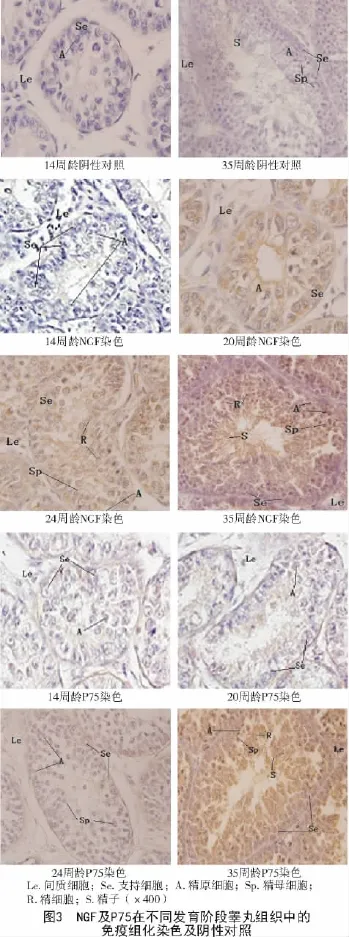
从20周龄至24周龄基本达到性成熟,并在35周龄达到最高峰。睾丸组织内曲细精管管腔已十分明显,可见各级精细胞及成熟精子,精原细胞呈多层排列。NGF及P75蛋白特异性免疫产物在各细胞中均可见。
对照组试验切片中NGF及P75蛋白免疫反应均为阴性。
3 讨论
近年来,对NGF在非神经组织内的研究越来越多,NGF在生殖系统的作用也逐渐被揭示出来。BRIAN等[10]在1991年提出,睾丸不仅具有生精功能,同时也具有内分泌功能。它能够通过产生肽类生长因子,以自分泌和旁分泌的作用方式,参与细胞的生长、发育与成熟过程,且其中NGF的潜在作用可能是介导细胞间的相互作用。同时附睾也具有内分泌功能,可通过分泌雄激素对储存的精子的成熟和获能起重要作用。研究发现,染氟可使大鼠附睾的内部结构出现不同程度的损伤,从而影响其功能[11]。吴建云等[12]在对大鼠睾丸组织中NGF的表达研究中发现,睾丸间质细胞能够分泌NGF,并通过与间质细胞、生精细胞上的受体相结合,对睾丸的发育、组织形态的完善、生殖细胞的发生等起调节作用。
RUSSO等[13]于1999年在对NGF和其受体在小鼠胚胎期和发育过程(1,5,10,20 d)中睾丸组织的表达的动态观察中发现,NGF及其受体的主要表达部位会随日龄增加发生变化,早期主要存在于支持细胞,后期则存在于间质细胞、管周样细胞。LI等[6]对大鼠的研究表明,NGF主要位于间质细胞及初级和次级精母细胞,在输精管的上皮细胞和促性腺的上皮细胞中也存在着表达,而在成熟精子和支持细胞中呈阴性反应。CUPP等[14]研究了胚胎期和出生后0~5 d的大鼠睾丸组织中的NGF及其受体的表达情况,结果表明,早期NGF及其受体主要存在于支持细胞,而后期则存在于间质细胞和各级生精细胞中。这些研究表明,NGF及其受体在睾丸发育的不同阶段均有表达,但表达部位有所不同。本试验结果显示,在睾丸发育阶段表达产物主要集中在支持细胞,少量见于精原细胞及间质细胞,随着鸡性成熟的完成,NGF及其受体的表达产物主要见于支持细胞、精原细胞、各级精母细胞及精子中,间质细胞中含量较少,这可能与鸡的睾丸间质细胞不发达有关。
LI等[6]通过免疫组织化学方法发现,在大鼠睾丸的间质细胞、初级精母细胞与粗线期精子细胞中都有NGF的表达,这与对日本猴[7]和人类[8]的研究结果是相近的。但对日本猴的研究还发现,NGF在睾丸的支持细胞也有表达。咸华等[15]采用RT-PCR技术对出生后 1,7,14,28,56 d 小鼠睾丸组织中NGF mRNA的表达量进行了研究,结果表明,出生后 1,7,14,28,56 d 的小鼠睾丸组织内均有 NGF mRNA的表达,且7d的表达量最高。胡永婷等[16]在对大鼠睾丸组织中NGF mRNA的研究中发现,NGF mRNA的表达量在21 d前呈上升趋势,21 d达到峰值后逐渐下降至成年时并维持在一定水平。李丽芳等[17]采用实时荧光定量PCR技术对雄鸡睾丸组织NGF mRNA的表达研究显示,NGF mRNA在性成熟发育期(20~24周龄)雄鸡睾丸组织中的表达量随日龄增加呈上升趋势,成年期(35周龄)有所下降。通过以上这些研究可以发现,NGF的表达在物种间存在一定的差异性。而在本试验中,NGF及P75的蛋白表达量随日龄增加而升高,且在35周龄基本达到峰值。
本研究以散养雄性土鸡为对象,分析了NGF及P75在睾丸组织中的定位和表达,所得结果为分析其与睾丸组织的生长发育、性激素的分泌、精子的产生等生理学过程的关系提供了依据,为禽类生殖生理学研究奠定了重要的理论基础,有助于阐明其在禽类生殖发育中发挥调节作用的分子机理。
