富锌微生物的筛选及其饲喂鸡的生物学效价评定
2018-10-19卫爱莲代张超丁小玲闫一博李吕木
卫爱莲 代张超 鲁 陈 丁小玲 刁 欢 闫一博 李吕木
(安徽农业大学动物科技学院,合肥230036)
锌是动植物及人类重要的必需微量金属元素,参与体内多种生化反应,如蛋白质的合成、DNA和RNA的代谢、信号传导、基因表达以及调节细胞的凋亡[1]。不仅如此,锌还在促进动物的生长、免疫[2]、繁殖及脑神经等方面起着重要的作用[3]。并且动物年龄越小,锌对动物的影响越大[4]。仔猪缺锌可导致生长受阻,皮肤出现不全角化症[5]。研究还发现,饲喂高于动物营养需要量的高锌饲粮,对鸡[6]、羊[7]、猪[8]等动物具有促生长作用,因而生产上普遍采用高锌饲粮[9]。由于无机锌价格低廉,硫酸锌(ZnSO4)等无机锌是常用的饲粮锌营养源。但用无机锌作为锌源,其吸收利用率低[10-11]且易造成环境的污染,所以寻找新的锌源迫在眉睫。因此,利用率较高的微生物锌受到了广泛重视。郭雪娜等[12]在402株酵母菌中筛选到了1株可以将硫酸锌高效转化为酵母锌的菌株,其锌含量可达9.3 mg/g。李宇兴等[13]筛选的富锌酵母,对无机锌的转化率达50%。Cha等[14]比较了酿酒酵母菌FF-10对氯化锌、氧化锌和硫酸锌等不同无机锌转化为微生物锌的效果,发现氯化锌转化效率更高。大鼠饲喂试验表明,酵母锌的利用率要高于硫酸锌[15]。随着国家不断加大环境保护的力度,为提高锌的在动物体内的利用率,降低粪尿中锌残留量,一些利用率高的锌源,如氨基酸螯合锌[16]等更受欢迎,但是由于其价格较高而限制了其在生产上的广泛应用。因此,研发价格低廉、制备方法简单的微生物锌源显得尤为必要。为此,本研究拟从实验室保存的饲用菌种中筛选出高效转化无机锌为微生物锌的菌株,以期开发出价格相对低廉的微生物锌,为绿色畜牧业的发展做出积极贡献。
1 材料与方法
1.1 菌株、试剂与试验动物
试验所用的16株饲用菌种,其编号分别为2、3、4、6、8、13、14、15、16、18、19、20、21、22、23、58,均为本实验室保存的菌株,其中乳酸菌1株,酵母菌12株,芽孢杆菌3株。锌标准液(国家有色金属及电子材料分析测试中心)、硫酸锌(西陇科学股份有限公司)、葡萄糖(烟台市双双化工有限公司)均为分析纯。试验鸡为健康的18周龄的海兰褐公鸡,购自安徽省合肥市长丰县安禽禽业有限公司。
1.2 培养基
1.2.1 酵母浸出粉胨葡萄糖琼脂(YPD)培养基
葡萄糖20 g,土豆200 g,pH自然,水1 L,若为固体培养基则加入20 g琼脂。
1.2.2 营养肉汤(NB)培养基
牛肉膏5 g,蛋白胨10 g,氯化钠5 g,水1 L,若为固体培养基则加入20 g琼脂。
1.2.3 乳酸细菌(MRS)培养基
蛋白胨10 g,牛肉膏10 g,酵母粉5 g,葡萄糖20 g,乙酸钠5 g,柠檬酸氢二胺2 g,吐温-80 1 mL,磷酸氢二钾2 g,七水硫酸镁0.2 g,七水硫酸锰0.05 g,若为固体培养基则加入20 g琼脂。
1.2.4 无机锌转化培养基
在YPD、NB和MRS培养基中加入相应浓度的硫酸锌,以上培养基的灭菌条件为121 ℃、15 min。
1.3 主要仪器
火焰原子吸收光谱仪(ZEEnit700p,德国耶拿分析仪器股份公司)、高速冷冻离心机(JW-3021HR,安徽嘉文装备有限公司)、恒温摇床(ZHP-250,上海三发科技有限公司)、烘箱(DGT-G82A,合肥达斯卡特科学有限公司)、消化炉(ML-3-4,上海科恒实业发展有限公司)。
1.4 锌含量的测定
1.4.1 标准曲线的绘制
按照GB/T 5009.14—2017《食品安全国家标准 食品中锌的测定》[17]中火焰原子吸收吸收光谱法绘制锌标准曲线。标准曲线的线性回归方程为:
Y=0.3026x+0.0127。
1.4.2 微生物锌含量的测定
待测培养液4 000 r/min离心5 min,弃去上清液,用超纯水配制0.9%的生理盐水,洗涤3次后收集菌体,在60 ℃烘箱中烘干至恒重,参照GB/T 5009.14—2017《食品安全国家标准 食品中锌的测定》[17]进行消化分解,再稀释5、10、20倍进行上机测定。
1.5 富锌微生物的筛选
取备选菌种按照各自的标准培养条件培养好后,分别接种到100 mL对应的PDA、NB和MRS液体培养基中,酵母菌于28 ℃、120 r/min振荡培养2 d,芽孢杆菌于37 ℃、120 r/min振荡培养1 d,乳酸菌于37 ℃静止培养2 d。然后在固体培养基中进行3次纯化,挑取菌株接入无机锌浓度为2 mg/L的对应的PDA、NB和MRS液体培养基中,酵母菌培养和芽孢杆菌培养3 d,乳酸菌培养4 d。培养结束用高速冷冻离心机对菌液进行离心(4 000 r/min、5 min),弃去上清液,再用去离子水冲洗3遍后在透析袋中透析,直至上清液中检测不出锌离子,再离心收集沉淀得到菌体,然后在60 ℃的烘箱中烘干至恒重[18]。以微生物转化无机锌为微生物锌的转化率为依据,筛选出对无机锌转化率高的菌株。
1.6 目标菌种培养条件的单因素优化
对无机锌浓度、培养温度、培养时间和菌液接种量4个因素依次进行优化,根据菌种对无机锌转化为微生物锌转化率的高低,筛选出最佳转化率的组合参数。以上一次筛选的最优转化率因素作为下一次最优转化率因素筛选时的条件。
1.6.1 无机锌浓度的优化
设置5个无机锌浓度,分别为2、4、6、8和10 mg/L,每个处理2个重复,菌液接种量为2%,28 ℃、120 r/min振荡培养72 h。
1.6.2 培养温度的优化
设置5个培养温度,分别为26、27、28、29和30 ℃,每个处理2个重复,无机锌浓度为1.6.1所确定的无机锌浓度,其余条件与1.6.1相同。
1.6.3 培养时间的优化
设置5个培养时间,分别为48、66、72、84和96 h,每个处理2重复,培养温度为1.6.2所确定的培养温度,其余条件与1.6.2相同。
1.6.4 菌液接种量的优化
设置5个菌液接种量,分别为1%、2%、3%、4%和5%,每个处理2重复,培养时间为1.6.3所确定的培养时间,其余条件与1.6.3相同。
1.7 目标菌种培养条件的正交优化
在单因素试验的基础上,采用L9(34)设计,对无机锌浓度(A)、培养温度(B)、培养时间(C)和菌液接种量(D)4因素进行3水平正交优化,进一步确定其将无机锌转化为微生物锌的最佳组合条件,每个处理3个重复。各因素水平为:无机锌浓度分别为1.5、2.0和2.5 mg/L,培养温度分别为27.5、28.0和28.5 ℃,培养时间分别为66、72和78 h,菌液接种量分别为2%、3%和4%。
1.8 无机锌转化微生物锌的转化率计算
微生物转化后菌体中的含锌量与培养基中添加的无机锌含量的百分比即为无机锌转化为微生物锌的转化率,其计算公式为:
转化率(%)=100×微生物转化后菌体中的含锌量/为培养基中添加的无机锌含量。
1.9 酵母锌饲喂鸡的相对生物学效价评定
将20只健康的18周龄的海兰褐公鸡随机分4组,即2个对照组和2个试验组,每组5个重复,每个重复1只,单笼饲养,各组间体重差异不显著(P>0.05)。对照组1和对照组2饲喂无机锌(ZnSO4·7H2O),饲粮锌含量分别为60和90 mg/kg;试验组1和试验2组饲喂酵母锌(为上述菌种转化的富锌酵母菌),饲粮锌含量也分别为60和90 mg/kg。预试期和正试期各5 d,每只鸡日定量饲喂100 g,于08:00和16:00分2次饲喂。采用全收粪法[19]测定饲粮锌的表观代谢率,进而计算出酵母锌中的锌相对于硫酸锌中锌的相对生物学效价。试验在安徽农业大学动物代谢室进行,采用玉米-豆粕型饲粮,饲粮组成及营养水平见表1,微量元素预混料组成见表2。
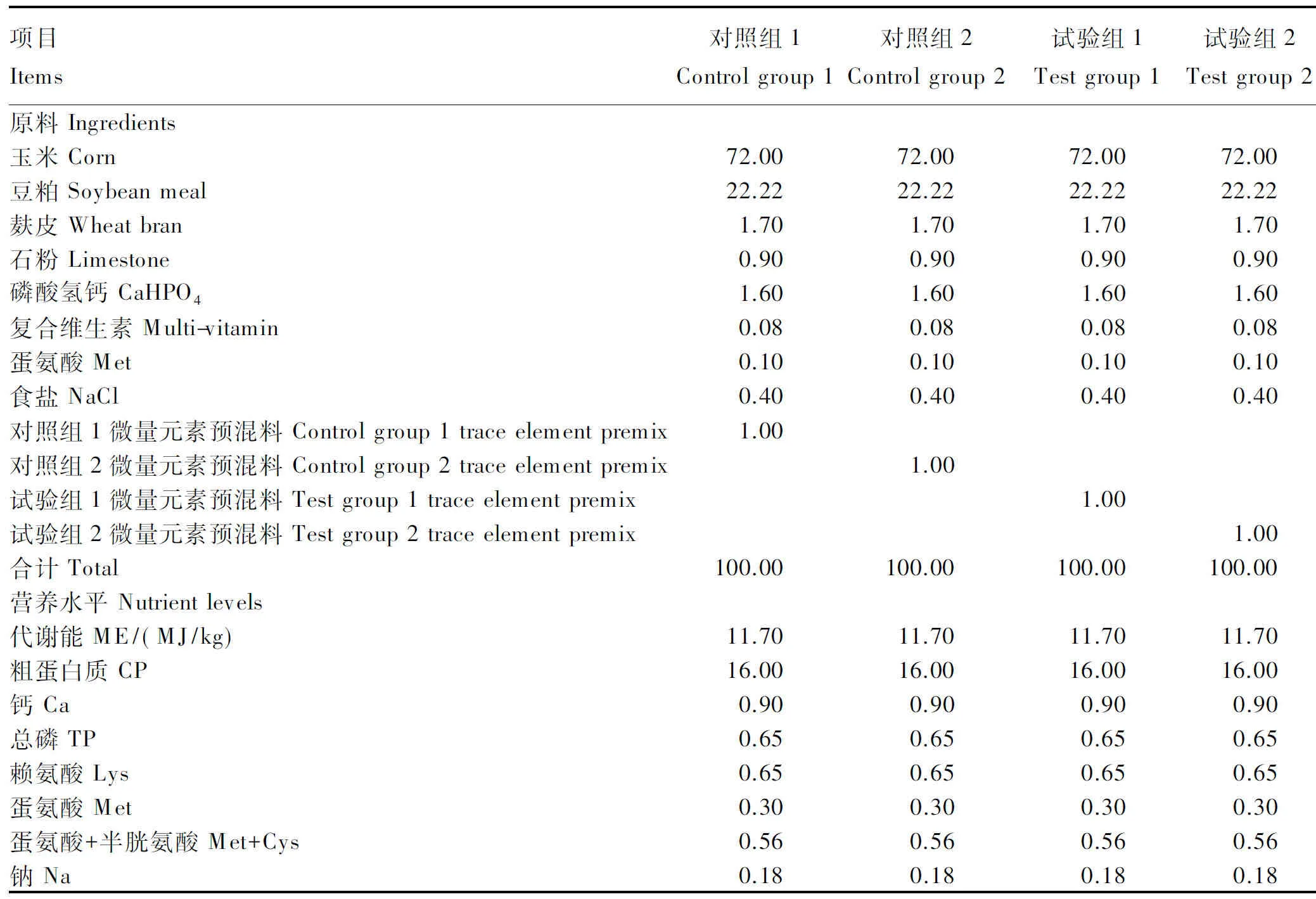
表1 饲粮组成及营养水平(风干基础)
每千克复合维生素含 Per kg multi-vitamin contained: VA 7 000 IU,VD38 000 IU,VE 30 IU,VC 5 mg,VB113 mg,VB230 mg,VB63 mg,叶酸 folic acid 3 mg,泛酸 pantothenic acid 20 mg,烟酸 nicotinic acid 30 mg。
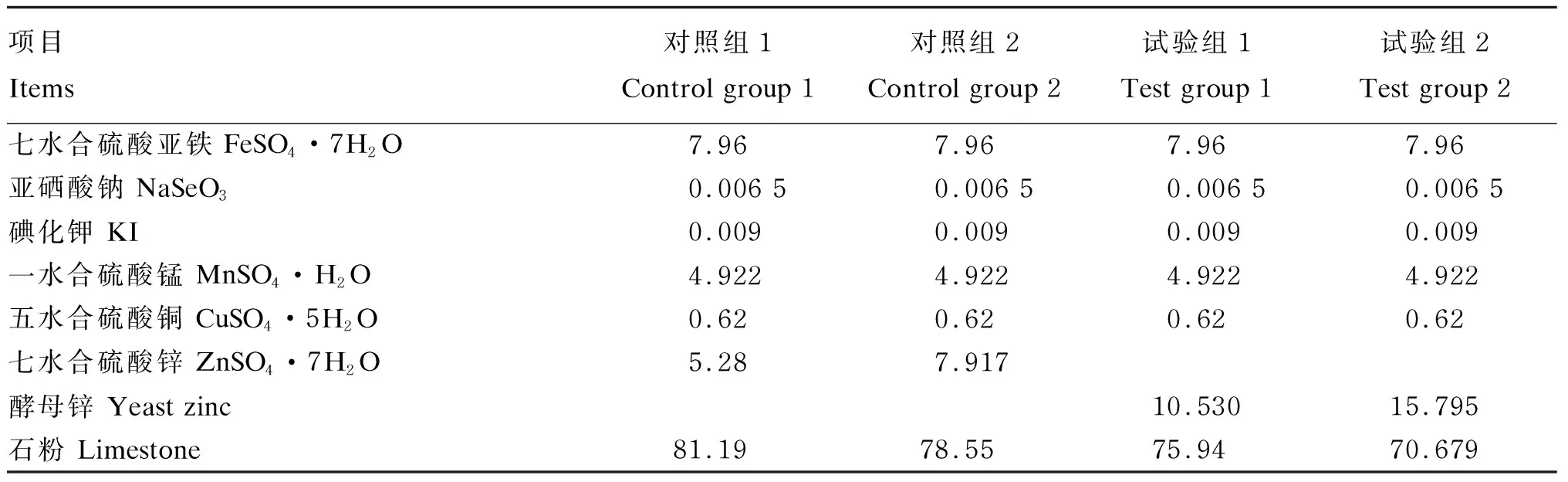
表2 微量元素预混料组成
酵母锌中锌含量 Zinc content of yeast zinc:11.396 mg/g。
锌的相对生物学效价的有关公式为:
每日锌食入量(g)=每日采食量×饲粮中锌含量;每日粪尿锌排出量(g)=每日粪尿排出量×粪尿中锌含量;每日锌存留量(g)=每日锌食入量-每日粪尿锌排出量;对照组食入锌增量(g)=对照组2食入锌量-对照组1食入锌量;对照组锌存留增量(g)=对照组2锌存留增量-对照组1锌存留增量;试验组食入锌增量(g)=试验组2食入锌量-试验组1食入锌量;试验组锌存留增量(g)=试验组2锌存留增量-试验组1锌存留增量;锌生物学利用率(%)=100×锌存留增量/食入锌增量;锌的相对生物学效价(%)=100×试验组锌生物学利用率/对照组锌生物学利用率。
1.10 数据分析
数据先用Excel 2007进行整理,再用SPSS 20.0进行分析。单因素试验数据进行单因素方差分析,正交试验数据进行方差分析及极差分析。所有试验结果均用平均值±标准差表示,显著水平为P<0.05。
2 结果与分析
2.1 菌株的筛选
从表3中可以看出,58号菌种(酿酒酵母菌)转化无机锌为微生物锌的转化率最高,达到了52.68%。因此,以58号菌种进行后续的研究,以下皆称该菌种为酿酒酵母菌。
2.2 单因素优化
2.2.1 无机锌浓度对酿酒酵母菌转化无机锌能力的影响
从表4中可以看出,酿酒酵母菌对无机锌的转化率随着无机锌浓度的增加而逐渐降低,当无机锌浓度为2 mg/L时,转化率最高,达到了64.48%,显著高于其他各组(P<0.05)。这说明无机锌浓度为2 mg/L时,酿酒酵母菌的富锌能力最好。
2.2.2 培养温度对酿酒酵母菌转化无机锌能力的影响
从表4中可以看出,随着培养温度的升高,酿酒酵母菌对无机锌的转化率先逐渐升高再逐渐降低。28 ℃时转化率最高,为76.87%,与26和30 ℃时差异显著(P<0.05),与27和29 ℃组差异不显著(P>0.05)。因此,选择28 ℃作为酿酒酵母菌转化无机锌的培养条件。
2.2.3 培养时间对酿酒酵母菌转化无机锌能力的影响
从表4中可以看出,培养时间为72 h时,酿酒酵母菌对无机锌的转化率最高,达到78.18%,显著高于48和66 h(P<0.05),然后随着培养时间的增加,转化率差异不显著(P>0.05)。因此,选择酿酒酵母菌转化无机锌的培养时间为72 h。
2.2.4 菌液接种量对酿酒酵母菌转化无机锌能力的影响
从表4中可以看出,随着菌液接种量的增加,酿酒酵母菌对无机锌的转化率先逐渐升高后降低,菌液接种量为4%时,酿酒酵母菌对无机锌的转化率最高,达到了78.57%,显著高于菌液接种量为1%和2%时(P<0.05)。随后再增加菌液接种量,酿酒酵母菌对无机锌的转化率不再增加,但与菌液接种量为3%时差异不显著(P>0.05)。因此,选择酿酒酵母菌转化无机锌的菌种接种量为4%。
由单因素试验设计结果可得知,酿酒酵母菌转化无机锌的最佳条件为:无机锌浓度2 mg/L,培养温度28 ℃,培养时间72 h,菌液接种量4%。

表3 16株饲用微生物菌种转化无机锌为微生物锌的转化率
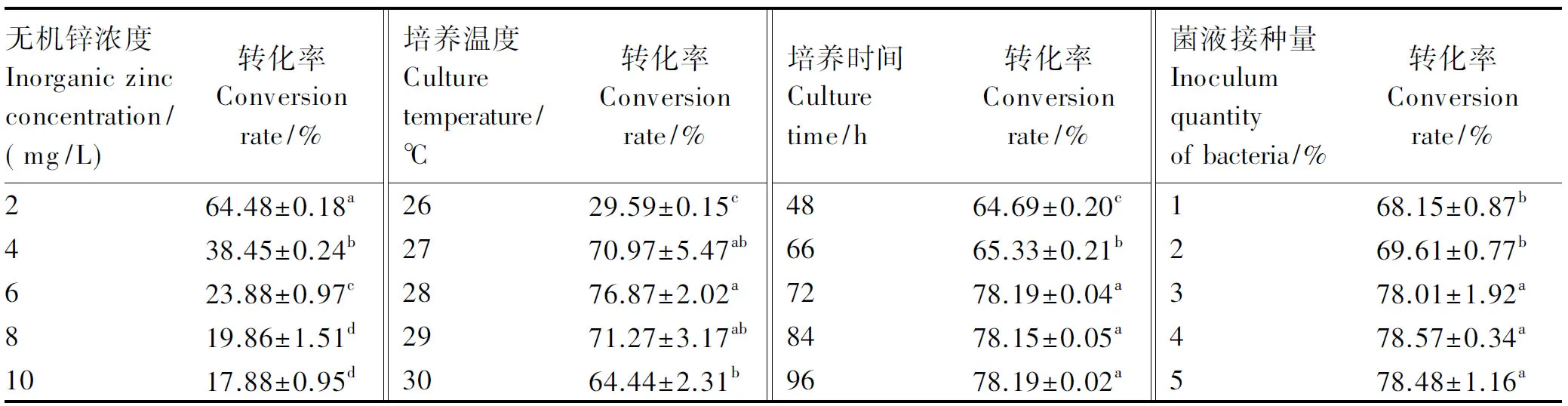
表4 无机锌浓度、培养温度、培养时间和菌液接种量对酿酒酵母菌转化无机锌能力的影响
同列数据肩标不同小写字母表示差异显著(P<0.05),相同小写字母表示差异不显著(P>0.05)。
In the same column, values with different small letter superscripts mean significant difference (P<0.05), while with the same small letter superscripts mean no significant difference (P>0.05).
2.3 正交优化
从表5中可以看出,影响试验结果因素的先后顺序为:A>B>D>C,即影响酿酒酵母菌转化无机锌能力的因素依次为无机锌浓度、培养温度、菌液接种量和培养时间。由K值可得出最佳组合为:A1B2C1D3,即无机锌浓度1.5 mg/L,培养温度28 ℃,培养时间66 h,菌液接种量4%。在此最优条件下进行正交的验证,其结果为无机锌的转化率达98.01%,高于所有正交试验的所有组合,证明该组合即为酿酒酵母菌转化无机锌的最优组合条件。
从表6中可以看出,无机锌浓度、培养时间和菌液接种量对转化率有极显著的影响(P<0.01),培养温度对转化率有显著的影响(P<0.05),各因素3水平之间差异显著(P<0.05)。
2.4 酵母锌饲喂鸡的相对生物学效价评定
从表7中可以看出,酵母锌中锌的生物学利用率比硫酸锌高10.33%,其相对于硫酸锌中锌的相对生物学效价为114.83%,表明该酵母锌是优于硫酸锌的一种锌添加剂。

表5 正交试验设计结果的极差分析

表6 Duncan氏多重比较结果
**表示因素各水平多重比较时差异极显著(P<0.01),*表示因素各水平多重比较时差异显著(P<0.05),同行数据肩标不同小写字母表示差异显著(P<0.05)。
** indicated extremely significant differences at each level of multiple comparisons (P<0.01), * indicated significant differences at each level of multiple factor comparisons (P<0.05), and values the same row with different small letter superscripts mean significant difference (P<0.05).
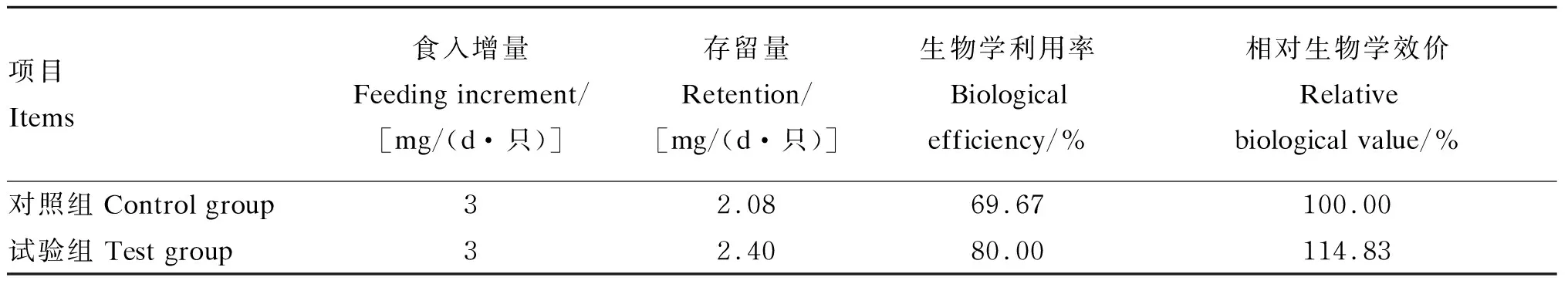
表7 酵母锌中锌的相对生物学效价
3 讨 论
3.1 培养条件的优化
不同的微生物对微量元素的吸附机制和吸附能力不同,所以在选用微生物转化无机微量元素来改善微量元素的利用率时,菌种的选择就显得尤为重要,常常要根据吸附的元素不同来选择不同的微生物进行转化微量元素。与此同时,微量元素的浓度、培养温度、培养时间、菌液接种量等也对微生物转化无机微量元素的能力有着重要的影响[20]。
3.1.1 无机锌浓度对酿酒酵母菌转化无机锌能力的影响
无机锌浓度对酿酒酵母菌转化无机锌的能力有较大的影响,本试验最佳的无机锌浓度为1.5 mg/L,此条件下转化率达到了98.01%。无机锌浓度主要影响酿酒酵母菌的活力,当无机锌浓度过高,可能影响酵母菌的繁殖力,这是因为金属元素能与酿酒酵母菌中的蛋白质结合,使其变性失活,破坏蛋白质的正常生理功能[19],从而抑制了酿酒酵母菌的生长;无机锌浓度过低时,不能满足酿酒酵母菌的营养需要,使其生长延长[21]。杨靖鹏[22]研究表明,无机锌转化为微生物锌的转化率为69.25%,低于本试验的转化率,这可能是因为本试验的无机锌浓度较低,有利于酿酒酵母菌将无机锌尽可能多的转化为微生物锌,提高无机锌的利用率,减少无机锌对环境的污染。
3.1.2 培养温度对酿酒酵母菌转化无机锌能力的影响
培养温度影响微生物的生长,酵母在25~32 ℃均可生长,但在不同的温度下其生长的速度和合成的有机物不同,因此要根据转化的微量元素选择合适的温度。在富集转化的过程中,温度过高会使酿酒酵母菌中的磷脂分子在膜内进行快速的侧向扩散,增加膜脂的流动性,破坏膜的完整性,从而导致酿酒酵母菌的存活率下降[23]。本试验所筛选的培养温度与康毅等[24]所研究的酿酒酵母菌需要的温度条件是相同的。
3.1.3 培养时间对酿酒酵母菌转化无机锌能力的影响
培养时间对酿酒酵母菌转化无机锌的能力有较大的影响,培养时间会影响微生物的生长及其对无机锌富集转化量的多少,培养时间过短,酿酒酵母菌未生长完全;培养时间过长,酿酒酵母菌会产生副产物,从而抑制其增长。本试验筛选出的培养时间与Chreptowicz等[25]所筛选酵母所需的培养时间是一样的。
3.1.4 菌液接种量对酿酒酵母菌转化无机锌能力的影响
菌液接种量主要影响无机锌向微生物锌转化的速率,菌液接种量过低,微生物生长缓慢,杂菌污染率增加,转化时间延长;菌液接种量过高,微生物生长迅速,在短时间内积聚大量代谢副产物,抑制微生物活性物质的合成[26]。本试验的菌液接种量为4%,低于孔林[27]研究的菌液接种量,可能的原因是本试验的菌液浓度高于其菌液浓度。
3.2 酵母锌饲喂鸡的相对生物学效价评定
在集约化饲养的模式下,动物在生产过程中会集中排泄大量的粪便和尿液,给环境造成了巨大污染,其中微量元素的大量排出对环境造成不可逆的损害,不仅如此,对动物本身和周围植物也造成了一定程度的损伤。其中锌在动物生产中的排放不仅仅与饲粮中添加水平密切相关[28],也与动物自身对锌的利用率有关,即与锌的生物学效价有密切的关系[29]。因此,提高锌的利用率对动物本身和环境均有益。本研究筛选出的富锌酵母不仅对无机锌具有较高的转化率,并且其饲喂鸡可以显著提高鸡对锌的生物学利用率,减少粪中锌排放,其锌相对于无机硫酸锌中锌的相对生物学效价高达114.83%,这一结果与其他微生物锌的结果一致[30-31],与索海青[31]测得的微生物锌中锌的相对硫酸锌中锌的相对生物学效价为115%高度一致。
本试验中酵母锌的利用率高于硫酸锌,可能的原因是锌被酿酒酵母菌富集在胞内,以胞内锌的形式进入动物消化道,其结构稳定,不易解离,并且能抵抗与其他配体如铜锌结合蛋白等的干扰作用,以一种完整的结构形式运输到小肠的吸收部位,所以酵母锌较硫酸锌对动物具有更高的生物学利用率,这可能符合有机锌的内源吸收假说[8]。大量研究表明,蛋氨酸锌较硫酸锌不但具有更高的生物利用率,而且还同时具有免疫和抗氧化活性[32-33],但酵母锌是否像蛋氨酸锌一样也具有免疫和抗氧化活性呢?这尚待进一步研究。
4 结 论
① 酿酒酵母菌对无机锌的转化率最高,可达52.26%。
② 酿酒酵母菌转化无机锌的最优条件为:无机锌浓度1.5 mg/L,培养温度28 ℃,培养时间66 h,菌液接种量4%。该条件下,可将98.01%的无机锌转化为微生物锌。
③ 以酿酒酵母菌转化的酵母锌饲饲喂鸡,相对与硫酸锌中锌,其锌的利用率是114.83%。
