巴氏杀菌β-内酰胺类抗奶对犊牛生长和胃肠道发育的影响
2018-10-17辛小月曲永利殷术鑫
辛小月 曲永利 袁 雪 高 岩 王 璐 殷术鑫 张 帅
(黑龙江八一农垦大学动物科技学院,大庆163319)
奶牛生产中β-内酰胺类抗生素如青霉素等[1]是最常用的一类疾病治疗的药物。在用药期间以及停药期奶牛所产奶中会含有这些抗生素。含有抗生素、高体细胞数的牛奶统称为抗奶,国外也称之为废奶。在德国每年产生的废奶量占总产奶量的1%~4%[2],这些奶足够饲喂给所有牛场的犊牛。抗奶作为不计成本的饲料,饲养者们选择将其饲喂给犊牛来降低饲养成本。对于抗奶的利用方式,根据作者所在研究小组2016年对黑龙江省300多个牛场调查结果显示,约95%的牛场使用抗奶饲喂犊牛,而且其中66%的牛场不对抗奶进行相关处理。然而牛奶质量对犊牛的生长发育和机体健康起着重要的作用,所以有必要对抗奶对犊牛生长发育的影响进行研究。按多数国家的标准定义,巴氏杀菌工艺是指“生牛奶中天然存在的碱性磷酸酶活性被钝化,而乳过氧化氢酶活性依然得以保留的一大类热处理工艺”,其目的在于杀灭牛乳中致病菌的同时最大限度地保存营养物质和纯正口感[3]。刘根涛等[4]通过饲喂巴氏杀菌初乳研究其对犊牛生长性能及胃肠道发育的影响,结果显示,巴氏杀菌初乳显著降低复胃重与活体重的比值,且能够在一定程度上提高犊牛平均日增重,促进犊牛生长发育,降低腹泻率。目前,关于巴氏杀菌抗奶在幼龄反刍动物中的应用研究报道较少,特别是关于它对犊牛生长和胃肠道发育影响的研究更为少见。因此,本试验旨在研究饲喂巴氏杀菌β-内酰胺类抗奶对犊牛生长发育和小肠发育的影响,为国内奶牛场抗奶的科学有效利用提供理论依据。
1 材料与方法
1.1 试验动物与设计
选用3日龄、体重为(42.82±0.35) kg的健康荷斯坦公犊18头,随机分为对照组和试验组,每组9头。对照组饲喂β-内酰胺类抗奶,试验组饲喂巴氏杀菌β-内酰胺类抗奶,2种奶的饲喂温度均控制在37~39 ℃,60日龄断奶,试验期为180 d。
1.2 试验饲粮
试验饲喂犊牛的奶来源于使用β-内酰胺类抗生素(头孢噻呋钠)处于治疗期和停药期的泌乳奶牛。试验抗奶巴氏杀菌的条件为:63~65 ℃下加热30 min。试验饲粮由颗粒料(开食料)和优质羊草组成,饲粮配方均采用CPM软件优化形成,试验饲粮组成及营养水平见表1。
1.3 饲养管理
试验犊牛出生0.5 h内饲喂初乳4 kg/头。试验期间抗奶和巴氏杀菌抗奶的饲喂量3~7日龄每日饲喂3次,5.0 kg/d;8~20日龄每日3次,5.5 kg/d;21~40日龄每日2次,4.0 kg/d;41~50日龄每日2次,3.0 kg/d;51~60日龄每日1次,1.0 kg/d。各组犊牛8日龄时开始添加优质羊草和颗粒料(开食料),每头添加量为0.3 kg/d,断奶时添加量为1.0 kg/d。每天提供充足的饮水。犊牛培育舍每天进行清理,并定时进行消毒,以确保为犊牛提供干净的卫生条件。
1.4 样品采集与测定方法
1.4.1 奶样相关指标
每10 d采集1次奶样,每天采集3次(早、中和晚),将采取的奶样按4∶3∶3混合。取混合后奶样50 mL于加入5%重铬酸钾防腐剂的测定管中,4 ℃保存,用于乳成分测定。同样取混合后奶样50 mL于无菌瓶中,4 ℃保存,用于收集后2 h内总细菌、大肠杆菌和沙门氏菌数量的测定。
奶中乳成分测定:采用Foss Milkoscan 133B乳成分分析仪(Foss Electric,丹麦)测定。
奶中体细胞数量测定:采用Foss (r) Bentley Somacount CC-5000体细胞测定仪(Foss Electric,丹麦)测定。

表1 试验饲粮组成及营养水平(干物质基础)
1)预混料为每千克饲粮提供 The premix provided the following per kg of the diet:VA 18 000 IU,VD35 000 IU,VE 50 mg,Fe 80 mg,Cu 12 mg,Zn 80 mg,Mn 50 mg,I 1 mg,Se 0.4 mg,Co 0.4 mg。
2)产奶净能[5]为计算值,其余营养水平为实测值。NEL[5]was a calculated value, while the other nutrient levels were measured values.
抗生素含量测定:采用液相色谱-串联质谱法(LC-MS/MS Agilent Technologies,美国)测定。
总细菌、大肠杆菌和沙门氏菌数量测定:将奶样以1∶10的比例梯度稀释到10-7,每个梯度各取1 mL加入无菌培养基中,奶中的总细菌用平板琼脂计数培养基(PCA)在37 ℃、5% CO2培养箱中培养48 h,大肠杆菌用结晶紫中性红胆盐琼脂(VRBA)培养基在37 ℃、5% CO2培养箱中培养24 h,沙门氏菌用SS培养基在37 ℃、5% CO2培养箱中培养24 h,计数。
1.4.2 生长发育指标
分别于犊牛30、60、90、180日龄晨饲前测定犊牛的体重和体尺指标,并计算犊牛各阶段的平均日增重。
1.4.3 粪便评分及腹泻率
犊牛60日龄以前,每天观察每头犊牛的排粪状况并进行评分,粪便外形正常,稳固但不坚硬,掉在地面或沉积后外形稍有变化,记为1分;外形松软成堆,但难以保持,记为2分;软膏或薄饼状,极易扩散,记为3分;呈水状,固液分离,记为4分[6]。3分及以上的视为发生腹泻,统计完成后进行腹泻率的计算[7]。腹泻率的计算公式如下:
腹泻率(%)=Σ[(腹泻犊牛头数×犊牛腹泻天数)/(重复组犊牛头数×记录天数)]×100。
1.4.4 胃肠道发育指标
在60、90和180日龄时分别从试验组和对照组选取3头犊牛,晨起空腹颈动脉放血处死。在屠宰后沿腹中线部位剖开腹腔,在不破坏消化道的情况下,将胃肠道置于托盘中。
垂直切取大小为1.5 cm×1.5 cm瘤胃背囊和腹囊,同时分别取十二指肠近端(5 cm处)空肠前、中、后段,回肠中段各2~3 cm,用生理盐水冲洗干净并吸去多余的水分,放入到10%中性甲醛中固定,将组织尽可能保持原有的形态结构,留做组织切片,用以做胃肠道形态学的观察。
瘤胃及肠道固定样经苏木精-伊红(HE)染色后,对其组织形态进行观察。每头犊牛的每个部位选取5张切片用ML-50显微图像采集分析系统进行观察并拍照。每张片子选取10个完整的视野(瘤胃乳头完整,走向平直,肠绒毛完整),用目镜(40×)测微尺观察测量每个视野中瘤胃乳头最长最宽处的乳头高度及乳头宽度。测量每个视野中肠绒毛最长最宽处的绒毛高度、绒毛宽度、隐窝深度及黏膜厚度,并计算绒毛高度/隐窝深度(V/C)。
1.5 统计分析
整理后的数据采用SAS 9.2统计软件中的GLM过程对数据进行单因素分析,试验数据用“平均值±标准误”表示,以P<0.05表示差异显著,P<0.01表示差异极显著。
2 结 果
2.1 β-内酰胺类抗奶和巴氏杀菌β-内酰胺类抗奶的成分
由表2可知,巴氏杀菌β-内酰胺类抗奶中总细菌、大肠杆菌和沙门氏菌数量较β-内酰胺类抗奶均极显著降低(P<0.01),但乳糖率、乳蛋白率、乳脂率、乳总固形物率、尿素氮含量和体细胞数量均无显著差异(P>0.05)。
2.2 巴氏杀菌β-内酰胺类抗奶对犊牛生长的影响
由表3可知,试验组犊牛在3~60日龄期间的平均日增重显著高于对照组(P<0.05),2组间犊牛60~180日龄和3~180日龄期间的平均日增重及30、60、90和180日龄的体重差异均不显著(P>0.05),但试验组均略高于对照组。
由表4可知,与对照组相比,试验组犊牛60日龄体高及90和180日龄胸围均显著提高(P<0.05);其他各时间点试验组犊牛的体斜长、体直长、管围、腿围和胸深均无显著性差异(P>0.05)。
2.3 巴氏杀菌β-内酰胺类抗奶对犊牛粪便评分及腹泻率的影响
由表5可知,与对照组相比,试验组犊牛在3~10日龄和3~60日龄期间的粪便评分和腹泻率显著降低(P<0.05),而11~30日龄和31~60日龄期间的粪便评分和腹泻率均无显著性差异(P>0.05)。随着日龄的增长,试验组和对照组犊牛的粪便评分逐渐减小,腹泻的发生概率也有所降低。
2.4 巴氏杀菌β-内酰胺类抗奶对犊牛瘤胃和小肠形态发育的影响
由表6可知,试验组和对照组犊牛在60、90和180日龄时的瘤胃背囊和腹囊的乳头高度、乳头宽度和黏膜厚度均无显著性差异(P>0.05)。对于十二指肠,试验组犊牛60日龄时的绒毛高度显著高于对照组(P<0.05),对照组犊牛在90日龄时的隐窝深度显著高于试验组(P<0.05),试验组犊牛60日龄时的V/C显著高于对照组(P<0.05);2组间其他各时间点的十二指肠绒毛宽度、黏膜厚度和肌层厚度均无显著性差异(P>0.05)。对于空肠,与对照组相比,试验组90日龄时的绒毛宽度显著提高(P<0.05),60、90和180日龄时的隐窝深度显著降低(P<0.05),90和180日龄时的V/C显著提高(P<0.05);而犊牛在60、90和180日龄时的绒毛高度、黏膜厚度和肌层厚度均无显著性差异(P>0.05)。试验组和对照组犊牛回肠的各指标在60、90和180日龄时均无显著性差异(P>0.05)。
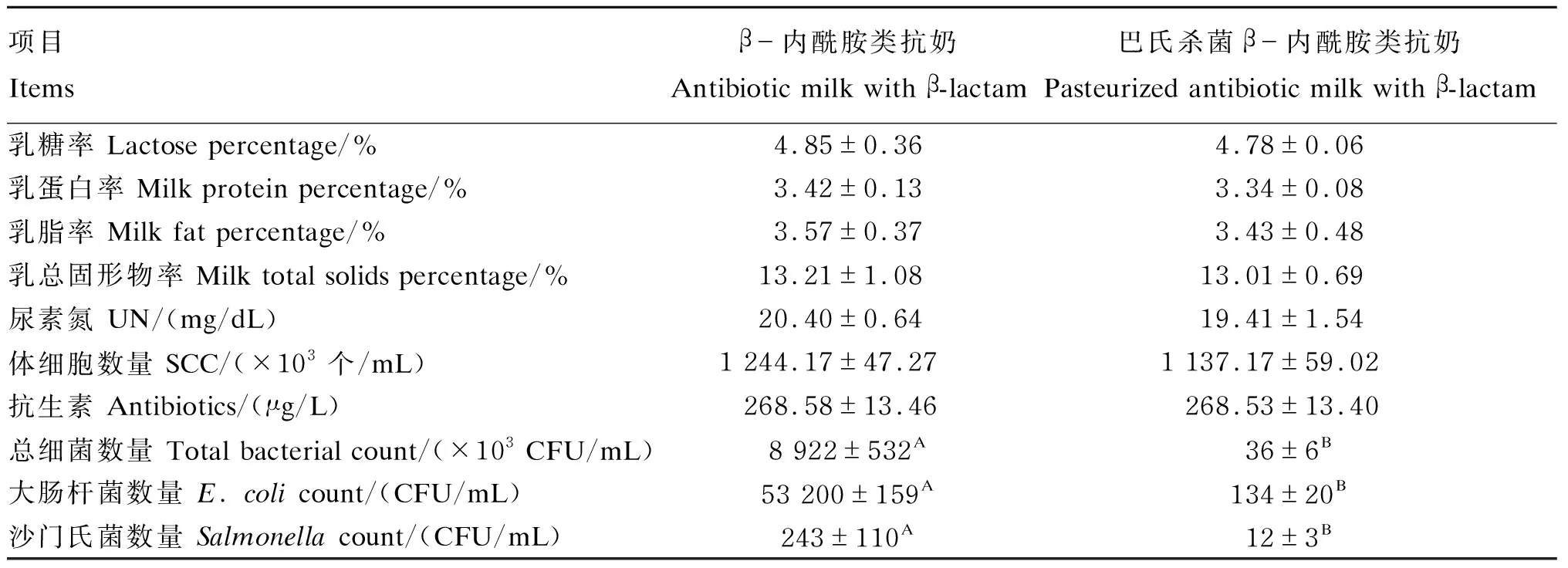
表2 β-内酰胺类抗奶和巴氏杀菌β-内酰胺类抗奶的成分
同行数据肩标相同字母或无字母表示差异不显著(P>0.05),不同小写字母的表示差异显著(P<0.05),不同大写字母的表示差异极显著(P<0.01)。表3、表5同。
In the same row, values with the same or no letter superscripts mean no significant difference (P>0.05), while with different small letter superscripts mean significant difference (P<0.05), and with different capital letter superscripts mean extremely significant difference (P<0.01). The same as Table 3 and Table 5.
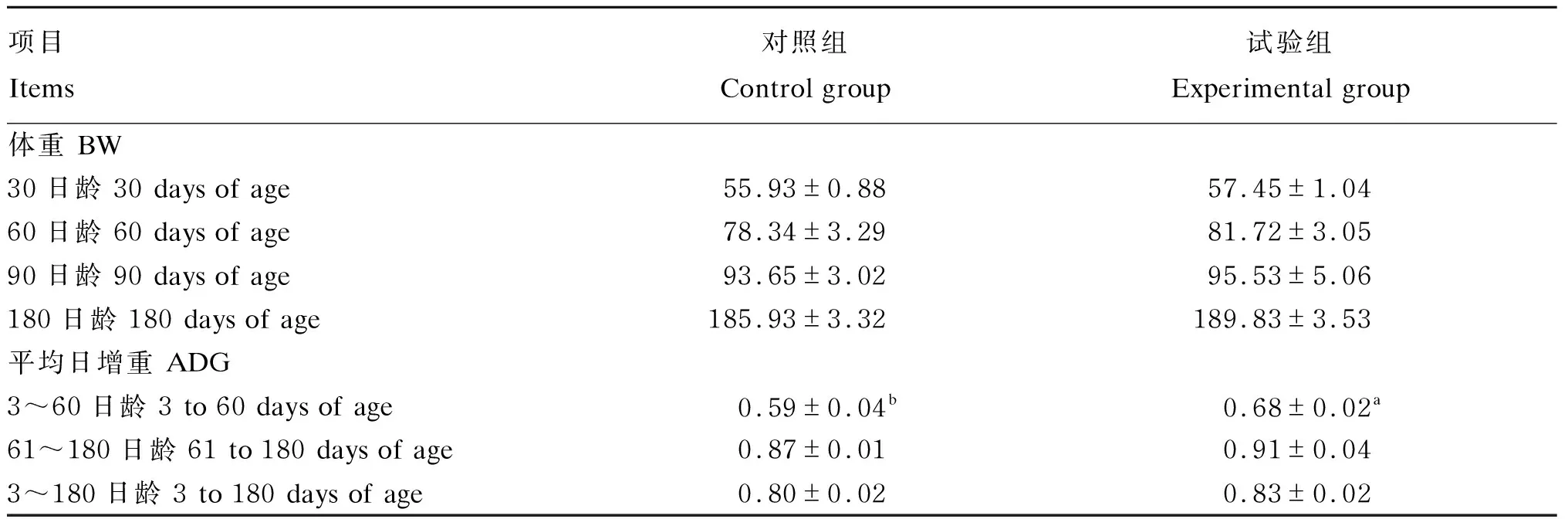
表3 巴氏杀菌β-内酰胺类抗奶对犊牛体重的影响
3 讨 论
3.1 β-内酰胺类抗奶和巴氏杀菌β-内酰胺类抗奶的成分比较
β-内酰胺类药物因其广谱低廉、使用方便及毒性低被用作奶牛临床型和亚临床型乳房炎及子宫内膜炎的首选药物。本试验中,2种奶中的抗生素含量无显著差异,说明巴氏杀菌未对奶中抗生素含量造成影响,与Jorgensen等[8]的研究结果相一致。本试验中巴氏杀菌β-内酰胺类抗奶中的乳脂率、乳蛋白率均达到了国际标准。虽然像乳蛋白等乳成分经巴氏杀菌后有一定程度损失,但这2种奶之间并未表现出显著差异,这与臧长江等[9]的研究结果一致。乳糖受巴氏杀菌的影响较小,其含量相对稳定并可小范围变化,这与本试验的结果相同[10]。朱正鹏等[11]研究表明,牛奶中的乳脂和乳糖等乳成分与牛奶中体细胞数量呈负相关。然而,本试验中并未表现出这种负相关性。奶中体细胞数量是评价奶牛健康的重要指标。当奶牛乳房受细菌侵染或是由挤奶机造成机械性损伤时,血液会分泌大量的白细胞来抵抗外来的感染并修复损伤组织,此时大量增幅的白细胞也会伴随牛奶排出体外。因此,奶牛乳房发生炎症, 牛奶中的体细胞数量会迅速升高,甚至乳成分会随之发生变化。本试验中的β-内酰胺类抗奶和巴氏杀菌β-内酰胺类抗奶的体细胞数量没有显著差异,且均超过1×106个/mL,这符合泌乳奶牛所处的病理状态,也说明巴氏杀菌对奶中体细胞数量没有影响。奶牛临床型及亚临床型乳房炎多数
是由细菌感染引起的[12]。细菌在感染乳腺组织时能够吸附在上皮细胞上,从而引发局部免疫反应,其特征为红肿、发炎和产奶量下降[13]。总细菌数量是牛奶中总微生物污染的指标,也是反映奶品质量的重要指标。总细菌数量越高说明奶牛健康状况越差,牛奶的品质越差。本试验中,β-内酰胺类抗奶经巴氏杀菌后,总细菌、大肠杆菌及沙门氏菌数量均极显著降低,这与李龙柱等[14]的研究结果相符。根据Jorgensen等[15]的研究结果,巴氏杀菌可显著降低大肠杆菌和沙门氏菌数量。本研究的结果也清楚地表明这一点,说明巴氏杀菌能够有效地杀灭致病菌,降低通过牛奶传播给犊牛疾病的风险,从而提高了奶的质量。
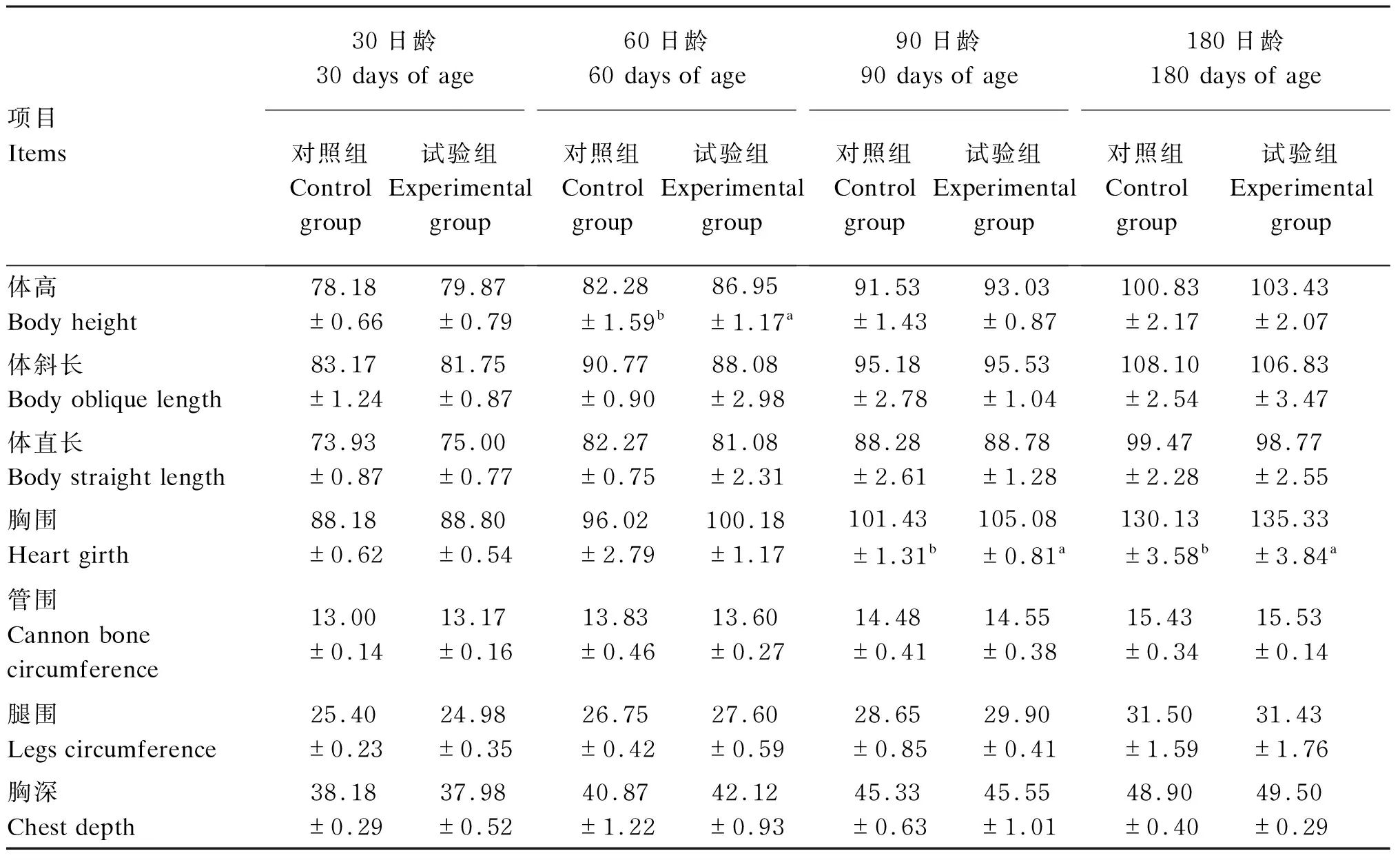
表4 巴氏杀菌β-内酰胺类抗奶对犊牛体尺的影响
相同时间点、同行数据肩标相同字母或无字母表示差异不显著(P>0.05),不同小写字母的表示差异显著(P<0.05)。表6同。
In the same row, values at the same time point with the same or no letter superscripts mean no significant difference (P>0.05), while with different small letter superscripts mean significant difference (P<0.05). The same as Table 6.
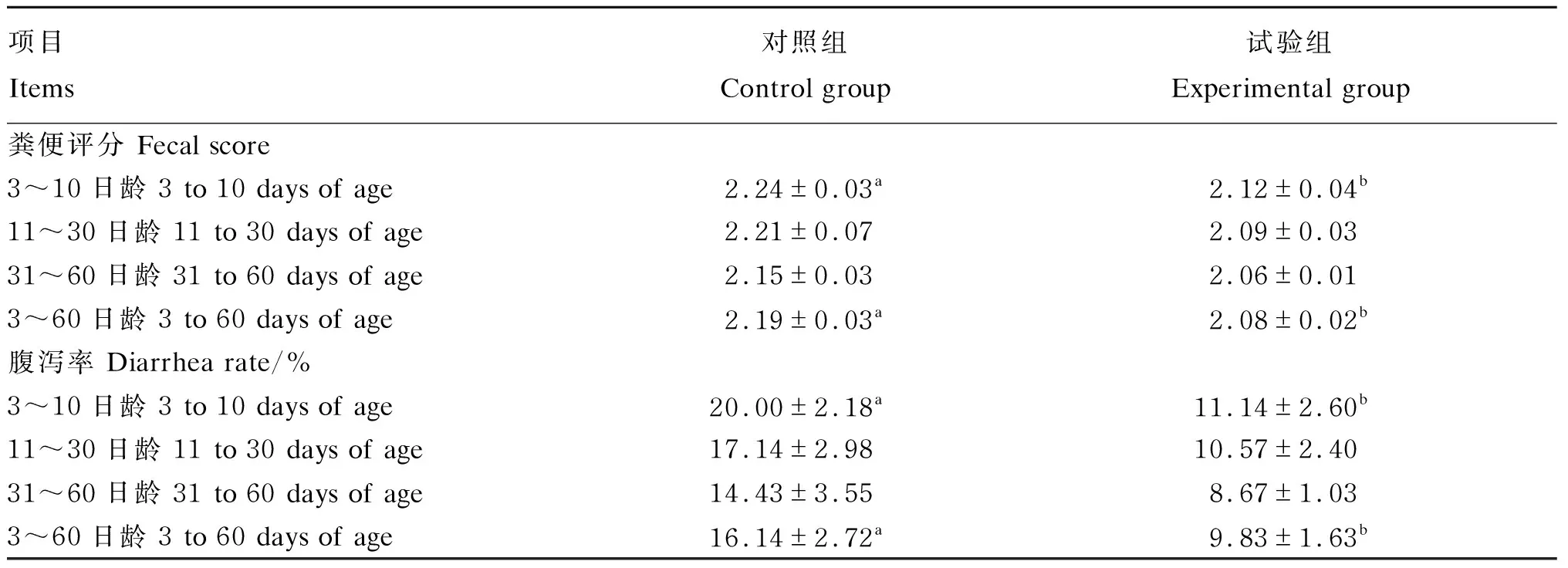
表5 巴氏杀菌β-内酰胺类抗奶对犊牛粪便评分及腹泻率的影响
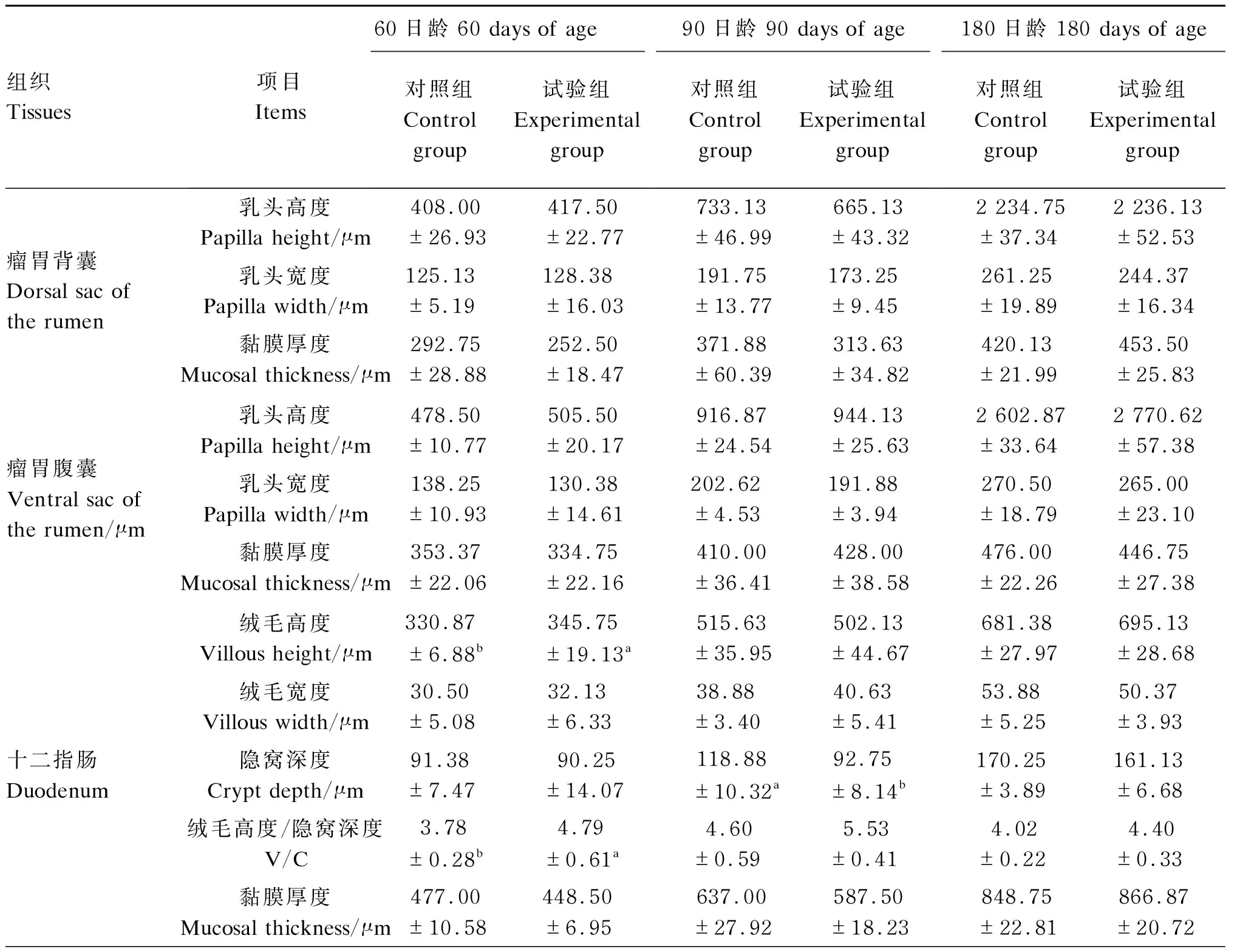
表6 巴氏杀菌β-内酰胺类抗奶对犊牛瘤胃和小肠形态发育的影响

续表6组织Tissues项目 Items60日龄 60 days of age对照组Control group试验组Experimental group90日龄 90 days of age对照组Control group试验组Experimental group180日龄 180 days of age对照组Control group试验组Experimental group空肠Jejunum绒毛高度 Villous height/μm267.37±9.83251.75±9.69293.50±11.28291.25±14.42327.25±10.68411.00±16.50绒毛宽度 Villous width/μm25.87±2.9326.25±1.7827.25±1.34b34.00±1.52a32.63±3.0137.37±2.52隐窝深度 Crypt depth/μm83.62±2.41a74.50±3.06b103.13±4.13a86.25±3.65b112.00±4.76a99.50±3.37b绒毛高度/隐窝深度 V/C3.22±0.173.42±0.182.88±0.18b3.40±0.20a2.92±0.14b4.13±0.26a黏膜厚度 Mucosal thickness/μm410.00±17.68399.87±21.87479.00±10.33494.38±13.62601.00±25.07625.87±18.93回肠Ileum绒毛高度 Villous height/μm241.37±11.13242.28±11.29336.75±11.40351.63±16.45459.87±22.68475.00±22.25绒毛宽度 Villous width/μm28.62±1.4826.12±0.8731.12±1.4533.75±1.4432.62±2.0835.25±2.22隐窝深度 Crypt depth/μm82.37±4.3881.50±2.2488.63±3.9583.87±2.2993.25±2.6392.50±4.48绒毛高度/隐窝深度 V/C2.97±0.172.95±0.123.85±0.204.21±0.214.95±0.245.15±0.11黏膜厚度 Mucosal thickness/μm480.75±10.82461.88±11.43531.75±16.04523.00±21.11600.37±26.66607.37±37.04
3.2 巴氏杀菌β-内酰胺类抗奶对犊牛生长的影响
体重是反映犊牛生长状况的一个重要指标。Aust等[16]研究结果表明,犊牛饲喂废弃奶后,没有对犊牛的生长造成影响。有研究表明,饲喂巴氏杀菌抗奶的犊牛在断奶前后的体重均高于饲喂未经巴氏杀菌抗奶的犊牛。本试验中,试验组犊牛在3~60日龄期间的平均日增重显著高于对照组,这与宋健等[17]研究结果相似,说明饲喂巴氏杀菌β-内酰胺类抗奶可在一定程度上促进犊牛的生长。这可能是由于巴氏杀菌使牛奶中总细菌及有害菌数量大量减少,降低了犊牛的潜在发病率,使犊牛处于健康生长状态。本试验中,各时间点时犊牛的体重及60~180日龄和3~180日龄期间的平均日增重差异均不显著,表明饲喂巴氏杀菌β-内酰胺类抗奶主要影响了犊牛哺乳期的增重,或者说饲喂巴氏杀菌β-内酰胺类抗奶可潜在提高犊牛的生长。
体尺是衡量犊牛生长发育的重要指标,可反映犊牛的骨骼发育情况和饲养管理水平[18-19]。Hill等[20]给出了部分荷斯坦犊牛的体尺数据:体高86.4~93.1 cm,体斜长82.3~91.0 cm。本试验中犊牛60日龄体高和体斜长基本处于其给定的范围内,说明2组犊牛均属于正常发育。另外,本试验中试验组犊牛60日龄的体高及90和180日龄的胸围显著高于对照组,这可能与试验组犊牛各时间点的体重和各时间段平均日增重均高于对照组有关。因此,综合体重、体尺来看,饲喂巴氏杀菌β-内酰胺类抗奶对犊牛的生长有所促进。
3.3 巴氏杀菌β-内酰胺类抗奶对犊牛粪便评分及腹泻率的影响
犊牛腹泻是犊牛常见疾病之一,临床症状为腹泻、体温升高、精神不振、迅速消瘦等,严重的可导致犊牛死亡。犊牛腹泻的原因大体分为营养性腹泻和传染性腹泻。生鲜乳中大肠杆菌和沙门氏菌等微生物数量超标是引起犊牛腹泻的主要原因,因此,生鲜乳是引起犊牛疾病潜在传染源。有研究表明,巴氏杀菌能够显著降低牛奶中微生物的数量和种类,降低犊牛患病风险,从而可减小牛奶中病原体对犊牛健康造成的影响[21-22]。Sandra等[23]通过研究巴氏杀菌抗奶和代乳品对犊牛生长的结果发现,巴氏杀菌抗奶在提高犊牛生长的同时,可显著降低犊牛的发病率和和死亡率。宋健等[17]和杨盛等[24]研究发现,饲喂巴氏杀菌牛奶能够改善犊牛的健康状况,使犊牛腹泻发病率降低。本试验中试验组犊牛在3~10日龄和3~60日龄期间的粪便评分和腹泻率均显著低于对照组,而在11~30日龄和31~60日龄期间2组犊牛粪便评分和腹泻率并无显著差异,但试验组犊牛仍降低了6.57%和5.76%。说明巴氏杀菌可消除抗奶中微生物给犊牛健康带来的部分风险,这或许是2组犊牛日增重存在一定差异的原因;但腹泻率下降的有限,原因可能是巴氏杀菌抗奶随着保存时间的延长,蛋白质、乳脂肪品质降低,微生物数量增加,导致巴氏杀菌抗奶二次污染[25]。随着犊牛日龄的增加其腹泻率也有所下降,这与董晓丽[26]的研究结果一致。可能是因为随着日龄增加,其消化器官和免疫机能也逐渐发育成熟[27],其次犊牛采食的颗粒料特殊的加工工艺通过制粒的高温处理,可杀灭病原微生物[28],从而减少了腹泻的发生。因此,总体看饲喂巴氏杀菌β-内酰胺类抗奶可促进犊牛的生长且更有利于维持犊牛健康状态。
3.4 巴氏杀菌β-内酰胺类抗奶对犊牛胃肠道发育的影响
瘤胃功能的完善与否直接关系到动物机体的生长性能。大量研究结果表明,挥发性脂肪酸是刺激瘤胃发育以及功能建立与完善的重要物质[29-30]。评价瘤胃发育情况的指标通常是瘤胃乳头高度、乳头宽度和瘤胃壁厚度[31-32]。上述指标受饲粮供给情况的影响。周怿等[33]通过在犊牛的饲粮中添加β-葡聚糖的研究发现,其瘤胃乳头高度和宽度得到显著增加;李辉[34]研究不同粗蛋白质水平饲粮对犊牛瘤胃发育影响时发现,相对于18%和26%的粗蛋白质水平来说,22%粗蛋白质水平的代乳粉能促进瘤胃乳头发育;李玉[35]研究结果显示,代乳粉中植物蛋白质水平的提高能够刺激瘤胃上皮乳头的生长;Evans等[36]研究发现,在进入瘤胃内的饲粮中,漂浮在上方的大颗粒饲粮能够刺激瘤胃背囊上皮细胞的快速增殖。本试验中,试验组犊牛和对照组犊牛在60、90和180日龄时的瘤胃背囊和腹囊的乳头高度、乳头宽度以及黏膜厚度差异均不显著,说明这2种奶对犊牛瘤胃形态学发育没有太大的影响。这可能是犊牛的生理结构食管沟的作用使得牛奶直接进入真胃,所以牛奶对犊牛瘤胃发育没有显著的作用。根据上述报道或近些年的报道,精饲料、粗饲料、固体饲粮的类型以及犊牛的采食习惯是影响犊牛瘤胃发育的主要因素,而本试验中2组犊牛采食相同的颗粒料和羊草,再加之犊牛的饲养管理相同,所以这可能是2组犊牛瘤胃形态学发育并未表现出差异的原因。
幼龄反刍动物其瘤胃尚未发育完全,小肠是营养物质消化吸收的主要部位,小肠形态结构发育的正常与否直接关系到犊牛的消化吸收功能。肠道的消化吸收能力与其绒毛高度、隐窝深度及黏膜厚度均呈正相关[37]。小肠绒毛的高度与其肠黏膜上皮细胞数量呈显著相关,绒毛越长,对养分的吸收能力越强[38]。隐窝深度反映了隐窝细胞的增殖率和成熟度[39]。也有研究证明,V/C是更能综合反映小肠功能状况的指标[40]。黏膜结构相应的改善,能够增强动物的消化吸收功能,降低其腹泻率,加快动物的生长发育;但随着V/C的下降,肠道黏膜受损,进而消化吸收功能降低,影响动物的生长发育[41-42]。健康的幼龄动物V/C在3~4时,小肠才具有较强的吸收能力[43]。本研究中2组犊牛各肠道V/C在2.88~5.53,基本处于正常的范围内,这说明2组犊牛均能对饲粮中的营养物质进行有效的消化吸收。但是在本试验中饲喂巴氏杀菌抗奶显著增加了60日龄犊牛十二指肠的绒毛高度,显著降低了90日龄时十二指肠隐窝深度,显著增加了60日龄时十二指肠V/C。另外,试验组犊牛空肠绒毛宽度在90日龄时显著高于对照组,V/C在60、90和180日龄也均显著高于对照组。从小肠形态学角度可说明饲喂巴氏杀菌抗奶更有利于十二指肠和空肠的组织形态学发育,这可能与犊牛的腹泻率存在着相关性,因为从整体看本试验中饲喂巴氏杀菌抗奶的犊牛腹泻率较低,所以这可能是导致犊牛十二指肠和小肠形态学发育出现差异的原因,这符合上述前人的报道。然而,饲喂巴氏杀菌抗奶对各测定时间点犊牛回肠的各测定指标均无显著影响,说明饲喂巴氏杀菌抗奶主要影响十二指肠和空肠的发育,而对回肠的发育影响较小。
4 结 论
① 饲喂巴氏杀菌β-内酰胺类抗奶能够在一定程度上降低犊牛腹泻的发生率,保持犊牛的肠道健康,有利于犊牛的生长。
②从胃肠形态学角度看,饲喂巴氏杀菌β-内酰胺类抗奶的犊牛十二指肠的绒毛高度、V/C及空肠的V/C较饲喂β-内酰胺类抗奶的犊牛显著提高,因此饲喂巴氏杀菌β-内酰胺类抗奶主要对十二指肠和空肠的发育影响较显著。
