镉对梭鱼草叶片保护酶活性、光合及荧光特性的影响
2018-10-19辛建攀李文明祁茜田如男
辛建攀,李文明,祁茜,田如男
(南京林业大学风景园林学院,江苏 南京 210037)
镉主要来源于农药使用、污水排放、采矿及工业生产等人类活动,是环境中生物毒性最强的重金属元素之一,具有较强的移动性、化学活性和较长的生物半衰期,经植物根系吸收后可迅速转移至地上部分[1-2]。研究表明,植物能够通过提高超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)等保护酶活性来忍耐一定程度的镉胁迫[3-5]。但是,较高浓度的镉会破坏植物的多种代谢活动,使细胞内超氧阴离子自由基(O2-·)、过氧化氢(H2O2)等活性氧自由基大量积累,引起膜脂过氧化作用,抑制酶活性或破坏叶绿体结构,不利于植物光合作用及气体交换等生理活动,从而抑制植物生长[6-7]。
梭鱼草(Pontederiacordata)隶属于雨久花科(Pontederiaceae)梭鱼草属(Pontederia),原产于新大陆美洲热带及温带地区,主要分布于沼泽、湿地、水渠、湖泊、池塘及河流边缘浅水区域等,为专性湿地植物,具有很高的园林观赏和生态应用价值,在景观水体绿化美化、湿地恢复及重建过程中备受青睐[8-11]。从已有资料来看,有关梭鱼草的研究多集中于繁殖生物学[12-13]、富营养化水体净化[14-15]等方面,也有学者对梭鱼草去除重金属镉的效率进行了比较分析[16],但镉胁迫对梭鱼草生理生化特性的影响尚未有相关报道。因此,本研究通过溶液培养法,初步分析了不同浓度镉胁迫下梭鱼草叶片保护酶活性、叶绿素含量、气体交换参数及叶绿素荧光特性的变化,为了解梭鱼草的耐镉能力和生理机制提供理论基础。
1 材料与方法
1.1 供试材料
试验于2017年4-7月在南京林业大学风景园林学院园林教学中心温室完成,供试材料为梭鱼草。选取长势一致、健康植株,将根系冲洗干净后移至于盛有2 L 1/2 Hoagland营养液的塑料桶中进行适应性培养。每桶1株,培养周期为15 d,期间实时补充营养液至初始体积。
1.2 镉处理
适应性培养结束后,对供试材料进行镉(Cd)胁迫处理。镉溶液由CdCl2·2.5H2O和1/2 Hoagland营养液配制而成,共设置4个浓度梯度,分别为0、5、25和75 mg·L-1(以Cd2+浓度计算)(分别记为CK、A1、A2和A3)。各处理重复3次,每个重复8株。分别于第0,7,17,25天时测定叶片保护酶活性、叶绿素含量、光合气体交换参数及叶绿素荧光参数等生理生化指标。其中,光合气体交换参数和叶绿素荧光参数选择同一叶片的中部(避开主脉)进行测定。每次取样和相关指标测定结束后,及时更换营养液并添加对应浓度的镉溶液。
1.3 测定指标与方法
叶绿素含量测定采用丙酮乙醇混合液法[17];相对电导率测定采用电导法[18];SOD、POD及CAT活性测定分别采用氮蓝四唑(NBT)光还原法[19]、愈创木酚法和紫外吸收法[18]。
光合气体交换参数测定:于晴朗无风的天气,使用Ciras-2型便携式光合测定系统于上午9:00-11:30测定各处理下植株上部功能叶光合气体交换参数。测定过程中,使用开放气路,叶室温度设置为25 ℃,光强设置为1000 μmol·m-2·s-1),CO2浓度设置为390 μmol·mol-1,相对湿度为60%。测定指标包括净光合速率(Pn)、蒸腾速率(E)、气孔导度(Gs)以及胞间CO2浓度(Ci)等。
叶绿素荧光参数测定:于上午9:30-11:30用Handy PEA植物效率仪测定系统对各处理下梭鱼草叶片的叶绿素荧光参数进行测定。用暗适应夹夹住叶片中部,使叶片充分暗适应30 min。暗适应后将分析探头置于叶夹上,打开叶夹遮光片,使叶片暴露在饱和脉冲光(3000 mmol·m-2·s-1)下1 s。初始荧光(Fo)、最大荧光(Fm)、相对可变荧光(Vj、Vi)及PSⅡ最大光化学效率(Fv/Fm)等叶绿素荧光参数从Handy PEA软件测定结果中直接导出。
1.4 数据分析
采用SPSS 19.0进行数据处理和分析,对不同处理之间进行单因素方差分析和Duncan多重比较(P<0.05),用WPS表格作图。
2 结果与分析
2.1 镉胁迫对梭鱼草叶片细胞膜透性的影响
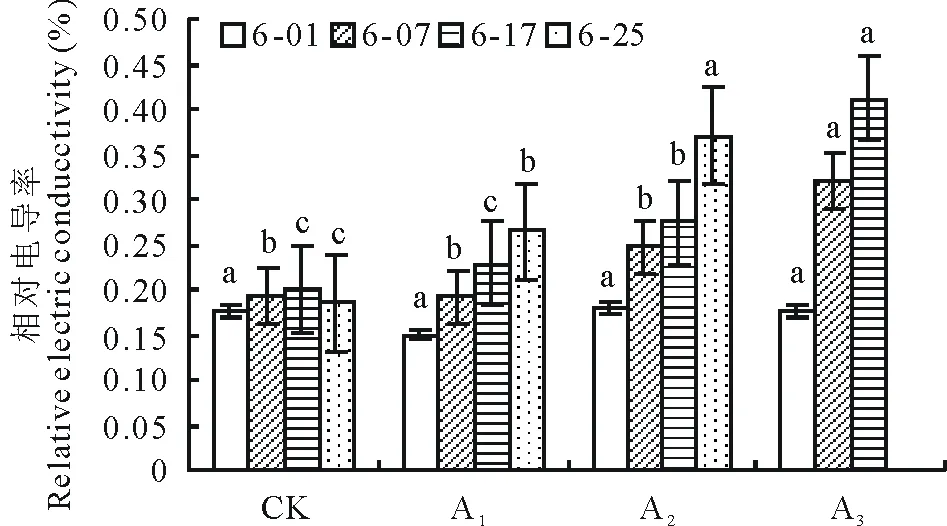
图1 镉胁迫对梭鱼草叶片相对电导率的影响Fig.1 Effects of Cd on the relative electric conductivities in P. cordata’s leaves 数据为平均值±平均误差(n=3),同一时期不同处理之间小写字母表示0.05水平显著差异性(P<0.05)。下同。Data are mean±SD (n=3). Different small letters among treatments in the same period indicate significant differences at the P<0.05 level. The same below.
植物叶片细胞膜透性的大小可以用相对电导率来衡量。与对照组相比,不同浓度镉胁迫下叶片相对电导率均呈上升趋势,且随着镉浓度的增加,叶片相对电导率的上升幅度增大(图1)。5 mg·L-1镉胁迫下叶片相对电导率在第25天时显著上升,比对照增加了29.92%;25 mg·L-1镉胁迫下叶片相对电导率在第17天时比对照显著增加了27.27%;75 mg·L-1镉胁迫下叶片相对电导率在第7天比同期对照显著增加了39.69%,胁迫结束时植株已全部死亡,表明低浓度镉在短时间内没有对植株造成伤害,但随镉浓度的增大和处理时间的延迟,植株受害程度加剧,膜脂过氧化作用增强,细胞膜透性逐渐增大,胞内电解质大量外渗,导致叶片枯黄、脱落甚至植株死亡。
2.2 镉胁迫对梭鱼草叶片保护酶活性的影响
2.2.1SOD活性 不同浓度镉处理下梭鱼草叶片SOD活性的变化如图2A所示。与对照组相比,当镉浓度为5 mg·L-1时,梭鱼草叶片SOD酶活性无显著变化。当镉浓度为25 mg·L-1时,叶片SOD活性先下降,在第7天时降至最低(157.90 U·g-1),这可能是梭鱼草对镉胁迫的应激性反应;随着胁迫时间的延长,SOD活性逐渐上升至对照水平(200.81 U·g-1),这是梭鱼草对镉胁迫的适应性反应,即梭鱼草叶片SOD清除O2-·的能力增强,有利于保护梭鱼草叶片膜结构的完整性。当镉浓度为75 mg·L-1时,SOD活性随胁迫时间的推移呈下降趋势,25 d时叶缘或叶尖变枯黄甚至叶片凋落,表明高浓度镉降低了SOD清除能力,使细胞内O2-·大量积累,对细胞产生毒害作用,从而加剧植株受害程度。
2.2.2POD活性 与对照组相比,不同浓度镉处理下梭鱼草叶片POD活性呈先上升后下降趋势(图2B)。当镉浓度为5、25 mg·L-1时,叶片POD活性在第17天时分别上升至峰值(135.28,149.42 U·g-1),比对照组增加了127.73%、151.71%,其中5 mg·L-1镉处理下的叶片POD活性在25 d时维持在相对稳定水平,有利于清除过氧化氢(H2O2),而25 mg·L-1镉处理下的叶片POD活性在25 d时急剧下降至对照水平,表明梭鱼草能够通过提高叶片POD活性来减缓镉对其造成的伤害,但这种调节作用具有一定的局限性。当镉浓度为75 mg·L-1时,叶片POD活性在第17天时上升至118.91 U·g-1,比对照组增加了98.46%,但此时仍然出现了叶缘或叶尖枯黄、叶片脱落甚至植株死亡的现象,这可能是高浓度镉减缓了叶片POD活性的增加,导致胞内H2O2的积累大于其清除而引起的。
2.2.3CAT活性 不同浓度镉处理对梭鱼草叶片CAT活性的影响如图2C所示。5、25 mg·L-1镉胁迫下叶片CAT活性基本上处于相对稳定状态,表明胞内H2O2
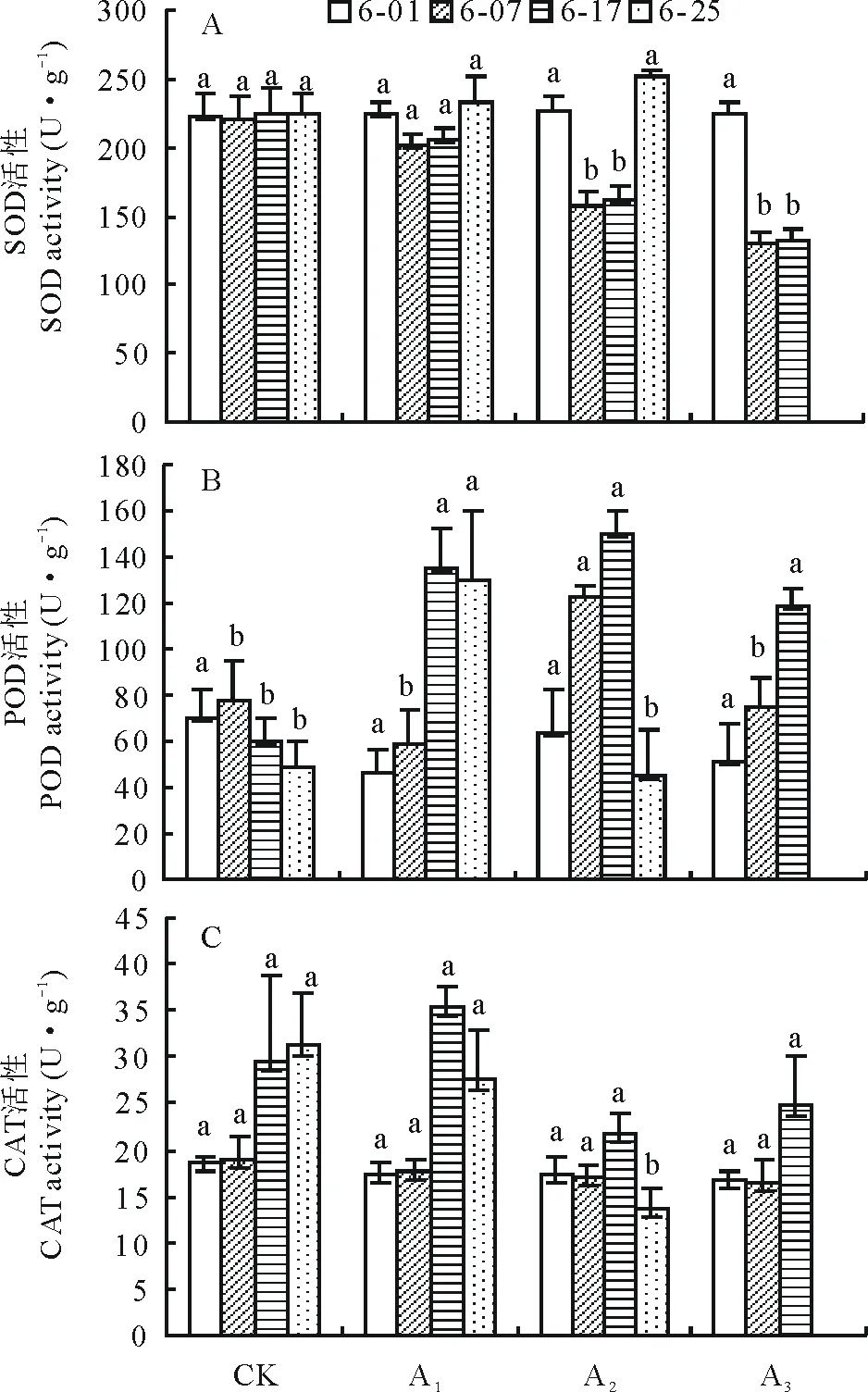
图2 镉胁迫对梭鱼草叶片保护酶活性的影响Fig.2 Effects of Cd on antioxidant enzyme activities in P. cordata’s leaves
等活性氧自由基的产生与清除处于动态平衡状态,其中25 mg·L-1镉胁迫下叶片CAT活性仅在第25天时比对照组显著下降了56.27%,表明梭鱼草对镉胁迫具有一定的适应性。75 mg·L-1镉胁迫下叶片CAT活性在第17天上升至24.74 U·g-1,但与对照组差异不显著;第25天叶片已枯黄甚至凋落,表明随镉浓度的增加和胁迫时间的延长,CAT清除能力下降,细胞内H2O2等活性氧积累过多,从而加速了叶片衰老。
2.3 镉胁迫对梭鱼草叶片光合色素含量的影响
不同浓度镉胁迫下梭鱼草叶片Chla、Chlb、ChlT含量及Chla/b比值的变化如表1所示。处理7 d时,各处理下叶片Chlb、ChlT含量及Chla/b比值与对照组均无显著差异,而Chla含量则显著下降了7.93%、6.33%和16.63%,表明Chla对重金属镉胁迫比较敏感。处理17 d时,叶片Chla含量显著低于对照组;Chlb含量随镉浓度的升高呈下降趋势,其中75 mg·L-1胁迫下Chlb含量比对照显著下降了38.36%;Chla/b比值呈下降趋势,但与对照组未达到显著水平;ChlT含量随镉浓度的升高呈下降趋势,其中25、75 mg·L-1镉胁迫下ChlT含量比对照组显著下降了17.67%、45.17%。处理25 d时,各处理下叶片Chla、Chlb、ChlT含量及Chla/b比值均低于对照组,且差异达到显著水平。总体上来看,梭鱼草叶片各色素含量随镉浓度的升高呈下降趋势,这可能是因为镉在梭鱼草叶绿体中积累,破坏了叶绿体结构,使叶绿素酶活性失调,导致叶绿素的合成速率下降或分解速率加快。
2.4 镉胁迫对梭鱼草叶片光合气体交换参数的影响
2.4.1净光合速率(Pn) 试验期间,镉处理均在不同程度上抑制了梭鱼草叶片Pn(图3A)。与对照组相比,镉胁迫下梭鱼草叶片Pn随镉浓度的增加呈下降趋势,且下降幅度随胁迫时间的延长而增加。5、25 mg·L-1镉胁迫下叶片Pn在第25天时比同期对照组分别显著下降了26.20%、54.80%。75 mg·L-1镉胁迫下叶片Pn在第7,17天比同期对照组分别下降了 55.42%、67.70%。
2.4.2蒸腾速率(E) 镉胁迫下梭鱼草叶片E随镉浓度的增加呈下降趋势(图3B)。其中,5 mg·L-1镉胁迫下叶片E变化不明显,此时植株的水分代谢活动没有受到影响。25、75 mg·L-1镉胁迫下叶片E均显著低于同期对照组,且下降幅度随胁迫时间的延长而增大,其中25 mg·L-1镉胁迫结束时叶片E比对照组降低了55.10%,而75 mg·L-1镉胁迫至17 d时叶片E即比对照组显著降低了60.12%。
2.4.3气孔导度(Gs) 气孔是植物叶片与大气进行气体交换的重要通道,其闭合程度是决定叶片蒸腾速率的重要因素之一。镉胁迫下梭鱼草叶片Gs与E的变化趋势基本一致(图3C)。胁迫结束时,5、25 mg·L-1镉胁迫下叶片Gs比对照组分别显著下降了39.38%、51.40%。当镉浓度继续增大时,叶片Gs下降幅度进一步增加,叶片E的变化也证明了这一结果。
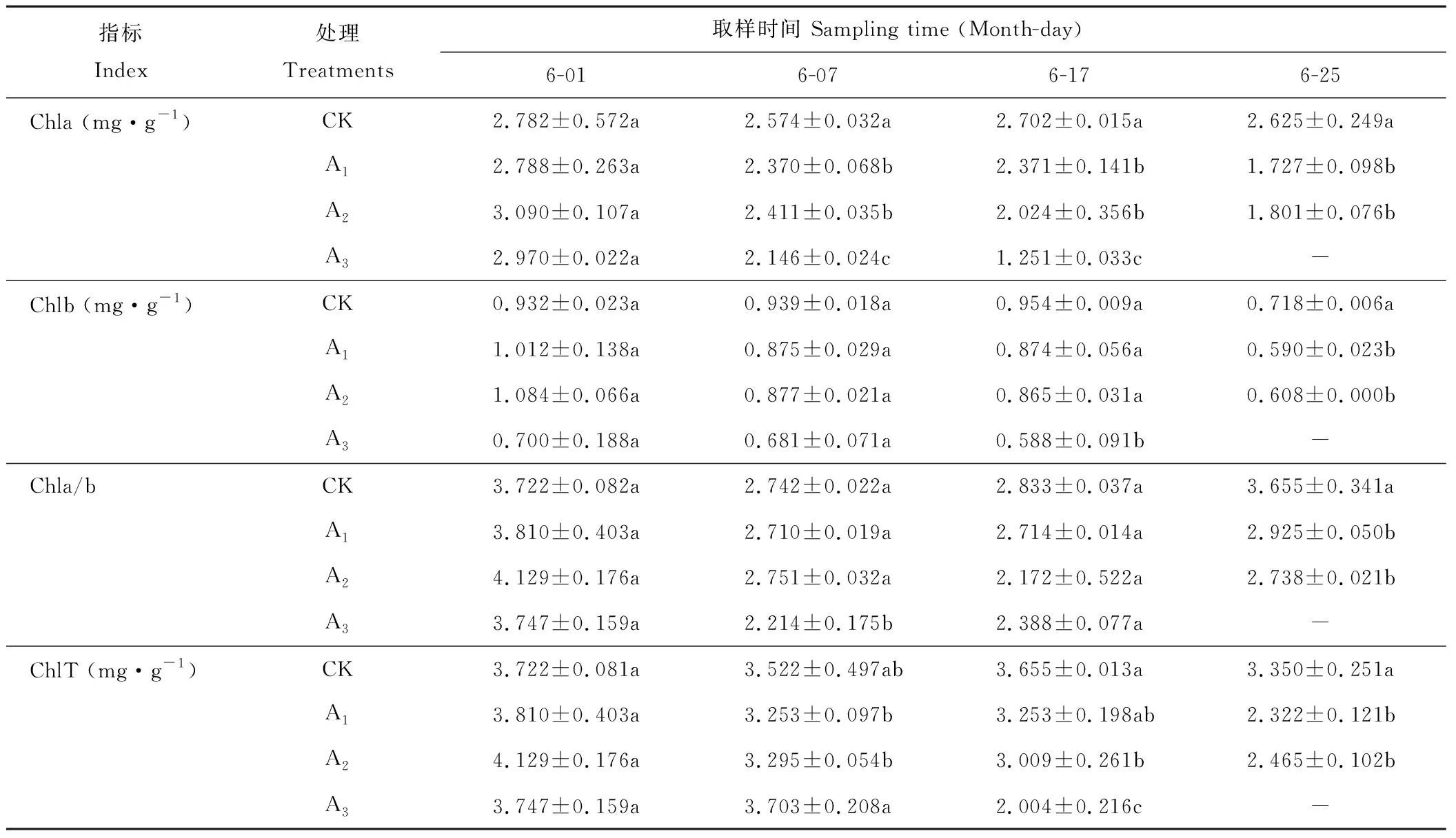
表1 不同浓度镉胁迫下梭鱼草叶片Chla、Chlb、ChlT含量及Chla/b的变化Table 1 Effects of Cd on Chla, Chlb, ChlT contents and Chla/b in P. cordata’s leaves
注:数据为平均值±平均误差(n=3),同一列内不同小写字母表示0.05水平显著差异性(P<0.05)。下同。
Note: Data are mean±SD (n=3). Different small letters in the same row indicate significant differences at theP<0.05 level. The same below.
2.4.4胞间二氧化碳浓度(Ci) 与对照相比,各处理下梭鱼草叶片Ci与Pn变化趋势较为一致(图3D)。第7天时镉胁迫下叶片Ci没有明显变化;第17和25天时镉胁迫下叶片Ci均显著低于对照组,其中5、25 mg·L-1镉胁迫结束时叶片Ci比对照组分别降低了21.90%、25.25%,这可能是由叶片Gs的下降而导致的。
2.4.5饱和蒸气压亏缺 (VPD)VPD是影响植物叶片蒸腾作用的主要因素之一。随着镉浓度的增加和胁迫时间的延长,梭鱼草叶片VPD呈上升趋势(图3E)。其中,5、25 mg·L-1镉胁迫结束时叶片VPD比对照分别升高了19.28%、41.77%,75 mg·L-1镉胁迫下叶片VPD第17天时比对照显著升高了22.50%,这可能会使其通过Gs而间接抑制光合作用。
2.5 镉胁迫对梭鱼草叶片叶绿素荧光特性的影响
2.5.1镉胁迫下梭鱼草叶片Fo的变化Fo为叶片暗适应后的最小荧光强度,其值的大小与Chla的含量有关,可反映环境胁迫对植物造成的伤害程度。如表2所示,与对照组相比,随着镉胁迫程度的增加和时间的延长,各处理下梭鱼草叶片Fo变化趋势有所不同。当镉浓度为5 mg·L-1时,叶片Fo与同期对照组差异不显著;当镉浓度为25、75 mg·L-1时,叶片Fo呈上升趋势,表明镉降低了梭鱼草叶片叶绿素原初光能转化效率下降,诱发光抑制,导致光系统Ⅱ(PSⅡ)反应中心失活。
2.5.2镉胁迫下梭鱼草叶片Fm的变化Fm为叶片暗适应后的最大荧光强度,可以反映环境胁迫下通过叶片PSⅡ反应中心电子传递的最大潜力。与对照组相比,当镉浓度为5、25 mg·L-1时,叶片Fm变化不明显;当镉浓度为75 mg·L-1时,叶片Fm呈上升趋势,第17天时比对照组增加了6.71%(表2),表明镉胁迫下梭鱼草叶片PQ库增加,有活力反应中心的数量显著增加。
2.5.3镉胁迫下梭鱼草叶片可变荧光强度的变化Vj、Vi分别为植物叶片在J、I相时的相对可变荧光强度,反映了电子经过质体醌A(QA)、质体醌B(QB)时的能量耗散比率。随着镉浓度的增加和胁迫时间的延长,梭鱼草叶片Vj、Vi均呈上升趋势(表2)。镉胁迫至17 d时,25、75 mg·L-1下叶片Vj比对照组分别增加了26.19%、19.05%;Vi比对照组分别增加了14.47%、10.53%,表明镉胁迫下梭鱼草叶片PSⅡ反应中心受体侧光合电子传递活性被抑制,这与质体醌QA和光系统I(PSI)的氧化还原反应受阻有关。
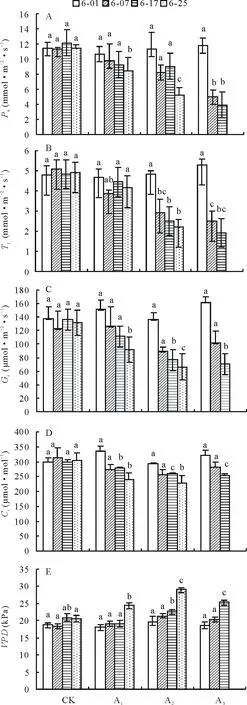
图3 镉胁迫对梭鱼草叶片光合气体交换参数的影响Fig.3 Effects of Cd on photosynthetic gas exchange parameters in P. cordata’s leaves
2.5.4镉胁迫下梭鱼草叶片Fv/Fm的变化Fv/Fm为植物叶片暗适应后PSⅡ的最大光化学效率,可以反映环境胁迫下叶片光抑制的程度。与对照组相比,不同浓度镉处理下梭鱼草叶片Fv/Fm的变化趋势存在一定的差异(表2)。当镉浓度为5、75 mg·L-1时,叶片Fv/Fm的变化不明显;当镉浓度为25 mg·L-1时,叶片Fv/Fm呈下降趋势,第17天时比对照组降低了5.95%,表明镉胁迫降低了梭鱼草叶片PSⅡ光化学活性及能量转化效率,这可能是因为镉抑制了PSⅡ反应中心QA到QB的电子传递,使非还原性QB积累较多,从而降低PSⅡ反应中心放氧活性。
2.5.5镉胁迫下梭鱼草叶片Fm/Fo和Fv/Fo的变化Fm/Fo为植物叶片PSⅡ反应中心电子传递效率,其可以反映植物对光能的利用效率。由表2可知,当镉浓度为5、75 mg·L-1时,梭鱼草叶片Fm/Fo没有明显的变化。第17天时,25 mg·L-1镉胁迫下叶片Fm/Fo比对照显著下降了24.22%,这是由Fo的上升幅度大于Fm而引起的,表明镉胁迫导致梭鱼草叶片光能利用效率降低。同时,镉胁迫下梭鱼草叶片Fm/Fo与Fv/Fo(PSⅡ反应中心的潜在活性)的变化规律一致,即随着叶片Fm/Fo的降低,PSⅡ反应中心的潜在活性呈下降趋势,从而导致光能转化为活跃化学能的效率降低。
2.5.6镉胁迫下梭鱼草叶片光能的吸收、传递与转化 不同浓度镉对梭鱼草叶片单位反应中心各种量子效率的影响如表2所示。第17天时25 mg·L-1镉胁迫下梭鱼草叶片单位反应中心吸收的能量(ABS/RC)、反应中心捕获的能量(TRo/RC)以及用于电子传递的能量(ETo/RC)比对照组增加了32.97%、42.48%和28.57%,且差异均达到显著水平,但同时单位反应中心热耗散的能量(DIo/RC)也比对照组显著增加了36.36%,与75 mg·L-1镉胁迫下叶片单位反应中心量子效率的变化趋势一致,表明镉胁迫下梭鱼草叶片捕光天线面积、反应中心捕获电子能力及进入电子传递链的能量增加,同时也有较多能量以热耗散的形式被释放,这可能是镉胁迫下梭鱼草进行自我保护的一种机制。
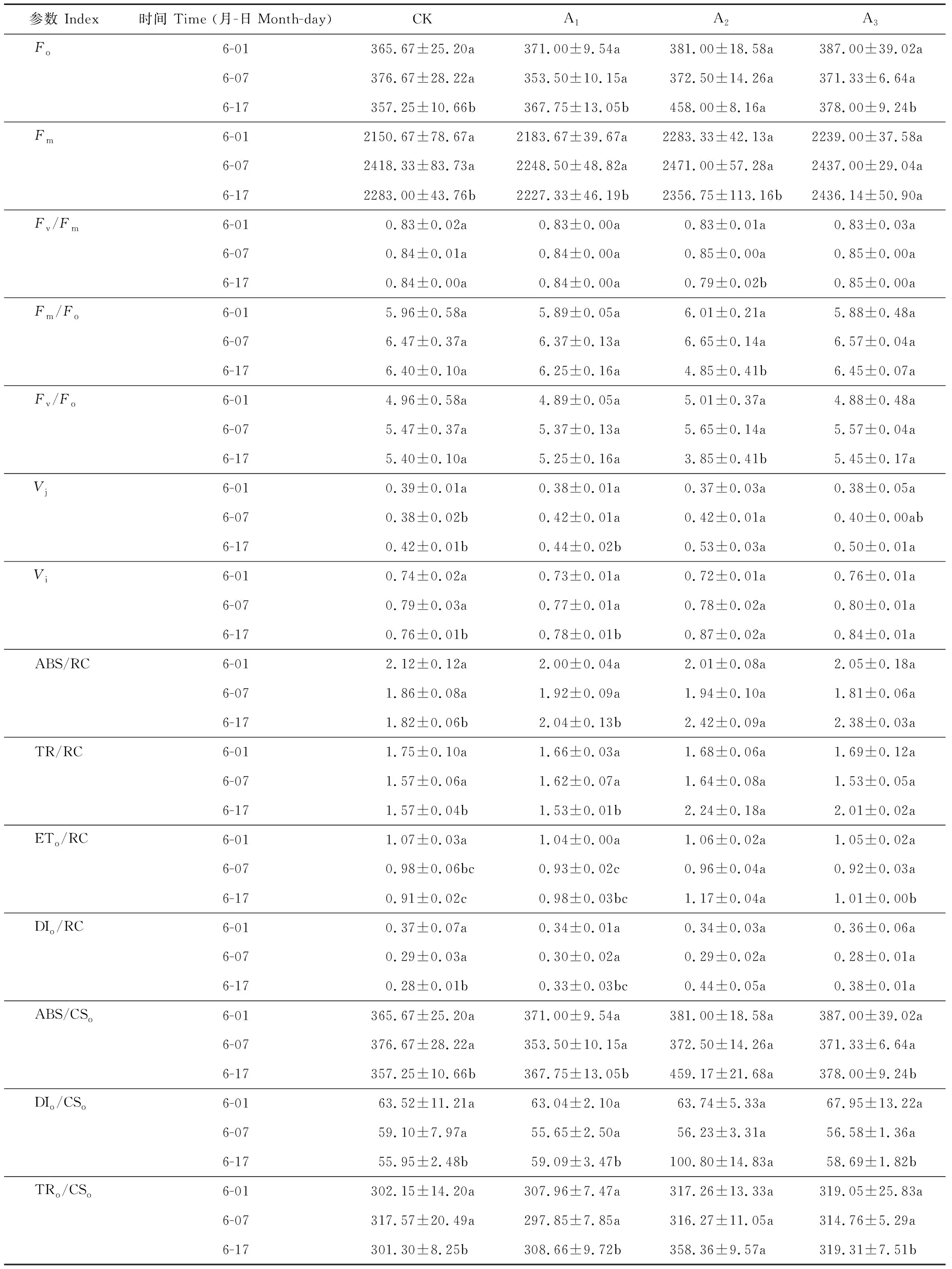
表2 镉胁迫下梭鱼草叶片叶绿素荧光参数的变化Table 2 Variations of chlorophyll fluorescence parameters in P. cordata’s leaves under Cd stress
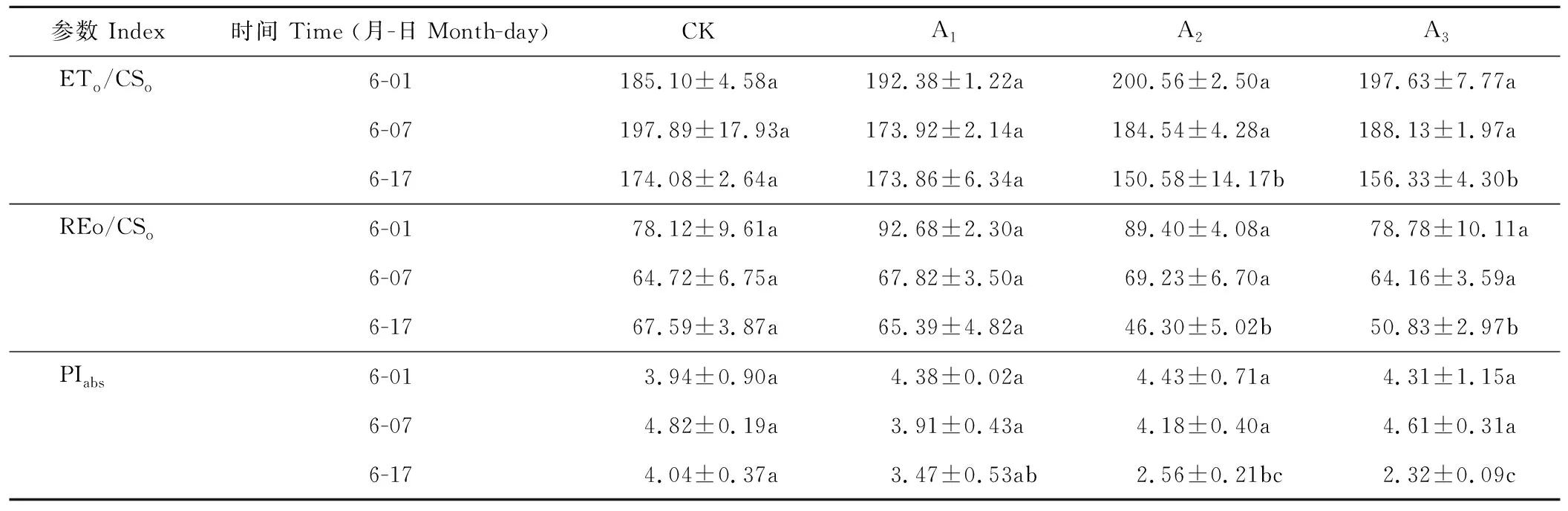
续表2 Continued Table 2
不同浓度镉对梭鱼草叶片单位面积各种量子效率的影响存在一定的差异(表2)。第17天时25 mg·L-1镉胁迫下梭鱼草叶片单位面积吸收的能量(ABS/CSo)、单位面积捕获的能量(TRo/CSo)比对照组显著增加了28.53%、18.94%,单位面积热耗散的能量(DIo/CSo)比对照组增加了80.16%,而单位面积用于电子传递的能量(ETo/CSo)、单位面积传递到电子链末端的能量(RE/CSo)则表现出相反的变化趋势,比对照组分别显著下降13.50%、31.50%;75 mg·L-1镉胁迫下叶片单位面积量子效率也表现出相似的变化趋势,表明镉胁迫下叶片单位面积有活性反应中心的数量增加,但仍会导致大部分的能量被热淬灭,从而抑制单位面积光能利用率、电子传递和PSI氧化还原过程。
2.5.7镉胁迫下梭鱼草叶片性能指数(PIabs)的变化 PIabs反映了植物叶片PSⅡ的总体性能,可以反映逆境胁迫下叶片PSⅡ功能与结构的变化。从表2可以看出,与对照组相比,随着镉浓度的增加和胁迫时间的延长,PIabs基本上呈下降趋势,镉胁迫下叶片PIabs在第17天比对照组分别下降了14.11%、57.82%和42.57%,表明镉胁迫导致梭鱼草叶片PSⅡ功能与结构受到了不同程度的损害,不利于光能向活跃化学能进行转变。
3 讨论
植物细胞膜为细胞生命活动提供相对稳定的内环境,是细胞内外物质运输与交换的重要屏障。当植物遭受逆境胁迫时,体内活性氧自由基积累,膜质过氧化作用加强,导致细胞膜透性增大,胞内电解质大量外渗,电导率增加。本研究中,高浓度(75 mg·L-1)镉处理下梭鱼草叶片相对电导率显著增加,这与曲丹阳等[20]的研究结果相一致,表明镉胁迫下叶片细胞膜结构损伤,膜系统的完整性被破坏;低浓度(5 mg·L-1)镉胁迫下叶片相对电导率能够保持较长时间的相对稳定性,这可能与镉诱导下梭鱼草体内抗氧化酶活性处于相对稳定的状态(图2)及根系的早期调控作用有关[21]。
植物体内存在着多种保护酶可以缓解或降低活性氧自由基对其造成的伤害[22-23],其中SOD是植物体内清除自由基的首要物质,能够将O2-·转化为H2O2和O2,而POD和CAT则可以将H2O2分解为H2O和O2,从而降低活性氧的含量[24-25]。当镉浓度超过一定范围之后,植物自身的调节作用将被破坏,导致细胞H2O2积累过多,从而加剧细胞膜受损程度,如蚕豆(Viciafaba)在50 μmol·L-1Cd2+处理9 d时,叶片SOD活性显著高于其他处理,同时叶片POD活性上升,但CAT活性被抑制,导致细胞内H2O2大量积累,从而对细胞产生毒害作用[26]。本研究中,镉胁迫下梭鱼草叶片SOD、POD及CAT活性均表现出不同的变化趋势,其中CAT活性变化基本不明显,而SOD、POD对镉胁迫的响应较为强烈,协调参与O2-·、H2O2的清除,以降低镉对梭鱼草膜系统的伤害程度,故低浓度(5 mg·L-1)镉对梭鱼草细胞的毒害作用较小,与其他学者在万寿菊(Tageteserecta)[27]、水稻(Oryzasativa)[28]等植物上的研究结果较为类似。但是,随着镉浓度的增加和胁迫时间的延长,梭鱼草细胞受害程度加剧,表明此时活性氧自由基的产生大于保护酶系统的清除能力[29]。
叶绿素是植物进行光合作用的重要物质基础,其含量的多少反映了植物光合效率的高低。研究表明,镉胁迫会使植物叶片叶绿素含量降低[30-31],这可能是因为镉胁迫阻碍了叶绿素分子结合色素-蛋白复合物的过程[32],也可能是镉胁迫通过抑制Fe2+、Mn2+及Mg2+等离子吸收和5-氨基酮戊酸脱水酶(ALAD)活性或提高叶绿素分解酶活性等途径干扰叶绿素的生物合成[33-34]。Ebrahim[35]指出,叶片衰老过程中Chla比Chlb含量下降速率更快。本研究发现,随着胁迫程度的增大和时间的延长,梭鱼草叶片ChlT含量呈下降趋势,叶片Chla含量显著下降的时间早于Chlb,同时Chla/b的变化反映出Chla含量的下降大于Chlb含量,与Xue等[36]对镉胁迫下大豆(Glycinemax)幼苗叶片Chla、Chlb含量及Chla/b比值变化的研究结果相一致。叶绿素a是光能的“捕捉器”和“转换器”,其含量降低会抑制梭鱼草叶片光合作用,使植株出现叶片发黄、凋落甚至死亡现象。
镉积累会导致叶片PSⅡ反应中心受损,如D1蛋白质降解[37]或水裂解蛋白酶活性下降[38],从而抑制植物光合作用[39-40]。本试验中,随着镉浓度的增加和胁迫时间的延长,梭鱼草叶片Pn表现为下降趋势,表明镉胁迫导致梭鱼草叶片光合碳同化的能力下降,同时叶片Pn的下降也伴随着E、Gs及Ci的下降,这与其他学者对镉胁迫下玉米(Zeamays)[41]、水龙(Jussiaearapens)[42]等植物叶片光合气体交换参数变化的研究结果相一致。气孔是植物与大气进行气体交换的主要通道,为植物叶片的光合作用提供CO2,因此镉胁迫下梭鱼草叶片Pn的降低与Gs的下降有着直接的关系[44],同时也可能与叶绿体ATP合酶和硝酸还原酶活性的降低有关[44-45]。
叶绿素荧光特性是叶片PSⅡ光化学过程的指示器,可以反映逆境对PSⅡ活性、电子传递及能量分配的影响。研究表明,镉离子(Cd2+)能够替代叶绿素分子中心位置的镁离子(Mg2+),从而改变叶绿素荧光参数[46]。本试验中,在前期(第1,7天)各处理对梭鱼草叶片叶绿素荧光特性基本上没有影响,表明梭鱼草对镉具有一定的耐受性;但随着胁迫时间的推移,25、75 mg·L-1镉胁迫下梭鱼草叶片Fo、Vj及Vi明显上升,Fv/Fm、Fm/Fo、Fv/Fo和PIabs则呈下降趋势,其中PIabs比Fv/Fm更能准确反映PSⅡ活性的变化,与Von Heerden等[47]的研究结果一致,这意味着梭鱼草叶片光合作用发生了光抑制,光合电子传递系统的活性、光能利用及转化效率降低,但其可以通过激活未活化的反应中心来适应镉胁迫,具体表现为叶片Fm的上升。
合理的能量分配机制是植物适应逆境胁迫的重要策略,同时也是光保护的重要机制之一。本试验中,后期(第17天时)25 mg·L-1镉胁迫显著影响了梭鱼草叶片PSⅡ反应中心光能的分配参数。首先,由于光抑制导致梭鱼草叶片ABS/RC、TRo/RC及ETo/RC显著增加,过剩激发能通过非光化学途径进行耗散以减少镉胁迫下活性氧自由基的产生及缓解其对光合机构的破坏,从而促使单位反应中心能量耗散(DIo/RC)的上升,与Ali等[48]的研究结果相一致,这对于维持梭鱼草叶片光能吸收和利用之间的平衡及光合碳同化能力具有重要意义。其次,与对照组相比,梭鱼草叶片ABS/CSo显著增加,从而导致单位面积上用于还原QA的激发能(TRo/CSo)增加。镉胁迫下叶片PSⅡ反应中心过剩的激发能以电子的形式存在于电子传递链中,本研究中梭鱼草叶片ETo/CSo和RE/CSo显著下降,导致叶片DIo/CSo显著增加,表明镉胁迫下梭鱼草叶片光能利用效率降低,但其可通过增加热耗散来降低PSⅡ反应中心过剩的激发能,从而缓解PSⅡ反应中心光抑制[49]。
4 结论
本研究表明,梭鱼草可以通过调节保护酶系统以适应低浓度(5 mg·L-1)镉胁迫。由于保护酶系统的调节作用有限,随镉浓度的增大和处理时间的延长,梭鱼草叶片细胞膜结构完整性被破坏;同时叶片光合作用发生光抑制,这可能与叶绿素含量、气孔导度下降以及PSⅡ活性受损有关,但其能够激活未活化的反应中心以适应镉胁迫,并通过非光化学淬灭能量以保护光合机构免受破坏。
