AMD1在胃癌中的表达及其与临床病理特征的关联*
2018-10-19苏文雨王吉林房静远
苏文雨 王吉林 房静远
上海交通大学医学院附属仁济医院消化内科 上海市消化疾病研究所(200001)
背景:S-腺苷甲硫氨酸脱羧酶1(AMD1)是调控多胺代谢的限速酶,多胺代谢异常可引起细胞恶性转化。目前多胺代谢已成为近年肿瘤领域的研究热点。目的:探讨AMD1在胃癌中的表达及其与临床病理特征的相关性。方法:采用免疫组化法检测72例胃癌及其癌旁组织中的AMD1表达,并分析其与胃癌临床病理特征的相关性。培养胃癌细胞MGC803,以AMD1-siRNA和AMD1抑制剂MGBG分别干预胃癌细胞,CCK-8法检测胃癌细胞增殖情况。结果:AMD1在65.3%的胃癌组织中高表达,其表达与肿瘤直径、肿瘤浸润深度密切相关(P<0.05),而与患者性别、年龄、TNM分期、淋巴结转移和远处转移无明显相关性(P>0.05)。以AMD1-siRNA和MGBG干预胃癌细胞后,细胞增殖力均明显下降(P<0.05)。结论:AMD1在胃癌中的表达升高,与肿瘤直径和肿瘤浸润深度密切相关;AMD1通过影响细胞增殖而参与胃癌的发生,有望成为胃癌诊断和治疗的新靶点。
Background:Adenosylmethionine decarboxylase 1 (AMD1) is a rate-limiting enzyme in the regulation of polyamine metabolism. Abnormal polyamine metabolism can lead to the cell malignant transformation. Polyamine metabolism has become a hot topic in the field of tumor research in recent years.Aims:To investigate the expression and correlation of AMD1 with clinicopathological characteristics in gastric cancer.Methods:The expression of AMD1 in gastric cancer tissue and paracancerous tissue were detected by immunohistochemical staining, and its correlation with clinicopathological characteristics of gastric cancer was analyzed. Gastric cancer cell MGC803 was cultured, AMD1-siRNA and AMD1 inhibitor MGBG were used to intervene the gastric cancer cell, and cell proliferation was assessed by CCK-8 assay.Results:AMD1 was highly expressed in 65.3% of gastric cancer, and its expression was closely related to tumor diameter and tumor depth of infiltration (P<0.05), but not related to gender, age, TNM staging, lymph node metastasis, and distant metastasis (P>0.05). After intervention with AMD1-siRNA or MGBG, cell proliferation of MGC803 cells were significantly decreased (P<0.05). Conclusions:AMD1 is highly expressed in gastric cancer and correlated with the tumor diameter and depth of infiltration. AMD1 is involved in development of gastric cancer through regulation of cell proliferation, and is expected to be a new target for the diagnosis and treatment of gastric cancer.
多胺(polyamine)包括精脒(spermidine)、精胺(spermine)和腐胺(putrescine),是广泛存在于真核细胞的一类低分子脂肪族阳离子化合物,是细胞生长的必需组分,是合成核酸、蛋白质所必需的一种调控物质。多胺可通过与带负电荷的生物大分子结合,影响DNA复制、转录和蛋白质的功能,从而广泛参与细胞增殖、分化、细胞信号转导、修饰蛋白激酶等过程[1]。肿瘤的快速生长也有赖于细胞内多胺含量,其代谢异常亦可引起细胞的恶性转化,目前多胺代谢过程已成为近年肿瘤领域的研究热点[2]。S-腺苷甲硫氨酸脱羧酶1(adenosylmethionine decarboxylase 1, AMD1)又称为SAMDC,是调控多胺代谢的限速酶[3-4]。在淋巴瘤中,AMD1通过调节真核细胞翻译起始因子5A(eIF5A)翻译后修饰来发挥抑癌基因的作用[5];在前列腺癌中,AMD1通过调控mTOR通路影响肿瘤细胞增殖,从而促进肿瘤的发生[6];AMD1在乳腺癌的发生、发展中亦起有重要作用[3]。但AMD1在胃癌中的表达及其作用的报道目前较少见。本研究通过检测AMD1在胃癌及其癌旁组织中的表达,并分析其与临床病理特征的相关性,同时通过抑制胃癌细胞中AMD1的表达和活性,检测胃癌细胞增殖情况,旨在为探讨AMD1在胃癌发生、发展中的作用提供理论依据。
材料与方法
一、资料来源
组织芯片购自上海芯超生物科技有限公司,包含72例胃癌组织及其癌旁组织,其中男性40例,女性32例,诊断均经术后病理检查证实。
二、研究方法
1. 免疫组化染色:组织芯片以3% H2O2预处理15 min,消除内源性过氧化物酶活性,并以柠檬酸盐缓冲液微波加热修复15 min后自然冷却至室温。滴加非免疫性山羊血清,室温封闭30 min。滴加抗AMD1抗体(Sigma-Aldrich,工作浓度为1∶50),4 ℃湿盒过夜后复温30 min,并以PBS缓冲液漂洗3次。滴加辣根过氧化物酶(HRP)标记的二抗,DAB显色,苏木精复染,自然晾干后中性树胶封片。
结果判断:细胞核呈棕褐色者为AMD1阳性细胞。随机选取5个高倍视野(×400),计数阳性细胞,根据阳性细胞数量分为四级:0级,无阳性细胞;1级,1~5个;2级,6~15个;3级,>15个。0级为AMD1不表达,1级为低表达,2~3级为高表达。
2. 细胞株、主要试剂:人胃癌细胞株MGC803(购自中国科学院上海生科院细胞资源中心,由上海市消化疾病研究所保存);RPMI-1640培养基、胎牛血清(Thermo Fisher Scientific);HiPerFect转染试剂(QIAGEN),AMD1抑制剂MGBG(北京北实纵横科技发展有限公司),AMD1-siRNA序列:正义链:5’-UUC UCC GAA CGU GUC ACG UTT-3’,反义链:5’-ACG UGA CAC GUU CGG AGA ATT-3’;Cell Counting Kit 8(CCK-8)试剂盒(同仁化学研究所)。
3. 细胞培养和干预:将MGC803细胞培养于含5%胎牛血清的RPMI-1640完全培养基中,生长至对数生长期后,按1.0×104个/孔的密度接种于96孔板,待细胞贴壁密度达70%后进行转染。
siRNA干预组:取0.5 μL预先配好的2 μmol/L siRNA(control-siRNA 或AMD1-siRNA)溶于2 μL去RNase水中,将0.75 μL HiPerFect转染试剂加入24.25 μL无血清培养基中,混匀siRNA和转染试剂,常温孵育10 min,然后加入96孔板中与无血清培养基混匀。37 ℃培养6 h后更换为含血清的培养基继续培养48 h。
AMD1抑制剂干预组:取DMSO或MGBG各0.2 μL加入无血清培养基,使药物终浓度达10 μmol/L,取100 μL分别加入96孔板中,37 ℃培养6 h后更换为含血清的培养基继续培养48 h。
4. CCK-8法:取MGBG或AMD1-siRNA干预48 h 的细胞,在避光条件下,将无血清RPMI-1640培养基与CCK-8试剂按9∶1的体积比混匀。吸去原有培养基,每孔加入100 μL上述CCK-8稀释液,37 ℃、5% CO2培养箱中孵育40 min;于波长450 nm处,上酶联免疫检测仪测定各孔吸光度(A)值,计算细胞增殖力。细胞增殖力(%)=(干预组A450 nm-空白组A450 nm)/(对照组A450 nm-空白组A450 nm)×100%,每组设3个复孔,实验重复3次,取均值。
三、统计学分析
结 果
一、AMD1在胃癌中的表达
72例胃癌患者中,与癌旁组织相比,胃癌组织AMD1表达明显升高(P<0.01)(图1)。
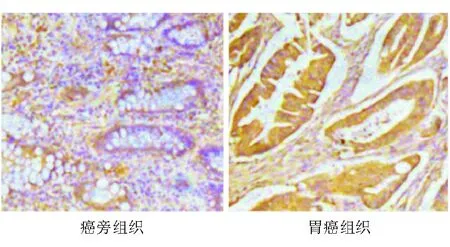
图1AMD1在胃癌及其癌旁组织中的表达(免疫组化染色,×200)
二、AMD1表达与胃癌临床病理特征的关系
72例胃癌患者中,47例(65.3%)AMD1呈高表达,且与肿瘤直径、肿瘤浸润深度密切相关(P<0.05),而与患者性别、年龄、TNM分期、淋巴结转移和远处转移无明显相关性(P>0.05)(表1)。

表1 AMD1表达与胃癌临床病理特征的关系(n)
三、AMD1对胃癌细胞增殖的影响
以AMD1-siRNA和AMD1抑制剂MGBG分别干预胃癌细胞MGC803后,胃癌细胞增殖力均较对照组明显降低(图2)。
讨 论
胃癌是引起全球肿瘤患者死因的第三大肿瘤[7],其发生是一个涉及多因素、多步骤的病理过程,具体发病机制尚待进一步探讨。多胺在器官发育、炎症、肿瘤、糖尿病、干细胞、肾脏疾病等生理和病理过程中发挥重要的调控作用[8-9],肿瘤细胞的快速增殖、迁移和侵袭能力依赖细胞内高浓度多胺,且肿瘤组织中多胺含量高是患者预后不良的重要指标[3,10-13]。AMD1主要通过催化S-腺苷甲硫氨酸脱羧产生脱羧S-腺苷甲硫氨酸,为精脒和精胺的生成提供氨丙基基团,从而调节细胞内多胺水平。Gupta等[3]的研究发现沉默AMD1表达后,可明显抑制乳腺癌细胞MCF7增殖和侵袭能力;Paasinen-Sohns等[14]发现,过表达AMD1可通过诱导异常血管形成促进肿瘤转移;Zhang等[15]报道,AMD1在调节干细胞的自我更新和分化中亦发挥重要作用。

图2AMD1-siRNA和AMD1抑制剂MGBG对胃癌细胞MGC803增殖的影响(CCK-8法)
本研究发现,与癌旁组织相比,AMD1在胃癌中的表达明显上调,且AMD1高表达与肿瘤直径、肿瘤浸润深度密切相关(P<0.05),而与患者性别、年龄、TNM分期、淋巴结转移和远处转移无明显相关性(P>0.05),提示AMD1与胃癌的发生、发展密切相关。MGBG为AMD1的竞争性抑制剂,可抑制精脒和精胺的生物合成。本研究以MGBG干预胃癌细胞,结果显示抑制AMD1活性后,胃癌细胞增殖力明显下降;同时以siRNA下调AMD1表达,胃癌细胞增殖力亦下调。提示AMD1一方面通过改变自身酶活性发挥调控的作用,另一方面通过改变自身表达来参与细胞增殖力的调控。eIF5A是重要的真核细胞蛋白翻译起始因子,其主要功能是促进蛋白质翻译的延伸,eIF5A的羟腐胺赖氨酸修饰是其激活的前提,细胞中多胺含量可改变eIF5A的羟腐胺赖氨酸修饰程度,从而影响eIF5A的活性[16]。eIF5A通过调控E-cadherin、MTA1、c-Myc等基因参与多种肿瘤的过度增殖[17-18]。Sievert等[19]发现eIF5A的促癌作用与多胺过表达密切相关;推测AMD1在胃癌中的调控作用可能是通过多胺代谢激活eIF5A继而调控相关癌基因的过表达而实现的,但具体调控机制有待于进一步验证。
总之,以多胺-羟腐胺赖氨酸轴为中心的多胺代谢网络在真核生物中广泛存在,该网络紊乱与许多肿瘤的发生密切相关,多胺代谢途径中的限速酶已成为近年抗肿瘤治疗和分子靶向药物研发的新靶点。本研究发现胃癌患者AMD1表达升高,且与肿瘤直径、浸润深度密切相关,且AMD1能通过两种方式参与调控胃癌细胞增殖力。随着对AMD1在胃癌发生中作用的研究的进一步深入,其有望成为胃癌诊断和治疗的新靶点。
