益骨汤对骨质疏松大鼠成骨细胞相关基因表达的实验研究*
2018-10-19李桂锦姚新苗
李桂锦 姚新苗
浙江中医药大学附属第三医院 浙江 杭州 310005
WNT10b、β-catenin、BMP-2、BMP-4、DKK1表达水平的变化,探讨益骨汤治疗骨质疏松的可能机制。
1 材料与方法
1.1 实验动物:采用SPF级12周龄雌性SD大鼠100只,体重200±10g,浙江中医药大学实验动物中心提供,许可证号:SCXK(沪)20080016,用于造模。
1.2 主要试剂与仪器:益骨口服液(方由补骨脂10g,骨碎补、生地、仙灵脾、怀山药各15g,丹参30g组成),由浙江省中医院中药房提供,制成含生药量1.0g/ml的水提液,用于去势大鼠灌胃治疗);倍美力水溶液:美国惠氏艾尔斯特制药公司艾尔斯特药厂制造,产品批号0502090,国药准字(2001)J51(2)号。水溶液浓度为9.4μg/ml。氯氨酮:上海第一生化药业有限公司生产,批号沪卫药准字(1995)第001064号;DKK1反义寡核苷酸序列如下:5′-TCTGGTCCAAGATCTGAT-3′由上海生物工程合成;WNT10b、β-catenin、BMP2、BMP4、DKK1酶联免疫检测试剂盒(R&D Systems美国);WNT10b、βcatenin、BMP-2、BMP-4、DKK1的PCR引物(艾菲生物技术有限公司);PCR仪(BIO-RAD 美国);紫外分析图像处理仪(上海天能科技有限公司);电泳仪(BIO-RAD 美国);半自动生化分析仪(上海三科仪器有限公司);紫外分光光度计(Eppendorf 德国);海尔冰箱(青岛海尔股份有限公司);液氮容器(乐山市东亚机电工贸有限公司);双能X线骨密度仪(型号:DPX-L美国LUNAR公司)。
1.3 实验分组:随机分为A组(假手术组)、B组(益骨汤治疗组)、C组(倍美力阳性对照组)、D组(正常对照组)、E组(DKK-1反义寡核苷酸对照组)5组,分16笼以常规饲料喂养,自由饮水。饲养室保持良好通风,室温控制在21±1℃,湿度63%,噪音<55分贝,自由摄食、饮水,光照与黑暗时间为每12h交替。
1.4 动物造模:大鼠采用氯胺酮按0.1g/kg进行腹腔麻醉,然后打开B、C、D、E组大鼠腹腔,去除双侧卵巢,逐层缝合;A组大鼠仅予以单纯剖腹后立即关闭。术后予以青霉素肌注预防感染,按4万U/只/d,持续3d。
1.5 饲养与给药:造模术后将SD大鼠分16笼予以常规饲料喂养12周,第13周起开始每天给药,A、D组以蒸馏水10ml/kg灌胃;B组以10ml/kg的益骨汤水提液灌胃;C组以浓度为9.4μg/ml倍美力水溶液10ml/kg灌胃,整个灌胃过程持续12周;E组予以DKK1反义寡核苷酸腹膜内注射20μg/kg/d,持续12周。
1.6 股骨骨密度检测:取大鼠股骨,剔除周围的肌肉,密封保存标本于-20℃冰箱内,采用双能X线骨密度测量仪,通过计算机系统软件,测量每只大鼠股骨BMD,取平均值,BMD值用g/cm2表示。
1.7 Wnt/β-catenin信号通路相关目的基因的提取、检测:采用Trizol法提取组织总RNA,紫外分光光度仪测定各组提取的总RNA浓度。

表1 各基因引物序列
1.8 WNT10b、β-catenin、BMP-2、BMP-4、DKK1 mRNA的表达:根据NCBI网站GeneBank查询目的基因WNT10b、β-catenin、BMP-2、BMP-4、DKK1 mRNA序列,引物合成使用Primer Premier 5.0软件,序列见表1。RNA定量后反转录合成第一链cDNA,用荧光定量PCR系统进行PCR反应,PCR总反应体系(25μl)为:加入TaqcDNA聚合酶1μl,10×PCR反应缓冲液4μl,dNTP 2μl,上下游引物各0.5μl,cDNA产物5μl和灭菌水12μl,按照各目的基因退火温度选择三步法完成扩增,循环45次。根据熔解曲线判断PCR扩增产物的特异性,由所得的循环阈值(Ct),根据 2-△△Ct法分别计算目的基因 DKK1、βcatenin在各组中的表达量。
1.9 统计学方法:采用SPSS17.0软件进行分析统计,计量资料以均数±标准差(-x±s)表示,各组数据的两两比较采用单因素方差分析(One-way ANOVA),方差齐性采用LSD法,以P<0.05为差异有统计学意义。
2 结果
2.1 各组骨密度比较:与A组比较,D组骨密度明显降低,差异有统计学意义(P<0.01),说明造模成功;B组、C组、E组的骨密度均明显高于D组(正常对照组),差异有统计学意义(P<0.01);B组的骨密度与C组比较差异无统计学意义(P>0.05)。见表2。
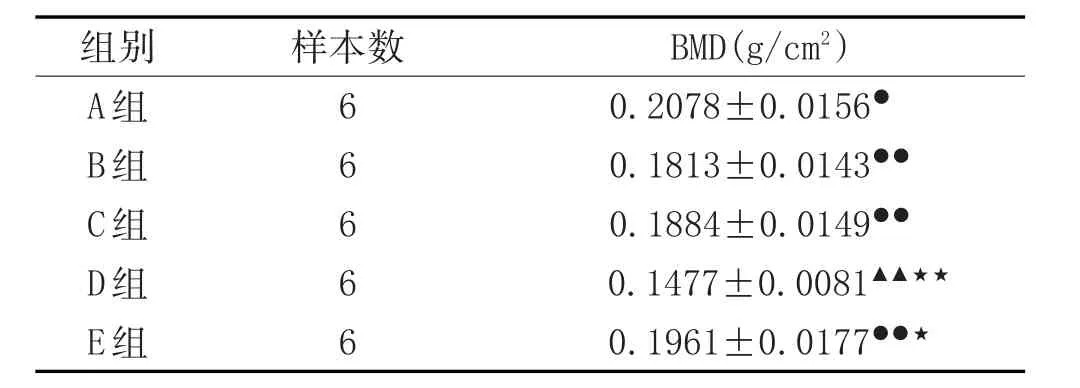
表2 各组去势大鼠右股骨上端骨密度结果比较(-x±s)
2.2 各组大鼠 WNT10b、β-catenin、BMP-2、BMP-4、DKK1蛋白含量比较:与D组比较,B组、C组、E组WNT10b、β-catenin、BMP-2、BMP-4蛋白光密度增加,DKK1蛋白光密度减少,差异有统计学意义(P<0.05,P<0.01);B组DKK1蛋白光密度与C组比较,差异有统计学意义(P<0.05);E组WNT10b蛋白光密度低于B组,差异有统计学意义(P<0.05)。见表3。

表3 各组大鼠成骨细胞5组蛋白光密度的变化(-x±s)
2.3 mRNA水平检测:各组Wnt10b、β-catenin、BMP-2、BMP-4、DKK1相对表达水平的荧光定量PCR扩增曲线分析表明,各基因的荧光定量RT-PCR均为特异性扩增。同时,荧光定量RT-PCR产物的溶解曲线分析也表明,各基因的荧光定量RT-PCR均为单一的溶解峰。以正常对照组作为校验样本,以β-catenin作为参照基因,用2-△△CT方法计算相对基因表达量,D 组的 WNT10b、βcatenin、BMP-2、BMP-4的表达量低于A组(伪去势组),而DKK1的表达量明显高于伪去势组,说明去除大鼠卵巢,可以使DKK1过度表达;而B组的WNT10b、βcatenin、BMP-2、BMP-4的表达量高于A组,DKK1的表达量低于A组。见图1。
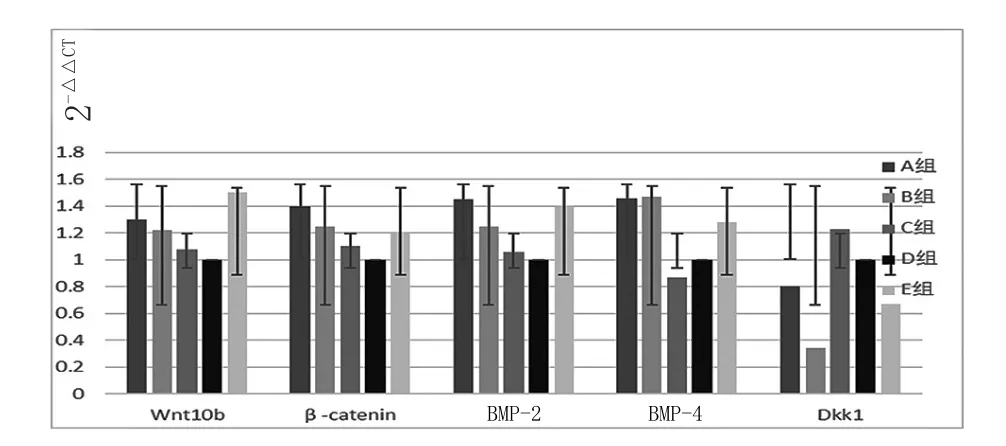
图1 各组Wnt10b、β-catenin、BMP-2、BMP-4、DKK1基因表达分析
3 讨论
中医学无“骨质疏松”病名,但根据其临床表现,可归属于中医学中“骨痿”“骨枯”“骨痹”等范畴,认为病变在骨,其本在肾,其病性多虚多瘀、本虚标实。补肾活血法体现中医标本兼顾的思想,是治疗骨质疏松的主要治法。益骨汤是姚新苗教授根据补肾活血的治疗方法,并结合多年临床经验提炼的治疗骨质疏松症验方,由补骨脂、骨碎补、生地、仙灵脾、怀山药、丹参等6味中药配伍而成。方中补骨脂、骨碎补为君药,补肾填精,强壮筋骨;生地、仙灵脾补肾滋阴;脾为后天之源,脾主肌肉,取怀山药为臣药;因久病必瘀,而致疼痛,以丹参活血化瘀。
近年来研究认为,绝经后骨质疏松症的发病机理主要为绝经后雌激素水平降低改变了成骨细胞、破骨细胞的功能、数量、寿命,从而影响骨形成、骨吸收偶联,进而导致绝经后骨质疏松症的形成[1],骨重建使人体的骨代谢保持在动态平衡状态。骨重建包括破骨细胞介导的骨吸收以及成骨细胞介导的骨形成[2]。如骨吸收超过了骨形成的代偿,就会导致骨质疏松。因此治疗骨质疏松可以从促进成骨细胞及抑制破骨细胞两方面着手。成骨细胞能够促进骨组织的发育、形成和重建,同时加强骨质量及骨强度。研究认为多种信号通路均能影响成骨细胞增殖,而其中经典WNT信号通路、BMP-2通路活化与促成骨细胞增殖是近年来研究的热点。WNT信号通路中βcatenin、WNT10b蛋白与OP的发生密切相关[3],WNT10b基因缺失小鼠其成骨细胞数量及活性显著下降,并导致骨质疏松症的发生[4],β-catenin经过WNT/LRP5/βcatenin/TCF/LEF级联反应过程促使下游成骨靶基因的表达[5],DKK1是经典WNT信号通路的抑制剂,能特异性的抑制经典WNT/β-catenin信号通路[6]。研究[7]证实BMP信号通路能调控成骨细胞生命周期的各个方面。BMP家族中BMP-2是促进骨形成和诱导成骨细胞分化重要的细胞外信号分子之一,有研究[8]表明BMP-4参与骨修复过程,是其他骨局部生长因子发挥生物学效应的必需因子。
本研究通过骨密度测定结果,我们发现B组、C组、E组成骨细胞数量明显增加,高于正常对照组。而B组又明显高于其他对照组,从以上结果可以确定益骨汤、DKK-1反义寡核苷酸能促进成骨细胞分化、增殖,加速骨形成,从而治疗骨质疏松症。蛋白测定及PCR结果显示B组、E组对WNT10b、β-catenin、BMP-2、BMP-4表达比D组明显上调(P<0.05),且B组4基因的表达明显高于其他组;而B组DKK1的表达比D组明显下调(P<0.05);此结果说明益骨汤能够促进WNT10b、βcatenin、BMP-2、BMP-4基因表达上调,可以抑制DKK1在成骨细胞增殖中的过度表达,从而推断,益骨汤促骨质疏松成骨细胞增殖机制与上调WNT10b、β-catenin、BMP-2、BMP-4在成骨细胞的表达,抑制DKK1过度表达有关。益骨汤可能通过调节经典WNT信号通路和BMP-2信号通路的相互关系,来实现诱导成骨细胞增殖,但其具体的机制有待于进一步研究。
4 参考文献
[1]谢肇,李起鸿.绝经后骨质疏松症的细胞凋亡及其调控机制[J].中华老年医学杂志,2004,23(6):436-438.
[2]Erben RG.Hypothesis:Coupling between resorption and formation in cancellous bone remodeling is a mechanically controlled event[J].Front Endocrinol(Lausanne),2015,6(5):82.
[3]王雨,苗永霸,王银,等.枸杞多糖含药血清对大鼠骨髓间充质干细胞成骨诱导过程及Wnt信号通路的影响[J].宁夏医科大学学报,2017,39(5):525-528.
[4]P.Wend,K.Wend,S.A.Krum,et al,The role of WNT10B in physiology and disease[J].Acta Physiol,2012,204(1):34-51.
[5]王燕,刘岩,马剑侠,等.Wnt/LRP5/β-catenin信号通路在绝经后骨质疏松发病中的作用[J].中华妇产科杂志,2011,46(10):769-772.
[6]Nishio Y,Dong Y,Paris M,et a1.Runx2-mediated regulation of the zinc finger Osterix/Sp7 gene[J].Gene,2006,372(2):62-70.
[7]X Cao,D Chen.The BMP signaling and in vivo bone formation[J].Gene,2005,357(1):1-8.
[8]胡静,郑洪新.骨质疏松大鼠的骨形成蛋白-4诱导成骨信号转导机制变化[J].中国老年学杂志,2009,19(10):2462-2465.
