万珂增强NK细胞对前列腺癌细胞杀伤作用的实验研究*
2018-10-18胡炜刘丹陈曲王嵬
胡炜,刘丹,陈曲,王嵬
(辽宁省锦州市中心医院 肿瘤科,辽宁 锦州 121001)
人类的先天性免疫系统中,自然杀伤细胞(natural killer cell,NK)为其重要组成部分,尤其在肿瘤免疫治疗中,更发挥了重要作用。NK细胞可以通过各种有效的杀伤机制,杀伤同系、同种或异种瘤细胞,包括释放穿孔素和颗粒酶、通过死亡受体调节肿瘤细胞的凋亡等[1-3]。NK细胞表面具有活化性受体和抑制性受体,两者间的平衡状态是其能否发挥细胞毒效应的决定因素[4]。抑制性受体主要是杀伤细胞免疫球蛋白样受体,可以特异性地与细胞表面的人白细胞抗原-I(human leucocyte antige-I,HLA-I)类分子结合,参与NK细胞的活化过程,抑制由活化性受体激发的细胞毒性作用。有研究证明,蛋白酶体抑制剂—万珂(化学名硼替佐米)通过促进T淋巴细胞和NK细胞上表达的死亡配体—肿瘤坏死因子相关凋亡诱导配体(TNF-related apoptosis-inducing ligand,TRAIL)连接到死亡受体4(death receptors 4,DR4)和DR5,引起肿瘤细胞的凋亡[5]。然而在前列腺癌细胞中,万珂致敏NK细胞杀伤肿瘤是否也是通过肿瘤细胞的抑制性配体实现,还未见报道。本研究用2种激素依赖性和激素非依赖性前列腺癌细胞株LNCaP和DU145为模型,探讨万珂是否可以致敏NK细胞对肿瘤的作用及其作用机制。NK细胞。经Ficoll-Paque Plus密度梯度离心,吸取界面层的外周血单个核细胞,用预冷Reaction buffer将单个核细胞的浓度调整为1×108个/ml,加入生物素化的抗体,混匀,孵育15 min,在混悬液中加入50μl磁珠,再次混匀,继续孵育15 min,将对细胞混悬液进行洗涤。将洗涤后的混悬液转移至磁场中,带磁力的细胞移至磁场中,6 min后吸除上清液,剩余NK细胞。将剩余的NK细胞在含10%胎牛血清和500 u/ml重组人白介素-2的RPMI 1640培养基中培养24 h,活化NK细胞。采用FITC-CD3和PE-CD56鼠抗人单抗标记NK细胞,用流式细胞仪分析CD3-CD56+细胞百分比以检测NK的纯度。本实验纯化的细胞中NK细胞>85%。
1 材料与方法
1.1 材料
万珂(美国Millennium Pharmaceuticals公司),NK分离试剂盒(美国RD公司RPMI 1640,胎牛血清(天津灏洋生物有限公司),胰蛋白酶(美国HyClone公司),荧光标记抗体藻红蛋白(Phycoerethrin,PE)标记的抗人DR5抗体、抗人Fas抗体、抗人HLAABC抗体购自美国Biolegend公司,Trizol试剂(美国Invitrogen公司),实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRTPCR)试剂盒(日本TaKaRa公司)。
1.2 方法
1.2.1 细胞培养 DU145、LNCaP细胞培养使用RPMI 1640培养基,培养基中含10%胎牛血清,2种细胞呈单层贴壁生长,用胰酶进行消化传代,待细胞呈对数生长时可进行实验。经各种因素处理后可进行指标检测。
1.2.2 NK细胞的分离及鉴定 取健康志愿者抗凝外周血20 ml,按NK细胞分离试剂盒说明书操作,分离
1.2.3 Annexin-V/PI法 20 nmol/L万珂处理DU145和LNCaP细胞48 h,记数细胞后,在每孔种植相同数量的细胞,细胞贴壁24 h。NK细胞以1∶1效靶比与肿瘤细胞共孵育6 d。收集所有细胞,用Annexin-V/PI法测定细胞的凋亡率。
1.2.4 流式细胞仪 取对数期生长的DU145、LNCaP细胞,不同浓度(0、10和20 nmol/L)万珂处理2种前列腺癌细胞株24 h,分别收集各组DU145、LNCaP细胞,磷酸盐缓冲溶液(phosphate buffer saline,PBS)洗2次,调整细胞浓度为2×10个5/ml,取500μl细胞悬液,加入PE标记的HLA-ABC抗体20μl,避光孵育20 min。冷PBS洗细胞1次,将细胞重悬于0.5 ml PBS中,流式细胞仪检测肿瘤细胞表面HLA-ABC蛋白的表达。使用WinMDI软件进行数据分析。
1.2.5 qRT-PCR 取对数期生长的DU145、LNCaP细胞,不同浓度(0、10和20 nmol/L)万珂处理2种前列腺癌细胞株24 h,分别收集各组DU145、LNCaP细胞。采用Trizol法抽提细胞总RNA,紫外分光光度计测定RNA纯度及含量,选用OD260/OD280比值为1.8~2.0的RNA标本用于下一步反应。按照逆转录试剂盒说明书进行操作,合成cDNA后进行PCR反应。分别向PCR管中加入SYBR Premix Ex TaqTMⅡ 12.5μl,cDNA 模 板 2μl,ddH2O 8.5μl,以及正反向引物各 lμl。HLA-C 正向引物 :5'-TCCTGGTTGTCCTAGCTGTC-3',反向引物 :5'-CAGGC-TTTACAAGTGATGAG3-';甘油醛-3-磷酸脱 氢 酶(glyceraldehyde-3-phosphate dehydrogenase,GADPH)正向引物:5'-GAAGGTGAAGGTCGGAGTC-3',反向引物:5'-GAAG-ATGGTGATGGGATTTC3-'。引物均由大连宝生生物工程公司有限公司合成。反应条件:95℃预变性30 s,95℃变性5 s,60℃退火30 s,共45个循环,60℃收集荧光5 s,99℃、1 min,50℃、1 min,以0.5℃/s的速度升温到99℃,对荧光进行连续监测做熔解曲线分析。采用qRT-PCR仪进行检测,以HLA-C与GADPH相对浓度比值反映目的基因mRNA的表达。用双标准曲线法对目的基因进行相对定量测定。实验结果重复3次。
1.3 统计学方法
数据分析采用SPSS 11.5统计软件,计量资料以均数±标准差(±s)表示,两组比较用t检验,多组比较用单因素方差分析,进一步两两比较用Tukey-HSD检验,P<0.05为差异有统计学意义。
2 结果
2.1 万珂提高前列腺癌细胞对NK细胞杀伤的敏感性
2.1.1 DU145细胞 未处理组、万珂组、NK细胞组及其共同预处理组的DU145细胞凋亡率分别为(21.698±2.658)%、(34.945±2.245)%、(23.972±2.952)%和(41.831±2.965)%,经单因素方差分析,差异有统计学意义(F=36.240,P=0.000)。进一步两两比较,万珂、NK细胞共同预处理的DU145细胞凋亡率较仅万珂或NK细胞预处理高(P<0.05)。见图1。
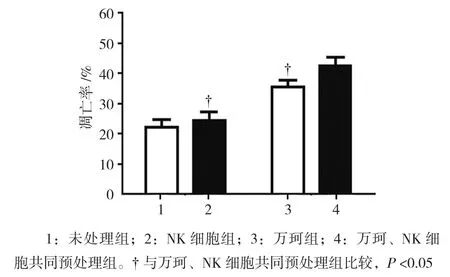
图1 万珂致敏NK细胞对DU145细胞凋亡的影响 (±s)
2.1.2 LNCaP细胞 未处理组、万珂组、NK细胞组及其共同预处理组的LNCaP细胞凋亡率分别为(23.663±2.204)%、(25.992±1.743)%、(29.729±2.581)%和(30.310±1.638)%,经单因素方差分析,差异有统计学意义(F=6.922,P=0.013)。进一步两两比较,万珂、NK细胞共同预处理组的LNCaP细胞凋亡率与万珂组、NK细胞组比较,差异无统计学意义(P>0.05)。处理过的DU145细胞凋亡率比LNCaP细胞更高。提示NK细胞能有效提高激素非依赖性前列腺癌细胞凋亡率,且NK细胞与万珂的联合应用较单独应用凋亡率更高。见图2。

图2 万珂致敏NK细胞对LNCaP细胞凋亡的影响 (±s)
2.2 万珂对DU145细胞HLA-I类分子mRNA和蛋白表达的影响
2.2.1 HLA-C mRNA 0、10和20 nmol/L万珂处理后DU145细胞HLA-C mRNA相对表达量分别为(1.017±0.107)、(0.892±0.152) 和(0.753±0.116),经单因素方差分析,差异有统计学意义(F=6.256,P=0.034)。进一步两两比较,10 nmol/L万珂处理后DU145细胞HLA-C mRNA表达水平与0和20 nmol/L万珂组比较,差异无统计学意义(P>0.05);20 nmol/L万珂处理后DU145细胞HLA-C mRNA表达水平较0 nmol/L万珂组下调(P<0.05)。见图3。
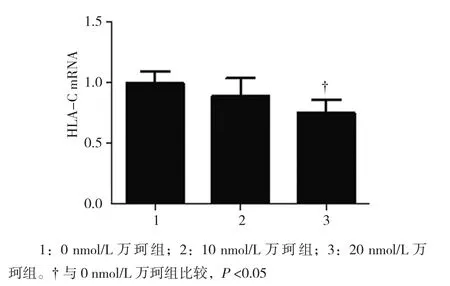
图3 不同浓度万珂对DU145细胞HLA-C mRNA表达水平的影响 (±s)
2.2.2 HLA-ABC蛋白 0和20 nmol/L万珂处理后DU145细胞HLA-C-ABC蛋白相对表达量分别为(65.842±0.178)和(38.220±0.389),经t检验,差异有统计学意义(t=12531.758,P=0.000),20 nmol/L万珂处理后DU145细胞HLA-ABC蛋白表达水平较0 nmol/L万珂组下调。见图4。

图4 不同浓度万珂对DU145细胞HLA-ABC蛋白表达水平的影响
2.3 万珂对LNCap细胞HLA-I类分子mRNA和蛋白表达的影响
2.3.1 HLA-C mRNA 0、10和20 nmol/L万珂处理后LNCap细胞HLA-C mRNA相对表达量分别为(1.027±0.101)、(0.930±0.140) 和(0.861±0.130),经单因素方差分析,差异无统计学意义(F=1.345,P=0.329)。见图 5。
2.3.2 HLA-ABC蛋白 0、10和20 nmol/L万珂处理后LNCap细胞HLA-ABC蛋白相对表达量分别为(2.831±0.428)和(2.110±0.551),经t检验,差异无统计学意义(t=3.221,P=0.147)。见图6。
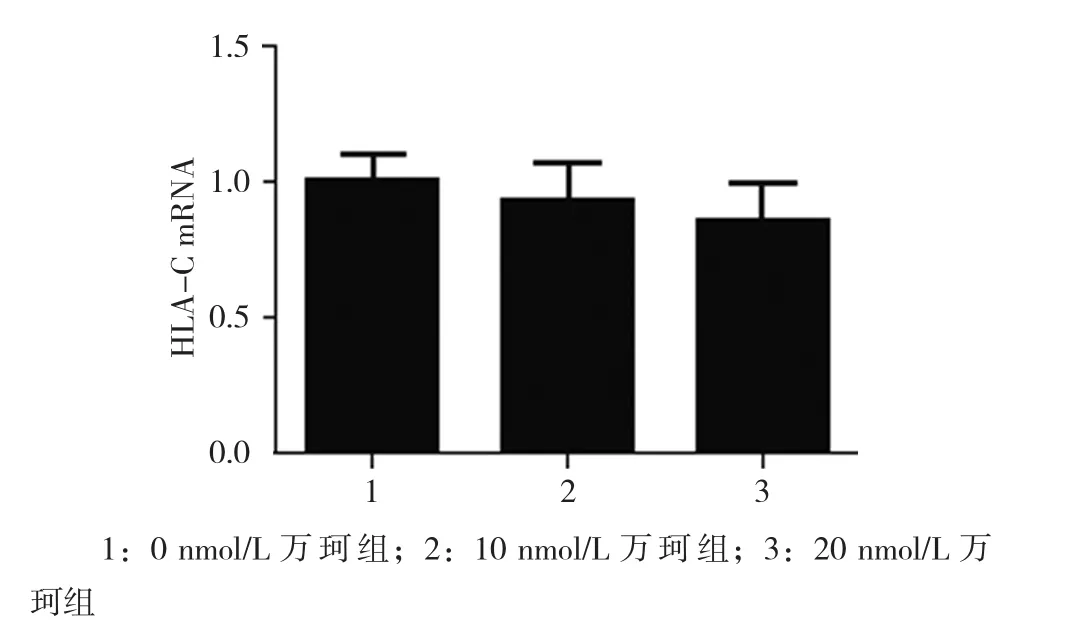
图5 不同浓度万珂对LNCaP细胞HLA-C mRNA表达的影响 (±s)
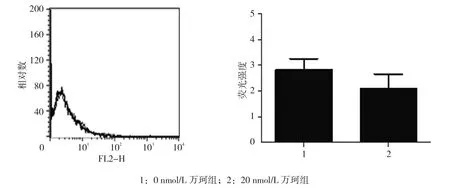
图6 不同浓度万珂对LNCaP细胞HLA-ABC蛋白表达的影响
3 讨论
近年来,前列腺癌的发病率越来越高。激素依赖性的前列腺癌患者可以用去势方法治疗,而激素非依赖性的前列腺癌对激素抑制治疗和化疗无效,患者生存率非常低,所以急切期待着新的治疗模式产生。
蛋白酶体抑制作用引发的抗肿瘤凋亡活性的精确机制非常难分析,似乎是多因素的。26S蛋白酶体能对大量的细胞通路进行调节。有研究表明,蛋白酶体抑制参与活化核转录因子κB[6-7],降低死亡区域蛋白样白介素-1β转换酶抑制蛋白的表达,增加DR5的表达,通过细胞内的凋亡通路活化Caspase-3[8-9],累积前凋亡蛋白Bik等大范围的细胞效应。而NK细胞也有TRAIL和Fas配体,其可以在靶细胞中触发凋亡。
曾经有人假设成熟的NK细胞表达≥1种自体HLA-I类抑制性受体,特别是HLA-C和Bw4分子[10]。当抑制信号占主导时,HLA-I类抑制性受体能够保护健康细胞不被NK细胞破坏[11]。而在相对情况下,NK细胞能积极地溶解肿瘤细胞而不显示这些抑制性受体。自体HLA分子使NK细胞失活是恶性肿瘤细胞逃逸宿主NK细胞介导的免疫的一个潜在机制[12]。
在正常的环境中,前列腺癌细胞表达自体HLA分子,使自体的NK细胞失活,这可能是肿瘤免疫逃逸机制的一个重要环节。这也有助于解释在实体肿瘤的治疗中获得性输注自体NK细胞相对缺乏活性[13]。本研究结果表明,万珂处理DU145细胞会导致细胞表面表达的HLA-ABC蛋白和HLA-C mRNA降低。这证明万珂能够克服前列腺癌细胞对NK细胞的抑制,使获得性输注NK细胞的治疗更有效,从而使其应用更广。可是这些改变却没有在LNCaP细胞上出现。还有研究表明,残留的宿主淋巴细胞的有效排斥反应限制了NK细胞输注的持久性,这也减少了治疗的有效性。而万珂能够通过特异性清除有自体反应性的T淋巴细胞,从而潜在促进NK细胞的持久性[14]。这些效应证明,万珂增强NK细胞的抗肿瘤活性。
综上所述,万珂抑制肿瘤细胞上HLA-ABC的表达,从而促进NK细胞对靶细胞的识别和杀伤。而这种效应在激素非依赖性前列腺癌细胞上表现更明显,证明万珂能成为一种有效的药物,增强肿瘤免疫治疗的效果,尤其为激素非依赖性前列腺癌的生物治疗提供新希望。
