2D-STI评价肺动脉压正常SSc患者右室收缩功能的临床研究
2018-10-18熊云涛曹礼庭
熊云涛,曹礼庭
(1.成都大学附属医院 超声科,四川 成都 610081;2.川北医学院附属医院 超声诊断科,四川 南充 637000)
系统性硬化病(systemic sclerosis, SSc)是一种免疫性疾病,表现为局限性或弥漫性皮肤增厚,并可影响心、肺及消化道等内脏器官。心脏损害是最重要的死亡原因之一[1]。SSc患者可发生右室收缩功能障碍,早期发现,有利于预后判断和治疗。二维斑点追踪成像技术(two-dimensional speckle tracking imaging, 2D-STI)无角度依赖性,可定量评价心肌功能。已有学者研究发现在评价右室收缩功能障碍时,2D-STE和常规超声心动图指标相关[2]。本文研究应用2D-STI评价未合并肺动脉高压(pulmonary arterial hypertension, PAH)的SSc患者右室收缩功能,并探讨SSc患者右室心肌功能减低的影响因素。
1 资料与方法
1.1 一般资料
选取2014年10月-2017年3月于成都大学附属医院及川北医学院附属医院收治的SSc患者30例作为SSc组。按照美国风湿病学会提出的SSc诊断标准,患者病程1个月~8.4年,1例患者合并系统性红斑狼疮,1例患者合并皮肌炎,均未合并PAH[3]。SSc组患者分为局限皮肤型(limited cutaneous SSc, lcSSc)组和弥漫皮肤型(diffuse cutaneous SSc, dcSSc)组,其中lcSSc组患者16例,dcSSc组患者14例。排除标准:患有冠状动脉粥样硬化性心脏病、心瓣膜病、心肌病、先天性心脏病、心律失常、高血压、慢性肺疾病及右室图像质量不好等。另选取同期来院体检的健康群众22例作为对照组,经常规超声心动图检查未见明显异常。本研究经川北医学院附属医院及成都大学附属医院伦理委员会审核通过。
1.2 仪器与方法
采用美国GE公司 Vivid E9超声诊断仪,配备频率为1.7~3.3 MHz的M5S探头。受检者采取左侧卧位,检查时同步记录心电图。应用常规超声心动图及脉冲组织多普勒(tissue doppler imaging, TDI)检查,分别测量计算左房收缩末期内径(left atrial endsystolic diameter, LAESD)、左室舒张末期内径(left ventricular end-diastolic diameter, LVEDD)、右房收缩末期横径(right atrial end-systolic diameter, RAESD)、右室舒张末期横径(right ventricular end-diastolic diameter,RVEDD)、右室流出道内径(right ventricle outflow tract,RVOT)、左室射血分数(left ventricular ejection fraction,LVEF)、右室面积变化分数(right ventricle fractional area change, RV-FAC)、三尖瓣环收缩期位移(tricuspid annulus systolicdisplacement, TAPSE)及心肌收缩期运动速度(myocardial systolic velocity, Sm)。肺动脉收缩压(pulmonary arterial systolic pressure, PASP)用三尖瓣反流压差法计算,在没有RVOT梗阻的情况下,PASP=右房压+三尖瓣反流压差。右房压根据下腔静脉塌陷指数来估测,三尖瓣反流压差根据简化Bernoulli公式计算得出,以静息状态下PASP≥35 mmHg(1 mmHg=0.133 kPa)为PAH诊断标准。
采集右室心尖四腔观连续3个周期以上的二维动态图像,帧频为40~70帧/s,在脱机状态下使用EchoPac-120软件进行分析,人工勾画右室收缩末期心内膜边界,并调节心内膜边缘曲线及感兴趣区宽度,得到右室侧壁各节段应变、应变率曲线(见附图)。记录右室侧壁心尖段、中间段及基底段收缩期纵向峰值应变(longitudinalpeak systolic strain, LS)及应变率(longitudinal peak systolic strain rate, LSRs),取3个节段应变参数的平均值分别得到右室侧壁整体纵向收缩期峰值应变(global longitudinal peak systolic strain,GLS)及应变率(global longitudinal peak systolic strain rate, GLSRs)。
1.3 统计学方法
数据分析采用SPSS 24.0统计学软件,计量资料以均数±标准差(±s)表示,比较用t检验,计数资料以构成比表示,比较用χ2检验,P<0.05为差异有统计学意义。
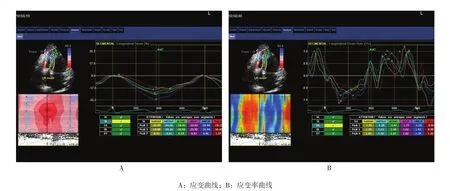
附图 斑点追踪技术测量右室侧壁应变及应变率曲线图
2 结果
2.1 SSc组和对照组患者基本资料及常规超声心动图参数比较
SSc组和对照组患者年龄、性别、BMI、心率、LAESD、LVEDD、LVEF、RAESD、RVEDD、RVOT、RV-FAC及Sm比较,差异无统计学意义(P>0.05)SSc组和对照组患者PASP、TASPE比较,差异有统计学意义(P<0.05),SSc组PASP高于对照组,TASPE低于对照组。见表1。
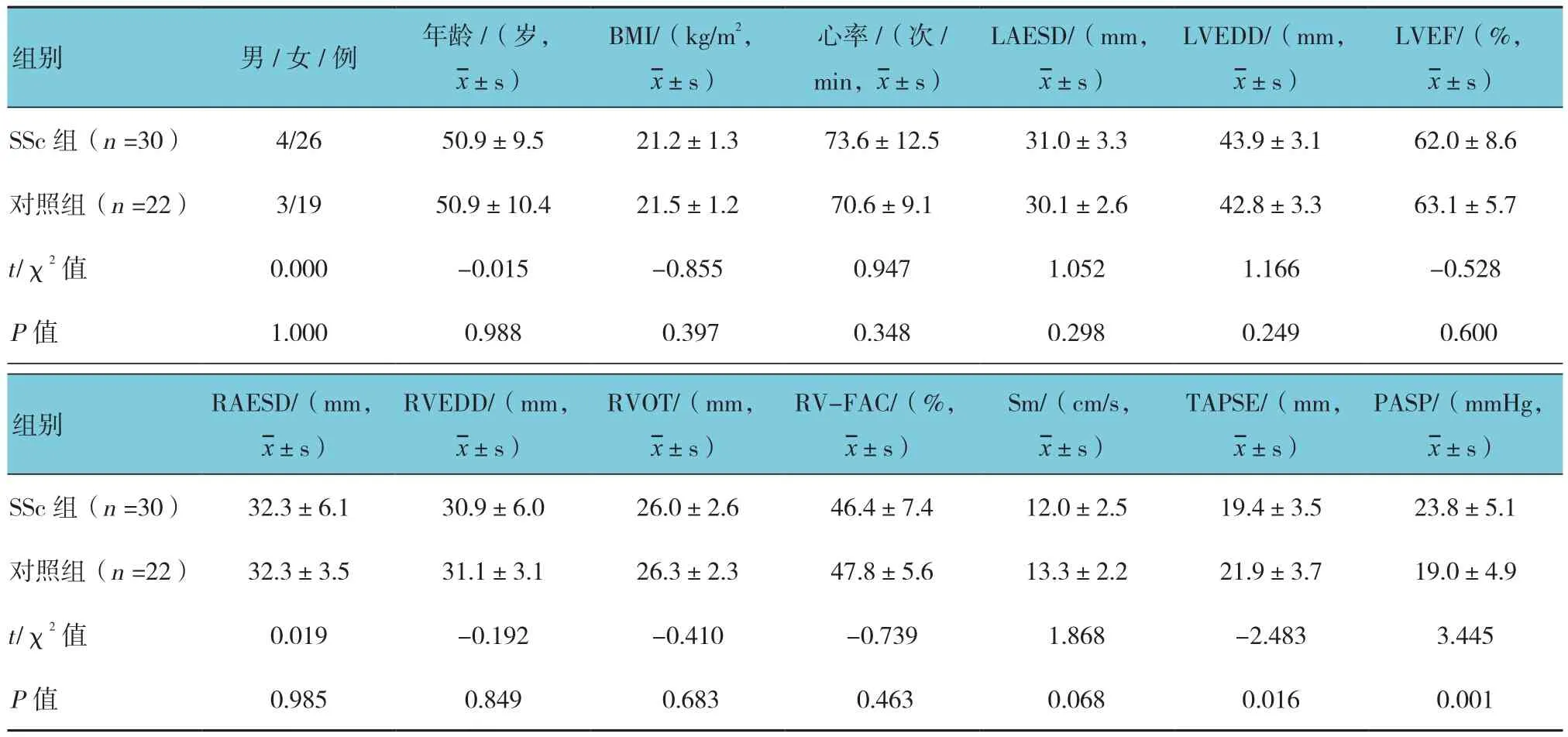
表1 两组患者基本资料及常规超声心动图参数比较
2.2 SSc组和对照组患者心肌功能比较
两组患者GLS、GLSRs、基底段LS和LSRs、中间段LS比较,差异有统计学意义(P<0.05),SSc组GLS、GLSRs、基底段LS及LSRs、中间段LS较对照组高;SSc组与对照组在心尖段LS及LSRs、中间段LSRs比较,差异无统计学意义(P>0.05)。见表2。
2.3 dcSSc组与lcSSc组患者心肌功能比较
dcSSc组与lcSSc组患者GLS、基底段LS及LSRs、中间段LS比较,差异有统计学意义(P<0.05),dcSSc组GLS、基底段LS及LSRs、中间段LS较lcSSc组高。dcSSc组与lcSSc组患者GLSRs、心尖段LS及LSRs、中间段LSRs比较,差异无统计学意义(P>0.05)。见表3。
表2 SSc组和对照组患者心肌功能比较 (±s)
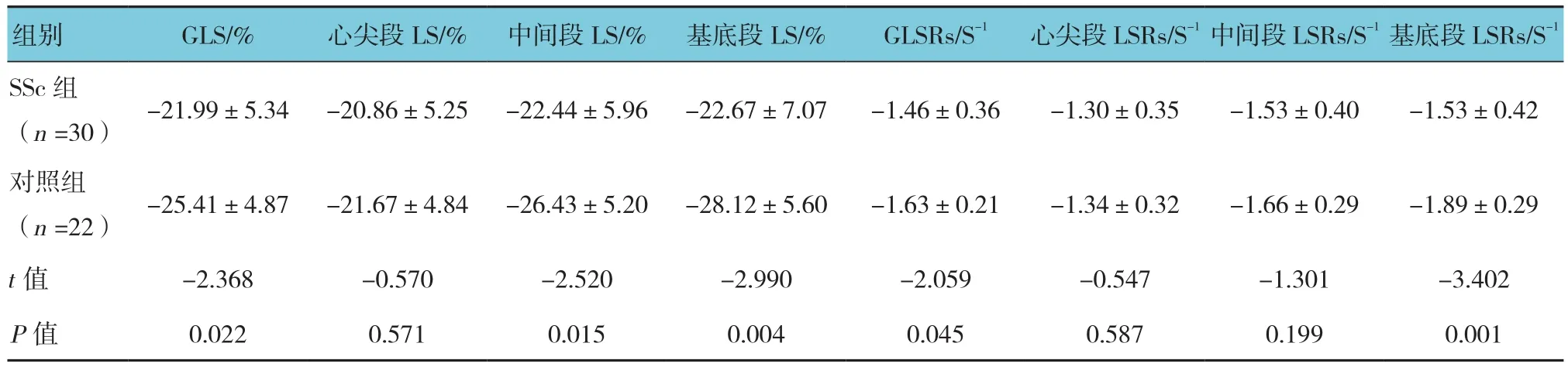
表2 SSc组和对照组患者心肌功能比较 (±s)
组别 GLS/% 心尖段LS/% 中间段LS/% 基底段LS/% GLSRs/S-1 心尖段LSRs/S-1中间段LSRs/S-1基底段LSRs/S-1 SSc组(n =30) -21.99±5.34 -20.86±5.25 -22.44±5.96 -22.67±7.07 -1.46±0.36 -1.30±0.35 -1.53±0.40 -1.53±0.42对照组(n =22) -25.41±4.87 -21.67±4.84 -26.43±5.20 -28.12±5.60 -1.63±0.21 -1.34±0.32 -1.66±0.29 -1.89±0.29 t值 -2.368 -0.570 -2.520 -2.990 -2.059 -0.547 -1.301 -3.402 P值 0.022 0.571 0.015 0.004 0.045 0.587 0.199 0.001
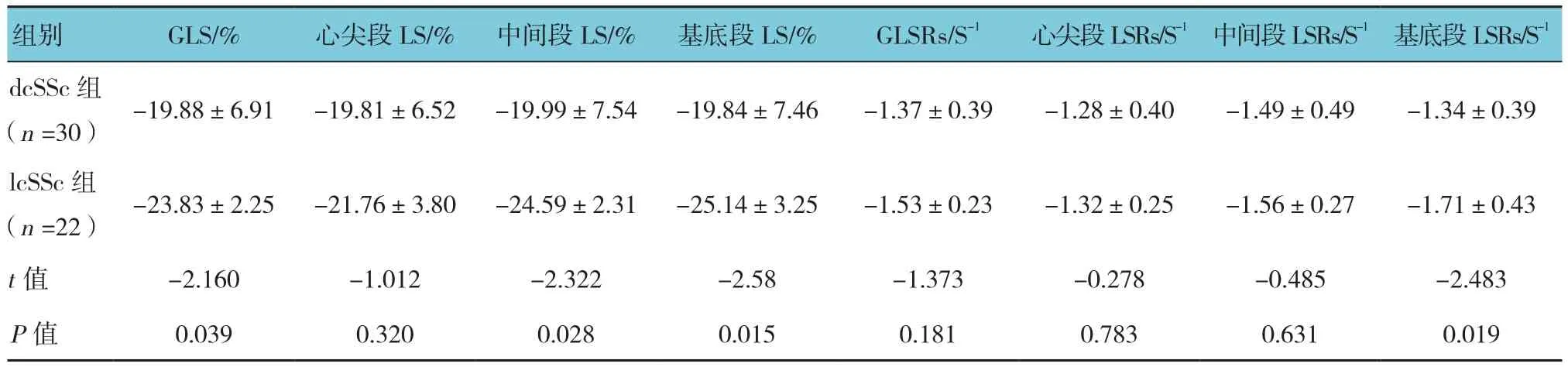
表3 dcSSc组和lcSSc组患者心肌功能比较
3 讨论
SSc是一种全身性自身免疫性疾病。SSc患者右室损伤有两种形式:一种是对心脏的直接损害,另一种则是继发于SSc损害肺或肾脏之后的心脏病变。右室壁较薄,结构复杂,对其功能进行评价有一定困难。
RV-FAC、Sm及TAPSE等是美国超声心动图学会推荐的右室收缩功能指标[4]。RV-FAC通过二维超声对右室腔面积变化的评估反映右室收缩功能,但本研究在SSc组与对照组比较无差异,提示SSc患者未合并PAH时,心室腔的大小形态还没有发生明显变化。TDI技术通过测量Sm评价右室整体收缩功能,较常规超声心动图指标具有更高的敏感性和特异性[5]。但是,TDI有角度依赖性,测量值很难准确反映Sm,本研究显示,SSc组与对照组比较无差异,与文献研究结果一致[6]。TASPE减低是早期发现SSc患者右室收缩功能障碍较有利的指标[7]。本研究结果发现,尽管两组的常规超声参数差异不明显,但SSc患者TAPSE减低,提示未合并PAH的SSc患者右室收缩功能受损,与文献研究结果一致[8-10]。
2D-STI通过逐帧追踪二维灰阶图像中均匀分布于心肌内的回声斑点,软件自动计算出心肌应变及应变率等,无角度依赖性,可更准确、真实地反映心肌运动情况,定量评价心肌局部和整体运动。右室的心肌主要由纵行纤维构成,因此,2D-STI对右室收缩功能的研究主要为长轴方向上的心肌形变。
在未合并PAH的SSc患者研究中,DURMUSE等[8]研究发现右室侧壁GLS较对照组减低;SCHATTKE等[9]研究显示,右室侧壁中间段及基底段LS减低;任卫东等[10]研究显示,SSc患者右室侧壁心尖段、中间段以及基底段LS均减低。本研究结果同样发现,未合并PAH时,SSc患者常规超声心动图参数无明显变化,提示常规参数评价早期右室收缩功能不敏感,但SSc组右室侧壁GLS、GLSRs、基底段LS及LSRs、中间段LS均较正常对照组高,提示SSc患者在PAH形成之前右室纵向形变的幅度及速率已减低,右室整体及局部收缩功能受损。ARGULA等[11]通过对合并PAH的SSc患者和原发性PAH患者的对比研究发现,虽然两组右室后负荷无差异,但是前者的预后更差。DURMUSE等[8]研究发现,未合并PAH的SSc患者右室收缩功能与疾病持续时间呈负相关,与PASP不相关,提示后负荷增加不是早期SSc患者右室心肌受损的唯一原因,另一个重要的原因是心肌的直接损害。主要的病理机制是SSc患者心内膜下小冠状动脉内-中膜增厚、狭窄,心肌组织缺血性损伤、纤维化。此外,本研究发现,未合并PAH的SSc组患者PASP虽然在正常范围内,但是仍然比对照组患者高。CODULLO等[12]对SSc患者随访观察显示,运动后的PASP≥48 mmHg或者运动前后的PASP差>18 mmHg的患者,其科钦风险预测评分更高。本研究采用三尖瓣反流压差法估测SSc患者静息状态下肺动脉收缩压,并没有排除通过轻微运动就可能诱发的PAH,因此,SSc患者右室心肌受损另一个可能的原因是轻微或间歇的PAH导致右室后负荷增加[9]。
进一步研究显示,dcSSc组右室侧壁GLS、基底段LS及LSRs、中间段LS较lcSSc组高,提示DcSSc患者右室收缩功能受损更严重,与ABDA等研究结果类似[13]。
本研究局限性在于样本量小且2D-STI技术是基于二维图像分析,不能反映心脏实时的三维运动,有待进一步用三维STI研究。
综上所述,本研究结果显示,未发生PAH的SSc患者,右室心肌收缩功能已受损,其中dcSSc患者较lcSSc患者损害更严重,2D-TDI可早期评价右室整体和局部收缩功能,有利于临床早期干预。
