同型半胱氨酸对FABP4启动子活性的影响*
2018-10-18熊建团李旭生杨安宁杨松昊邓梅王磊高源李南杨晓玲贾月霞姜怡邓
熊建团 ,李旭生 ,杨安宁 ,杨松昊 ,邓梅 ,王磊 ,高源 ,李南 ,杨晓玲 ,贾月霞,姜怡邓
(1.宁夏医科大学 药学院,宁夏 银川 750004;2.宁夏医科大学总医院 骨科,宁夏 银川750004;3.宁夏医科大学 基础医学院,宁夏 银川 750004)
脂肪型脂肪酸结合蛋白4(fatty acid binding protein 4, FABP4)属于脂肪酸结合蛋白大家族的重要成员,主要在脂肪组织中高度表达,在巨噬细胞中也有大量表达[1]。近年来研究表明,FABP4在肥胖和动脉粥样硬化的发生中发挥重要作用[2]。FABP4表达缺失可通过降低炎症因子在巨噬细胞中的表达,保护高血脂老鼠避免动脉粥样硬化的发生[3]。目前国内关于FABP4基因启动子的研究较少。同型半胱氨酸(Homocysteine, Hcy)是心脑血管疾病的独立危险因子,通过多种机制影响基因表达,参与疾病发生、发展[4]。本研究以人源FABP4基因为研究对象,成功克隆FABP4基因启动子,分析确定影响FABP4基因启动子活性的核心区域,为进一步开展功能研究提供实验基础。
1 材料与方法
1.1 主要设备和试剂
L-Hcy和佛波酯(phorbol 12-myristate 13-acetate,PMA)(德国Sigma-Aldric公司),二氧化碳CO2培养箱HF90(上海力新仪器有限公司),胎牛血清(杭州四季青生物工程材料有限公司),青霉素、链霉素、PBS缓冲液、DMEM和RPMI 1640培养基购自美国HycLone公司,相差显微镜(日本尼康公司),荧光素酶检测仪器(美国普洛麦格公司),PrimeSTAR HS DNA polymera(大连宝生生物工程公司有限公司),限制性内切酶Xhol、Hind Ⅲ、T4 DNA快速连接酶、DNA Marker及转染试剂LipofectamineTM3000购自美国Invitrogen公司,DNA提取试剂盒、凝胶回收纯化试剂盒、DNA纯化试剂盒及双荧光素酶检测试剂盒购自美国普洛麦格公司,质粒纯化试剂盒(北京天根生化科技有限公司),pGL3-Basic质粒、pRL-TK质粒由本实验室保存,HEK-293A细胞(四川大学华西医学院),实验中所用引物及测序由上海英俊生物有限公司完成。
1.2 启动子序列分析
根据GenBank中人FABP4基因的序列(GenBank:CR456903.1),查找启动子区2 000 bp区域,分别根据http://fruitfly.org:9005/seq_tools/promoter.html、http://www.urogene.org/methprimer/index1.html网站预测启动子结合序列和甲基化岛分布情况的结果。
1.3 FABP4基因启动子报告基因载体的构建
将人FABP4启动子初步分为4个片段,分别为 -500/-1、-1000/-1、-2000/-1、-2000/-1501, 利用Primer 5设计合成4对特异引物获得相应片段,并在5’端和3’端分别添加Xhol和Hind Ⅲ酶切位点,引物序列见附表。将目的片段从亚克隆载体上切割并回收,回收目的片段并与pGL3-Basic载体连接,利用双酶切方法筛选并测序鉴定。

附表 FABP4基因启动子片段引物设计
1.4 细胞培养
HEK-293A工具细胞使用DMEM培养基,THP-1单核细胞使用RPMI 1640培养液,均含12%胎牛血清。于37℃、5% CO2环境中静置培养。以500 nmol/L PMA培养液孵育THP-1单核细胞48 h,单核细胞即分化为巨噬细胞,然后给予不用浓度(0、50、100、200和500μmol/L)Hcy干预24 h后进行后续实验。
1.5 FABP4基因启动子活性分析
将细胞接种于6孔板中,待细胞生长至80%汇合时,采用LipofectamineTM3000转染细胞。转染DNA总量为2μg/孔,pGL3-FABP4不同大小片段质粒与海肾荧光素酶报告基因载体(pRL2TK)的比值为100∶1。将海肾荧光素酶报告基因载体作为内源参照,以消除由于转染效率及细胞活性等因素带来的差异。转染48 h后,按照Promega公司荧光素酶报告基因检测试剂盒说明书,进行荧光素酶活性检测。实验重复6次,每次3个平行实验,启动子相对活性以目的基因荧光与海肾荧光的比值(Fluc/Rluc)表示。
1.6 统计学方法
数据分析采用GraphPad Software 6.0统计软件,计量资料以均数±标准差(±s)表示,多组比较用方差分析,两两比较用SNK–q检验,P<0.05为差异有统计学意义。
2 结果
2.1 FABP4基因核心启动子预测分析
通过BDGP生物信息学网站预测,发现在FABP4启动子区2 000 bp的范围内含有2个可能的核心启动子位点,并且得分均>0.95(满分1.00分)。见图1。

图1 FABP4基因核心启动子预测分析
2.2 FABP4基因启动子区CpG岛生物学预测
通过Methprimer网站预测,笔者观察到在FABP4启动子区2 000 bp范围内没有CpG岛的存在,但是有一段CpG二核苷酸位点相对集中的区域,并且可以在这个相对集中的区域设计甲基化与非甲基化引物,观察FABP4基因启动子甲基化程度的改变。见图2。
2.3 FABP4基因启动子转录起始位点的预测
用生物信息学方法进行分析比对FABP4基因启动子2 000 bp序列,发现在位于转录起始的-67碱基位置和转录起始的-1548碱基位置含有CAAT盒,而位于转录起始的-808碱基位置含有TATA盒。见图3。
2.4 FABP4基因启动子区不同截取片段PCR产物
通过普通PCR扩增得到与预测截取片段大小相等且规整单一的PCR产物。其中,-2000/-1501片段组、-500/-1片段组、-1000/-1片段组、-2000/-1片段组长度分别为500、500、1 000和2 000 bp。见图4。
2.5 FABP4基因启动子不同截取片段pGL3载体双酶切结果
将构建好的FABP4基因启动子不同截取片段pGL3载体经Hind和Xhol双酶切后用电泳法分离,均被切出大小约4 000 bp的大片段条带和与之相对应的与PCR产物相大小一致的小片段条带。其中,-2000/-1501片段组、-500/-1片段组、-1000/-1片段组、-2000/-1片段组长度分别为500、500、1 000和2 000 bp。大片段的条带与pGl3空载体Hind、Xhol双酶切后的产物大小一致。见图5。
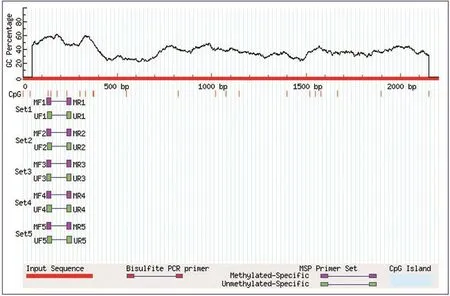
图2 FABP4基因启动子区CpG位点分析

图3 FABP4基因启动子区转录起始位点预测

图4 各FABP4基因启动子片段扩增

图5 各FABP4基因启动子片段酶切鉴定
2.6 FABP4基因启动子不同截取片段的荧光素酶活性
以HEK-293A细胞为工具细胞,分别转入不同长度的FABP4启动子截取片段,检测相应片段的萤光素酶活性,-2000/-1501片段组、-2000/-1片段组、-1000/-1片段组、-500/-1片段组细胞中相对荧光素酶活性分别为(0.2103±0.02741)、(0.3203±0.02978)、(0.1542±0.05314)和(0.2595±0.02686),经单因素方差分析,差异有统计学意义(F=16.900,P=0.000),提示不同长度FABP4启动子截取片段可能具有不同的启动活性。进一步两两比较经SNK–q检验,-500/-1片段组、-2000/-1片段组、-2000/-1501片段组启动活性高于pGL3对照组(P=0.002、0.001和0.011),其中-2000/-1片段组转录活性最强。见图6。
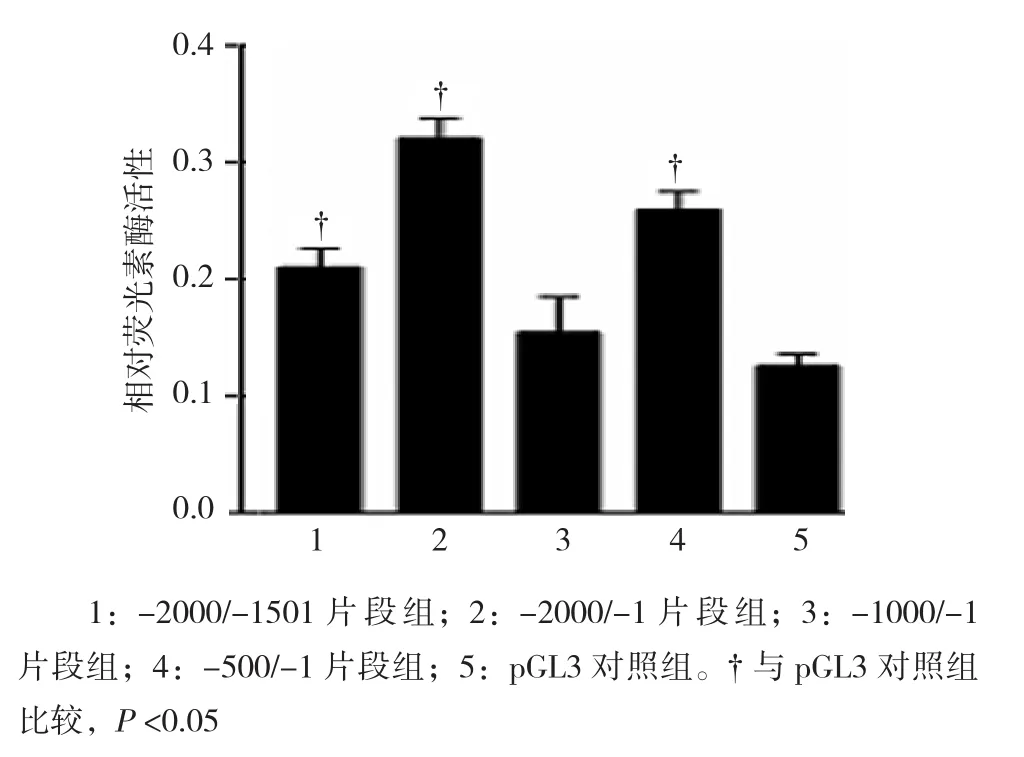
图6 各FABP4基因启动子片段荧光素酶活性检测
2.7 Hcy和5-氮杂胞苷对FABP4基因启动子的作用
将FABP4基因核心启动子-2000/-1片段转染巨噬细胞,并用不同浓度Hcy和5-氮杂胞苷(5-azacytidine, AZC) 干 预 后,0、50、100、200和500μmol/L Hcy组,以及100μmol/L Hcy+AZC组细胞中相对荧光素酶活性分别为(1.260±0.5585)、(1.430±0.1383)、(4.386±0.1711)、(4.029±0.1673)、(1.582±0.1952)和(5.265±0.3834),经单因素方差分析,差异有统计学意义(F=98.000,P=0.000)。进一步两两比较经SNK–q检验,50和500μmol/L Hcy组与0μmol/L Hcy组比较,差异无统计学意义(P=0.636和 0.400);100和 200μmol/L Hcy组高于0μmol/L Hcy组(均P=0.001);100μmol/L Hcy组用DNA甲基转移酶抑制剂AZC作用后,FABP4基因启动活性升高(P=0.002),提示Hcy可以增加巨噬细胞内FABP4核心启动子片段的活性,而DNA甲基转移酶抑制剂AZC可以进一步促进Hcy对FABP4启动子活性的影响。见图7。
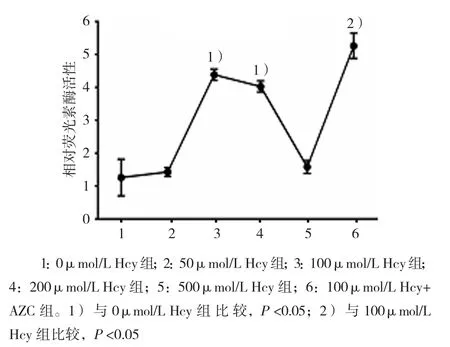
图7 不同浓度Hcy对FABP4基因核心启动子活性的影响
3 讨论
本研究发现人FABP4基因2 000 bp长度的启动子区含有3个转录起始结合位点,即由2个启动子区负责转录调控,分别位于-2000/-1051、-500/-1和-1000/-500区域,分别为-2000/-1051区域CAAT盒(序列为CCAAT)、位于-500/-1区域CAAT盒(序列为CCAAT)和-1000/-500区域的TATA盒(序列为TATAAAA)。一般真核生物中蛋白质编码基因的核心启动子元件分4类:①传统的TATA盒;②上游核心启动子元件;③下游启动子元件;④起始子。起始子只起转录起始并无转录调节作用,而上游启动子元件包括CAAT盒和GC盒等,能通过TFⅡ-D复合物的识别和结合来调节转录起始的频率,从而提高转录效率,但并不是所有启动子都含有这些转录基本元件[5]。
CAAT盒是转录因子CBF在DNA序列上的识别结合位点,其序列格式为CCAAT。CAAT盒位于所转录的真核生物基因的近端启动子,与其他启动子元件相互调节而发挥作用,通过控制转录起始的频率从而控制启动子的转录活性,是真核生物基因常有的基本转录区[6]。而TATA盒是另一个重要基础元件,是转录因子TBP识别的DNA序列,其序列格式通常为TATAWAW(W代表A或T)。通常认为,含有TATA盒的启动子可能参与组织特异性基因的转录调控,而TATA盒本身并无转录活性,如果表现出转录活性需要其他结构基因共同调控[7]。在FABP基因2 000 bp启动子区内,CAAT盒位于转录起始的-67碱基位置和转录起始的-1548碱基位置,对应存在的片段为-500/-1片段和-1501/-2000即表现出来转录活性,可以推测FABP4基因是由CAAT盒组成的核心启动子。而TATA盒则位于转录起始的-808碱基位置,存在于-1000/-1片段内而无转录活性,则TATA盒在FABP4转录中可能未起到转录活性作用。
基因启动子和丰富的CpG序列(GC位点通常未甲基化)中的甲基化修饰被认为与基因表达调控高度相关,是体内重要的转录调控方式[8]。一般来说,CpG岛通常是基因中GC含量为60%、CpG出现率达到0.65、长度为500 bp的序列,就算这些区域没有CpG岛也有丰富的CpG位点,可被甲基化修饰调控[9]。在FABP4基因启动子区里,GC含量相对较少,约为38%,在-2000/-1501片段中GC相对集中,含量也仅有47%,因此,FABP4基因启动子不含CpG岛,其调控可能受到散在分布的GC灵活调控。FABP4基因启动子可能是组织特异性表达的基因启动子,CpG位点参与基因表达调控的因素之一。-2000/-1501片段的转录活性高于对照组。由此证明,FABP4基因本身CpG位点相对集中区域也具有启动基因表达的能力。-2000/-1片段转录活性高于-500/-1片段,可以推测CpG对FABP4基因启动子转录调控起一定促进作用,参与FABP4基因表达调控。本研究还发现,FABP4基因启动子-1000/-500片段含有2个AML-1a结合区域(序列分别ACACAC和ACATAA)。AML-1a是一种具有与DNA结合的空间结构域,其缺乏相应转录激活结构域的转录调节蛋白,导致靶基因不能正常转录的机制可能是:一方面,AML-1a与DNA结合的结构域能够和AMLlb/lc竞争结合靶基因DNA结合位点,从而抑制转录;另一方面,AML-1a通过改变基因CpG位点中胞嘧啶(C)甲基化修饰生成5-甲基胞嘧啶(5mC)调控基因转录,该过程在转录调控中最早发生,随后通过激活或抑制转录因子与DNA结合而调节基因转录,这一调控主要集中在GC位点密集区[10]。实验中FABP4基因启动子-1000/-1片段的转录活性低于-500/-1片段,但荧光素酶活性与对照组比较无变化。由此推测FABP4基因-1000/-1片段启动转录过程中可能有负相关调节转录因子参与,或者有相关沉默子起关键作用。AML-1a是否是负责FABP4基因负调控主要的因子及相关转录沉默子的有待进一步研究。同时,包含丰富CpG-2000/-1501片段的-2000/-1片段活性与-1000/-1片段相比又进一步增强,推测-2000/-1501片段对FABP4基因启动子转录活性有非常重要的作用。此外,对照载体pRL-TK所携带的启动子是HSV1-tk基因自身启动子,属中等强度启动子[11]。实验中笔者发现FABP4基因启动子的启动活性均<40%TK启动活性,由此推测FABP4基因启动子启动基因表达能力较弱。使用不同浓度Hcy干预细胞后,100μmol/L Hcy组启动活性最强。Hcy在体内主要通过2种方式进行代谢:当蛋氨酸过量时,同型半胱氨酸通过转硫化通路代谢,生成胱硫醚(维生素B6为辅助因子),继而转变为半胱氨酸;当蛋氨酸含量较低时,Hcy主要通过蛋氨酸循环途径进行代谢[12]。SAM协助调解的Hcy被再甲基化形成蛋氨酸需要甲基四氢叶酸和维生素B12作为辅助因子,而自然界真核细胞内甲基化修饰反应唯一甲基来源只有SAM[13]。由此推断,当Hcy浓度过高时,迅速消耗培养基中的叶酸和维生素B12,SAM产生减少,FABP4启动子CpG转甲基减少,DNA发生去甲基化,使转录增强。给予叶酸和维生素B12干预后,启动子活性约降低10%,说明补充一定量的叶酸和维生素B12后,SAM产生进一步增多,转甲基能力增强,DNA发生甲基化位点增多,使转录减低。
综上所述,本实验证实FABP4基因启动子属于弱启动子,FABP4基因核心启动子由CAAT盒组成,部分CpG位点参与FABP4基因转录调控,AML-1a可能是调控FABP4基因转录的负性转录因子,而CpG位点与转录因子、沉默子的相互作用有待进一步研究。本研究为进一步研究FABP4基因的功能提供实验基础。
