Abraxne对Lewis肺癌小鼠Per2基因及SIRT1因子表达的影响
2018-10-18赵雪峰范娟杨玲麟傅少志陈琼英
赵雪峰,范娟,杨玲麟,傅少志,陈琼英
(1.西南医科大学附属医院 肿瘤科,四川 泸州 646099;2.四川省自贡市第三人民医院 放射科,四川 自贡 643020)
肺癌是发病率和死亡率均居首位的恶性肿瘤,大部分患者确诊时已为中、晚期,放化疗联合靶向药物治疗成为主要治疗手段[1-3]。Periods基因是近日节律调节系统的核心基因,沉默信息调节因子1(silent information regulator 1, SIRT1)是联系昼夜节律和能量代谢的能量传感器[4-5]。白蛋白结合型紫杉醇(albumin-bound paclitaxel, Abraxne)能加快紫杉醇进入肿瘤细胞,避免合成溶剂可能造成的毒副作用[6]。本研究探究Abraxne对Lewis肺癌小鼠生物钟基因Per2、SIRT1表达的影响,以期为临床治疗肺癌提供理论指导。
1 材料与方法
1.1 实验动物与试剂
1.1.1 实验动物 6~8周龄清洁级C57BL/6雌性小鼠60只,体重18~20 g,购自北京维通利华实验动物技术有限公司。
1.1.2 主要试剂及材料 小鼠Lewis肺癌细胞(lewis lung cancer cells, LLC)由本实验室保存。Abraxne注射用混悬液,规格:5 ml:100 mg/瓶,购自美国Celgene公司,紫素(溶剂型紫杉醇注射液)规格:5 ml:30 mg。购自北京协和药厂。Trizol RAN提取试剂(美国Invitrogen公司),RNA逆转录试剂盒、SYBR Green荧光定量检测试剂盒购自日本TaKaRa公司,组织蛋白提取试剂(南京凯基生物科技发展公司),兔抗鼠Per2一抗、兔抗鼠SIRT1一抗、碱性磷酸酶标记山羊抗兔IgG溶液购自美国Sigma公司。
1.2 动物模型的复制
取本实验室冻存的LLC细胞进行复苏,用含10%胎牛血清的RPMI 1640培养基,在37℃、5%二氧化碳CO2孵箱中常规培养、传代,传代期间采用MTT法检测细胞活力,确认细胞活力正常且传代3次后即可使用。取对数生长期细胞用0.25%胰酶消化,制成单细胞悬液,1 000 r/min离心5 min,倒掉培养基,用生理盐水将细胞浓度稀释至5×106个/L。在C57BL/6小鼠右腋部背侧皮下接种0.2 ml LLC细胞悬液(约1×106个细胞),接种后观察小鼠腋下变化,第2~5天皮下可触摸到肿瘤结节。若腋下肿瘤长势良好,在接种5 d后体积可>100 mm3,则提示Lewis肺癌小鼠模型复制成功。
1.3 实验分组
将接种后的45只Lewis肺癌小鼠随机分为模型组、紫素组和Abraxne组,用剪耳法标记,各15只,其余15只小鼠不做任何处理作为正常对照组。接种后第5天开始给药,连续治疗10 d。将瓶装Abraxne和紫素用生理盐水稀释为3 g/L,配好的溶液应在8 h内使用。Abraxne组从尾静脉缓慢注入Abraxne 30 mg/(kg·d);紫素组从尾静脉缓慢注入紫素 30 mg/(kg·d);模型组尾静脉注入等量生理盐水。
1.4 小鼠生存状态观察
接种后第5天起,各组小鼠每天同一时间称重,观察小鼠活动、饮食状态和死亡情况,并做好记录。
1.5 肿瘤体积动态变化
接种后第5天起,每天同一时间用游标卡尺(精确到0.1 mm)测定肿瘤最长径(a)和最短径(b),计算肿瘤体积(V):V=ab2/2。统计各组小鼠肿瘤平均体积,绘制肿瘤生长曲线。
1.6 实时荧光定量聚合酶链反应
接种后第15天将小鼠断头处死,完整剥离肿瘤结节组织于液氮中冻存。采用Trizol法提取各组小鼠肿瘤组织的总RNA,并通过逆转录试剂盒将其逆转录为cDNA,采用SYBR荧光定量检测试剂盒对肿瘤组织中的Per2和SIRT1 mRNA进行相对定量分析。引物序列由上海生工生物工程有限公司合成,采用美国ABI公司的7500系统进行实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)。反应条件:95℃预变性10 min,95℃变性15 s,72℃退火15 s,共40个循环。最终以β-actin作为内参,采用2-ΔΔCt法计算mRNA相对表达量。引物序列见表1。

表1 引物序列
1.7 Western blot检测
取每组小鼠肿瘤组织充分研磨,用组织蛋白提取试剂常规提取蛋白。每组取4μl蛋白样品,用BCA法进行蛋白定量,调节好蛋白浓度。将蛋白样品与等体积2×SDS缓冲液混合后加热变性,通过SDSPAGE电泳分离上清液,把分离的蛋白质转印到硝酸纤维素膜上。将膜洗涤后在5%牛血清蛋白溶液中室温封闭1 h,洗涤后将膜置于一抗稀释液(兔抗鼠Per2或SIRT1一抗溶液1∶100)中,4℃孵育过夜。次日早晨将膜快速清洗后,转移到二抗稀释液(碱磷酶标记山羊抗兔IgG溶液1∶1 000)中,室温孵育2 h,清洗后用新配制的显色液进行显色,待出现清晰的条带后终止反应,最后使用GIS-2020数码图像分析系统扫描并分析蛋白杂交条带。
1.8 统计学方法
数据分析采用SPSS 20.0统计软件,计量资料以均数±标准差(±s)表示,比较用单因素方差分析或重复测量设计的方差分析,两两比较用LSD-t法,P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠一般情况
模型组接种后第10天1只小鼠死亡。紫素组给药后第6天1只小鼠死亡,给药后第9天2只小鼠死亡。Abraxne组小鼠给药后无小鼠死亡。模型组、紫素组小鼠整体生长情况较差,活动、进食状态不佳,紫素组小鼠较模型组、Abraxne组明显消瘦;Abraxne组小鼠生长情况强于模型组、紫素组,状态最佳。
2.2 Abraxne对Lewis肺癌小鼠体重的影响
正常对照组、模型组、紫素组、Abraxne组小鼠在接种LLC细胞前、接种后第5天、给药后第5和10天的体重变化比较,采用重复测量设计的方差分析,结果:①不同时间点体重有差别(F=17.703,P=0.000);②4组大鼠体重有差别(F=7.976,P=0.000);③4组大鼠体重变化趋势有差别(F=21.641,P=0.000)。见表 2。
表2 Abraxne对Lewis肺癌小鼠体重的影响 (g,±s)

表2 Abraxne对Lewis肺癌小鼠体重的影响 (g,±s)
注:1)与正常对照组比较,P <0.05;2)与模型组比较,P <0.05;3)与紫素组比较,P <0.05。
组别 接种前 接种后第5 d 给药后第5 d 给药后第10 d正常对照组(n =15) 18.62±1.25 18.94±1.38 19.10±1.45 19.13±1.27模型组(n =14) 18.53±1.34 18.25±1.42 18.02±1.281) 17.75±1.031)紫素组(n =12) 18.64±1.29 18.31±1.08 17.74±0.961) 17.08±0.681)2)Abraxne组(n =15) 18.57±1.17 18.28±1.02 18.23±0.98 18.19±0.951)3)F值 0.021 1.043 3.389 9.688 P值 0.996 0.382 0.025 0.000
2.3 Abraxne对Lewis肺癌小鼠肿瘤体积的影响
模型组、紫素组、Abraxne组Lewis肺癌小鼠给予 Abraxne治疗后第 0、2、4、6、8和 10天的肿瘤体积比较,采用重复测量设计的方差分析,结果:①不同时间点的肿瘤体积有差别(F=35.128,P=0.000);②3组小鼠肿瘤体积有差别(F=8.376,P=0.000);③3组小鼠肿瘤体积变化趋势有差别(F=43.624,P=0.000)。见表 3和图 1。
表3 Abraxne对Lewis肺癌小鼠肿瘤体积的影响 (mm3,±s)

表3 Abraxne对Lewis肺癌小鼠肿瘤体积的影响 (mm3,±s)
注:1)与模型组比较,P <0.05;2)与紫素组比较,P <0.05。
组别 第0 d 第2 d 第4 d 第6 d 第8 d 第10 d模型组(n =14) 103.12±8.13 108.15±9.12 120.26±9.25 133.25±10.15 143.76±10.36 149.23±11.39紫素组(n =12) 102.33±8.22 106.26±8.02 114.33±9.271) 123.12±9.251) 127.29±9.171) 131.15±9.381)Abraxne 组(n =15) 103.25±7.12 105.43±8.16 107.56±8.291)2) 112.35±9.051)2) 115.65±8.921)2) 117.12±9.351)2)
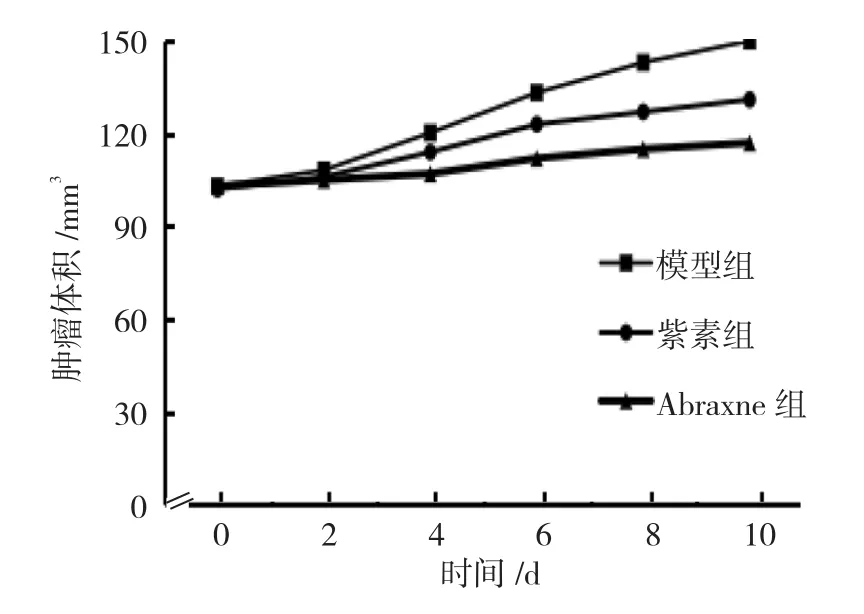
图1 Abraxne对Lewis肺癌小鼠肿瘤体积的影响 (±s)
2.4 Abraxne对Lewis肺癌小鼠肿瘤组织中Per2和SIRT1 mRNA表达的影响
模型组、紫素组、Abraxne组小鼠给药后肿瘤组织中Per2 mRNA相对表达量分别为(0.20±0.02)、(0.31±0.04)和(0.42±0.16),经单因素方差分析,差异有统计学意义(F=17.475,P=0.000)。模型组、紫素组、Abraxne组SIRT1 mRNA相对表达量分别为(0.14±0.04)、(0.23±0.05)和(0.30±0.08),经单因素方差分析,差异有统计学意义(F=25.603,P=0.000)。见图2。

图2 Lewis肺癌小鼠肿瘤组织中Per2和SIRT1 mRNA表达水平比较 (±s)
2.5 Abraxne对Lewis肺癌小鼠肿瘤组织中Per2和SIRT1蛋白表达的影响
模型组、紫素组、Abraxne组小鼠给药后肿瘤组织中Per2和SIRT1蛋白表达水平比较,经单因素方差分析,差异有统计学意义(P<0.05)。进一步两两比较经LSD-t检验,与模型组比较,紫素组、Abraxne组小鼠肿瘤组织中Per2和SIRT1蛋白表达水平升高(P<0.05)。见表 4和图 3。
表4 Abraxne对Lewis肺癌小鼠肿瘤组织中Per2和SIRT1蛋白表达的影响 (±s)
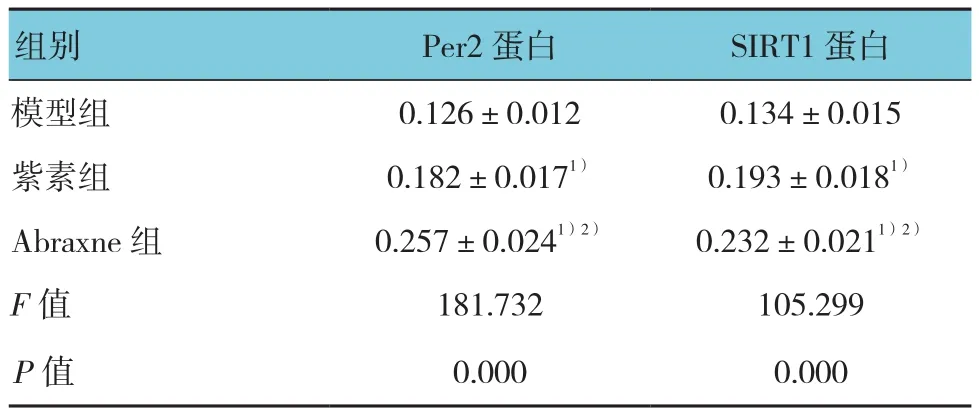
表4 Abraxne对Lewis肺癌小鼠肿瘤组织中Per2和SIRT1蛋白表达的影响 (±s)
注:1)与模型组比较,P <0.05;2)与紫素组比较,P <0.05。
组别 Per2蛋白 SIRT1蛋白模型组 0.126±0.012 0.134±0.015紫素组 0.182±0.0171) 0.193±0.0181)Abraxne 组 0.257±0.0241)2) 0.232±0.0211)2)F值 181.732 105.299 P值 0.000 0.000
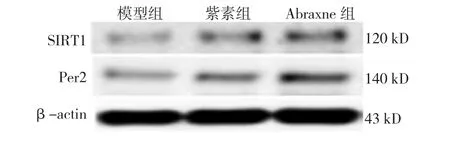
图3 Lewis肺癌小鼠肿瘤组织中Per2和SIRT1蛋白的表达
3 讨论
随着人口老龄化步伐加快和环境污染不断加剧,中国肺癌的发病率、死亡率高居不下。尽管肺癌的治疗手段不断进步,但是中、晚期肺癌的术后5年生存率仅为20%。肺癌的发生是一个多基因调控的复杂过程,致癌基因激活、抑癌基因失活或缺失与肿瘤的形成关系密切[7-9]。因此,深入挖掘肿瘤发生机制为肺癌患者的根治性治疗带来了希望。
紫杉醇是一种从红豆杉树皮中获得的广谱抗癌药物,其作用机制为抑制微管解聚,但其难溶于水,其制药溶媒为聚氧乙烯蓖麻油和无水乙醇混合物,然而该溶媒在体内降解生成的组胺可引起严重过敏反应,限制了溶剂型紫杉醇,如紫素,在临床上的应用[10-11]。Abraxne是把人血白蛋白和紫杉醇通过高压振动技术制成纳米微粒粉剂,使用时加入生理盐水溶解成120~150 nm大小的纳米粒Abraxne混悬液,即可静脉滴注。Abraxne不含助溶剂,可有效提高紫杉醇剂量,且临床用药时不必预防过敏反应[12]。白蛋白是人体内自然存在的疏水性载体,可与一些物质,如脂肪酸、脂溶性维生素、性激素等,通过可逆性共价方式结合[13-14]。白蛋白与内皮细胞膜受体gp60结合后,可激活小窝蛋白-1。小窝蛋白-1为膜表面糖基蛋白,直接协助药物跨膜运输。白蛋白药物复合体依次经过血管内皮细胞、组织、组织间隙,最终蓄积在肿瘤细胞内。此外,肿瘤组织分泌的富含半胱氨酸酸性分泌蛋白,其作用类似于白蛋白受体,可特异吸附白蛋白,因此白蛋白药物复合体可在肿瘤细胞周围聚集,提高局部药物浓度,增强抑瘤能力[15-17]。本研究通过Lewis肺癌模型小鼠实验发现,紫素干预后小鼠整体生长情况较差,活动、进食状态不佳,较模型组、Abraxne组明显消瘦,肿瘤生长速度较模型组减缓,但仍快于Abraxne组。同时通过对小鼠体重进行分析显示,各组小鼠在接种LLC细胞前、接种后第5天、给药后第5和10天均随着时间变化而变化。给予Abraxne治疗后第0、2、4、6、8和10天各组小鼠肿瘤体积大小也随着时间变化而变化。说明紫素能够抑制肿瘤生长,但易产生毒副作用。Abraxne组小鼠给药后无死亡,生长状况明显强于模型组和紫素组,Abraxne干预后肿瘤生长明显受到抑制,肿瘤生长速度明显小于模型组和紫素组,说明Abraxne较紫素更能抑制肿瘤生长,且不会产生毒副作用,临床使用更加安全。
生物钟是机体自我产生、不受外界因素控制的时间节律性,与衰老、代谢紊乱、肿瘤形成等现象息息相关。生物节律是生物钟的外在体现,包括亚日节律、近日节律、超日节律等。生物体通过近日节律调控肿瘤相关基因表达,生物钟基因异常表达可能会造成近日节律失调,导致肿瘤形成的风险上升。生物钟基因主要包括Periods(Per1-3)、Crystals(Cry1-2)、Bmal1、Clock、Ck1和Timeless[18-19]。Per2基因是近日节律系统的重要成员,参与多个信号通路,调节细胞周期及新陈代谢。研究发现,乳腺癌、卵巢癌、子宫内膜癌及肺癌组织中Per2蛋白普遍异常或缺失,Per2基因在癌旁组织中的表达水平明显强于肿瘤组织[20-22]。淋巴瘤和白血病组织中Per2蛋白表达水平明显低于正常组织,诱导Per2高度表达后,肿瘤细胞呈现出细胞周期停滞、增殖能力降低、凋亡速度加快等情况,这些结果暗示Per2在抑制肿瘤生长方面扮演重要角色。哺乳动物SIRT1基因是烟酰胺腺嘌呤二核苷酸依赖性组蛋白3脱乙酰酶,与酵母染色质沉默因子2最为同源,具有调节生物体新陈代谢、控制寿命长短等功能。SIRT1能通过去乙酰化与Per2发生作用,SIRT1被激活后,可使Per2去乙酰化,去乙酰化的Per2可被磷酸化后降解,如此周而复始[23-25]。研究发现,SIRT1在肿瘤形成过程中兼具致癌和抑癌基因的功能,其作用关键在于维持致癌和抑癌基因的平衡关系[26-27]。本研究中qRT-PCR和Western blot检测结果显示,紫素组、Abraxne组Lewis肺癌小鼠肿瘤组织中Per2、SIRT1 mRNA和蛋白表达水平较模型组升高;Abraxne组Lewis肺癌小鼠肿瘤组织中Per2、SIRT1 mRNA和蛋白表达水平较紫素组更高,推测紫杉醇抑制Lewis肺癌小鼠肿瘤生长的作用机制可能与生物钟基因Per2、SIRT1表达被激活有关,且Abraxne较紫素更能促进肿瘤组织中Per2和SIRT1蛋白的表达,Abraxne在临床上治疗肺癌的效果可能会更好。本研究的不足之处在于未阐明Per2基因的具体抑癌机制,在后续的研究中将对此进一步深入探究。
综上所述,本研究通过右腋部背侧皮下接种LLC复制Lewis肺癌小鼠模型,Abraxne干预后小鼠生长状况明显优于紫素组,肿瘤生长明显受到抑制,肿瘤组织中Per2、SIRT1 mRNA和蛋白表达水平较模型组、紫素组升高,说明Abraxne治疗肺癌的效果更好、更安全,其作用机制可能与生物钟基因Per2、SIRT1表达被强化有关。然而,肺癌发生、发展的相关因素很多,相关机制复杂,临床治疗肺癌的相关作用机制还需继续深入探究。
