高通量测序技术分析蓝狐肠道菌群多样性
2018-10-17陈双双司华哲穆琳琳李光玉刘晗璐
陈双双 司华哲 穆琳琳 李光玉 刘晗璐
(中国农业科学院特产研究所,长春130117)
蓝狐(Alopexlagopus),又名北极狐,属于脊索动物门,哺乳纲,食肉目,犬科,北极狐属[1]。蓝狐作为毛皮动物在世界范围内被大量饲养,我国的养殖地主要集中于胶东半岛、河北以及东北三省等地。蓝狐为适应寒冷的自然气候条件,体内常储存大量脂肪,对高蛋白质、高脂肪的动物性饲料有较高的利用率,并可较大范围的利用动物性饲料成分,其中包括各种鱼类、畜禽屠宰副产品(去骨的牛肉、羊肉、猪肉、兔肉、鸡肉等)以及畜禽的肝脏(如兔肝、牛肝、羊肝、鸡肝、鸭肝、鹅肝)等。目前,大多数研究集中于蓝狐的繁殖育种、营养需要量、毛皮发育等研究方面[2-5],鲜有关于蓝狐肠道菌群组成和多样性的研究。肠道微生物系统是动物本身最复杂的微生态系统,肠道中大量微生物参与营养物质的吸收、分布、代谢以及机体的免疫生理,肠道菌群的失调通常会导致动物机体功能紊乱[6-7]。因此,了解健康动物正常的肠道菌群分布,对维持肠道菌群平衡、保证动物健康有重要意义。作为肉食性单胃动物,狐的胃肠道微生物主要为大肠微生物[8],其肠道中具体含有哪些微生物,以及这些微生物在消化生理中发挥的作用,仍不清楚。本试验采用高通量测序技术对蓝狐肠道菌群组成情况进行分析,研究蓝狐肠道菌群多样性,为进一步揭示蓝狐肠道菌群对营养物质的代谢利用的作用提供微生物学基础。
1 材料与方法
1.1 试验材料
2017年9月17号从河北省昌黎县(东经39.72°、北纬119.15°)选取8只健康的育成期(5~6月龄)雄性舍饲蓝狐(F1~F8),其精神状态良好、采食均衡正常,生活环境干净卫生。现场采集蓝狐新鲜粪便时,等待蓝狐排出粪便后立即用无菌分装袋收集,防止落地被污染。采集蓝狐新鲜粪便15 g分装于5 mL的冻存管中(分装于3个管,每管5 g),放入液氮罐中带回实验室,备后续分析。蓝狐饲粮为养殖场中日常饲粮,其组成及营养水平如表1所示。
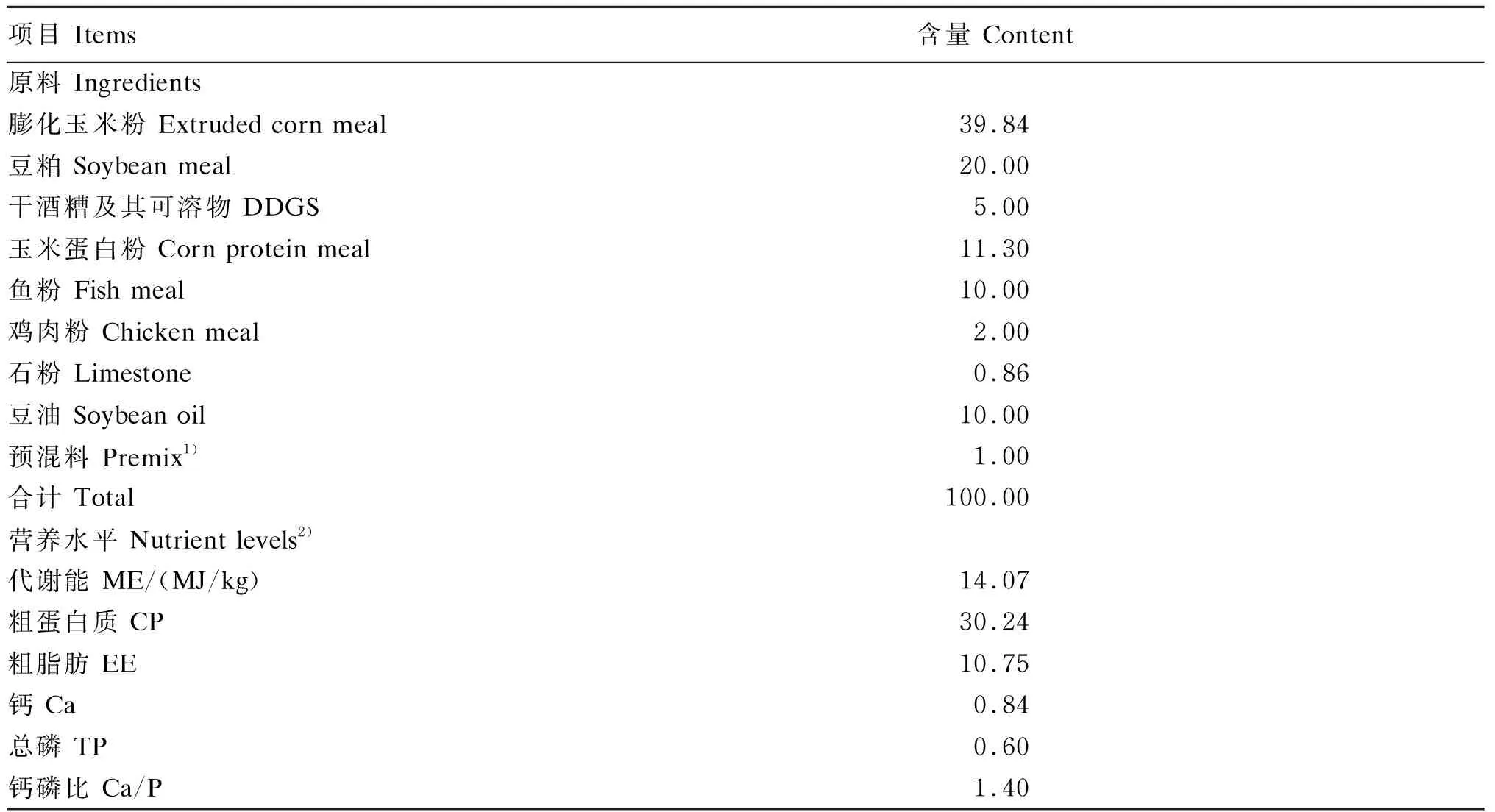
表1 蓝狐饲粮组成及营养水平(风干基础)
1)预混料为每千克饲粮提供The premix provided the following per kg of the diet:VA 10 000 IU,VB120 mg,VB210 mg,VB610 mg,VB120.1 mg,VC 120 mg,VE 60 mg,VK31.6 mg,生物素 biotin 0.5 mg,叶酸 folic acid 1.0 mg,泛酸 pantothenic acid 20 mg,烟酸 nicotinic acid 40 mg,胆碱 choline 400 mg,Cu (as copper sulfate) 10 mg,Fe (as ferrous sulfate) 80 mg,Mn (as manganese sulfate) 15 mg,Zn (as zinc sulfate) 60 mg,I (as potassium iodide) 0.50 mg,Se (as sodium selenite) 0.20 mg。
2)代谢能为计算值,其余为实测值。ME was a calculated value, while the others were measured values.
1.2 样品处理
1.2.1 微生物总DNA的提取

基因组DNA的鉴定:提取的基因组DNA经1%的琼脂糖凝胶电泳(电压120 V,电泳23 min,Marker为λⅢ DNA Maker)检测,DNA产物在14 000 bp左右,并且DNA条带亮度较高,无明显降解、无杂质,可进行下一步试验[9]。将目的DNA送至北京诺禾致源科技股份有限公司,基于Illumina Miseq测序平台,设备名称为HiSeq PE250,测序长度为250 bp。
1.2.2 目的基因的扩增与测序
以样品中提取的总DNA为模板,细菌选用16S rRNA V3/V4区合成特定引物,利用338F(5′-ACTCCTACGGGAGGCAGCA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)引物进行PCR扩增。PCR扩增体系(50 μL):上游引物(338F)1 μL,下游引物(806R)1 μL,DNA样品1 μL,Taq酶25 μL,ddH2O 22 μL。PCR扩增条件:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃复性2 min,25个循环;72 ℃延伸10 min。扩增产物4 ℃保存,经2%的琼脂糖凝胶电泳检测。
1.2.3 生物信息学分析
通过对原始数据进行拼接、过滤去杂得到有效信息,从而使信息结果更加准确、可靠。对有效信息进行聚类分析和物种分类分析,设定具有97%以上相似度的序列为1个操作分类单元(OTU),并在各分类水平统计每个样品的菌群组成。根据OTU聚类结果,进行菌群丰富度、Alpha多样性计算,其中Ace和Chao1指数用来表示菌群的丰富度,Simpson和Shannon指数用来表示菌群的多样性。在门和属2个分类水平上统计样品物种的丰度和多样性。
1.3 数据处理
结果以平均值±标准误表示,数据用Excel 2013进行整理并用SAS 9.4软件进行分析。
2 结 果
2.1 多样性指数
如表2所示,8个样本共得到654 716条序列,单个样本序列范围为57 002~95 638条,其中共得到569 930条有效序列(有效序列指tags,下文同),单个样本序列范围为52 758~84 112条。对样本进行聚类分析,在97%相似度下的OTU生物信息统计显示,共得到4 071个OTU(样本范围为468~574)。丰富度指数:Ace指数平均值为559,范围为480~699;Chao1指数平均值为595,范围为465~1036。多样性指数:Shannon指数平均值为5.27,范围为4.05~5.80;Simpson指数平均值为0.936,范围为0.847~0.957。每个样本的具体参数见表2。
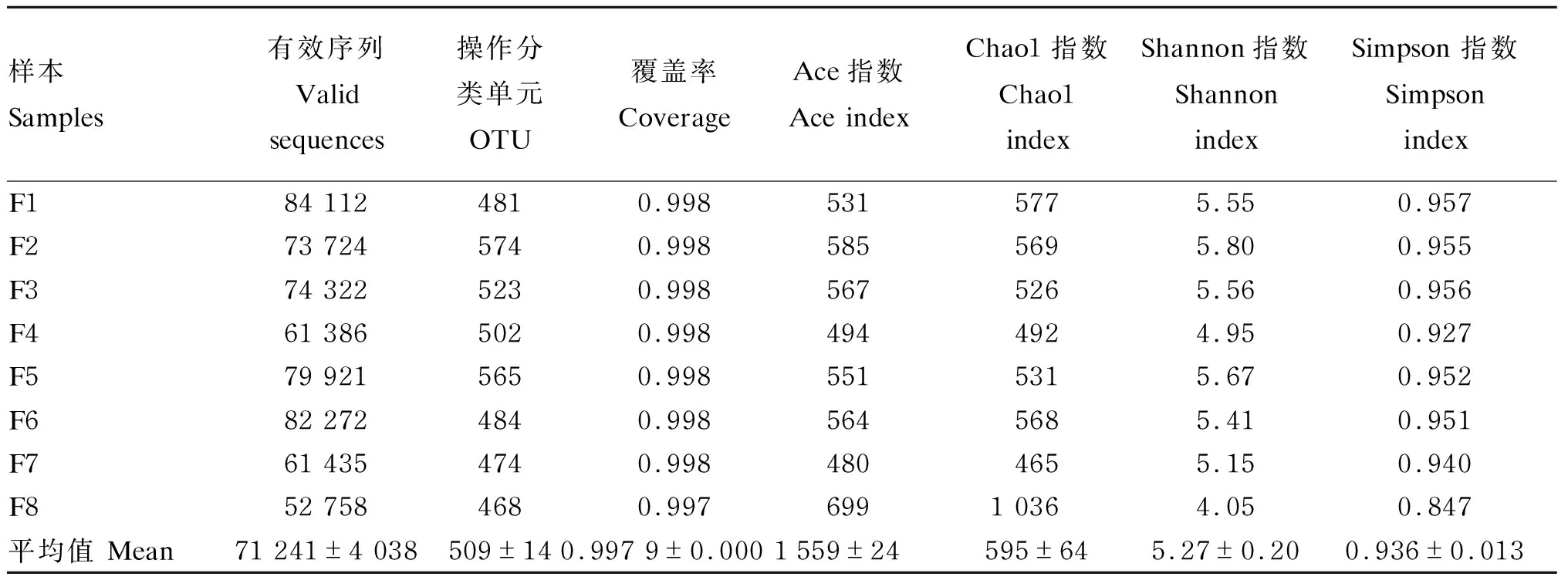
表2 样本测序数据分析
利用mothur对97%相似度的OTU做稀释曲线(图1-A),可知,当测序数量超过40 000时,各样本(F8除外)曲线逐渐趋于平缓,同时Shannon曲线(图1-B)也趋于平坦。
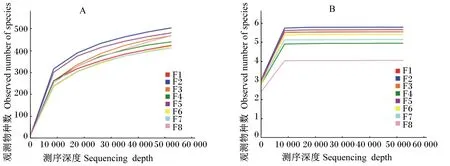
图1 稀释曲线(A)和Shannon曲线(B)分析
2.2 门分类水平下菌群结构
在门分类水平上分析,这些菌群在分类学上归属于16个门,其中厚壁菌门(Firmicutes)在蓝狐肠道菌群中的所占比例最多,占62.97%;拟杆菌门(Bacteroidetes)为第二大优势菌门,所占比例为22.05%;随后依次为放线菌门(Actinobacteria),占8.89%;变形菌门(Proteobacteria),占5.15%;梭杆菌门(Fusobacteria),占0.88%。以上5个菌门为蓝狐肠道菌群中的优势菌门,共占99.94%,具体门分类水平的分布见图2。8只蓝狐中F4与其他蓝狐的肠道菌群相似性较低,F4肠道中Bacteroidetes所占比例最高,而其他蓝狐肠道中Firmicutes为最优势菌门。
2.3 属分类水平下菌群结构
在属分类水平上分析,这些菌群在分类学上归属于209个属,其中有30个属的相对丰度占总体的85.95%。这30个属中链球菌属(Streptococcus)所占比例最高,为11.75%;随后比例较高的依次为乳杆菌属(Lactobacillus),占9.86%;普雷沃菌属(Prevotella),占9.28%;巨型球菌属(Megasphaera),占8.21%;柯林斯菌属(Collinsella),占7.27%;Blautia,占7.08%;拟杆菌属(Bacteroides),占5.64%;拟普雷沃菌属(Alloprevotella),占5.50%;Peptoclostridium,占5.07%;巨单胞菌属(Megamonas),占3.55%。具体属分类水平的相对丰度见图3。
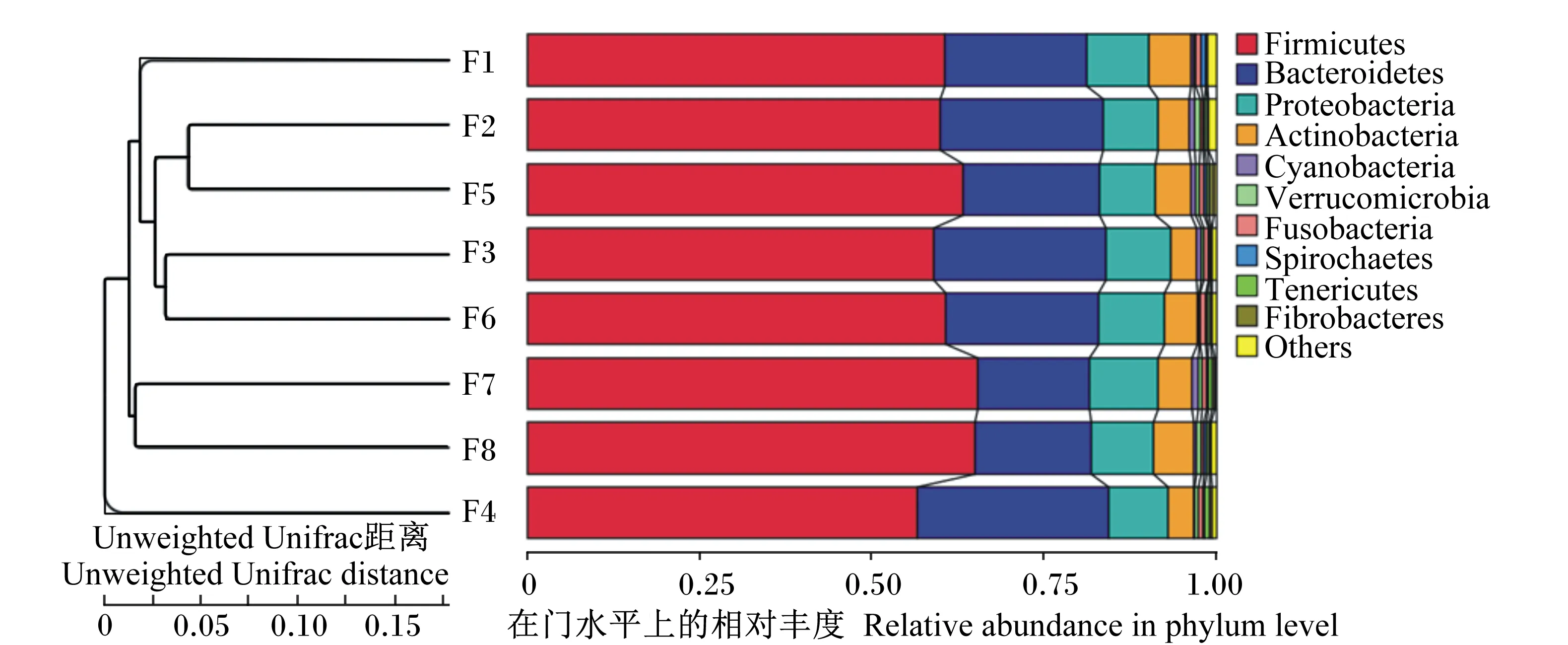
Firmicutes:厚壁菌门;Bacteroidetes:拟杆菌门;Actinobaeteria:放线菌门;Proteobacteria:变形菌门;Fusobacteria:梭杆菌门;Cyanobacteria:蓝藻菌门;Verrucomicrobia:疣微菌门;Spirochaetes:螺旋体门;Tenericutes:柔壁菌门;Fibrobacteres:纤维杆菌门;Others:其他。
图2基于UnweightedUnifrac距离的UPGMA聚类树
Fig.2 UPGMA clustering tree based on Unweighted Unifrac distance
在属水平上每只蓝狐肠道菌群中排名靠前的10种菌属所占比例见表3。F1肠道菌群中最优势菌属为Collinsella,占17.45%;F2、F3、F4肠道菌群中最优势菌属为Prevotella,分别占14.52%、13.06%、22.16%;F5、F7肠道菌群中最优势菌属为Lactobacillus,分别占17.56%、21.55%;F6、F8肠道菌群中最优势菌属为Streptococcus,分别占15.80%、25.72%。与其他蓝狐相比,F8肠道菌群中Streptococcus、Lactobacillus、Megasphaera所占比例较高,3个菌属共占71.00%。
3 讨 论
3.1 多样性指数分析
一般通过Alpha多样性分析反映样本的丰富度和多样性。本试验中,所有样本测序覆盖率(coverage)均在0.997以上,说明测序结果对蓝狐粪便样品中的细菌覆盖率高,测序结果合适,可满足肠道菌群多样性的分析需求[10]。当测序数量超过40 000时,各样本(F8除外)曲线逐渐趋于平缓,表明该测序数据量合理,随着数据量的增加几乎不产生新的OTU[11]。同时,Shannon曲线也趋于平坦,表明测序数据量足够大,从而能够反映出样品中绝大多数菌群[12]。Shannon指数越大则表示该样本中微生物多样性越丰富,由表2中Shannon指数数据可知,F8肠道中菌群多样性较低。由图1-A显示,较其他个体而言,F8个体的稀释曲线存在一定的坡度,可能是其取样深度不够,从而导致F8个体肠道菌群多样性较低。从整体来看,蓝狐肠道菌群中OTU平均值为509,Chao1指数平均值为595,Shannon指数平均值为5.27。范忠原等[13]研究发现,舍饲水貂肠道菌群中OTU为294,Chao1指数为350,Shannon指数为3.74。因此,与毛皮动物水貂相比,蓝狐肠道菌群具有较高的丰度与多样性。
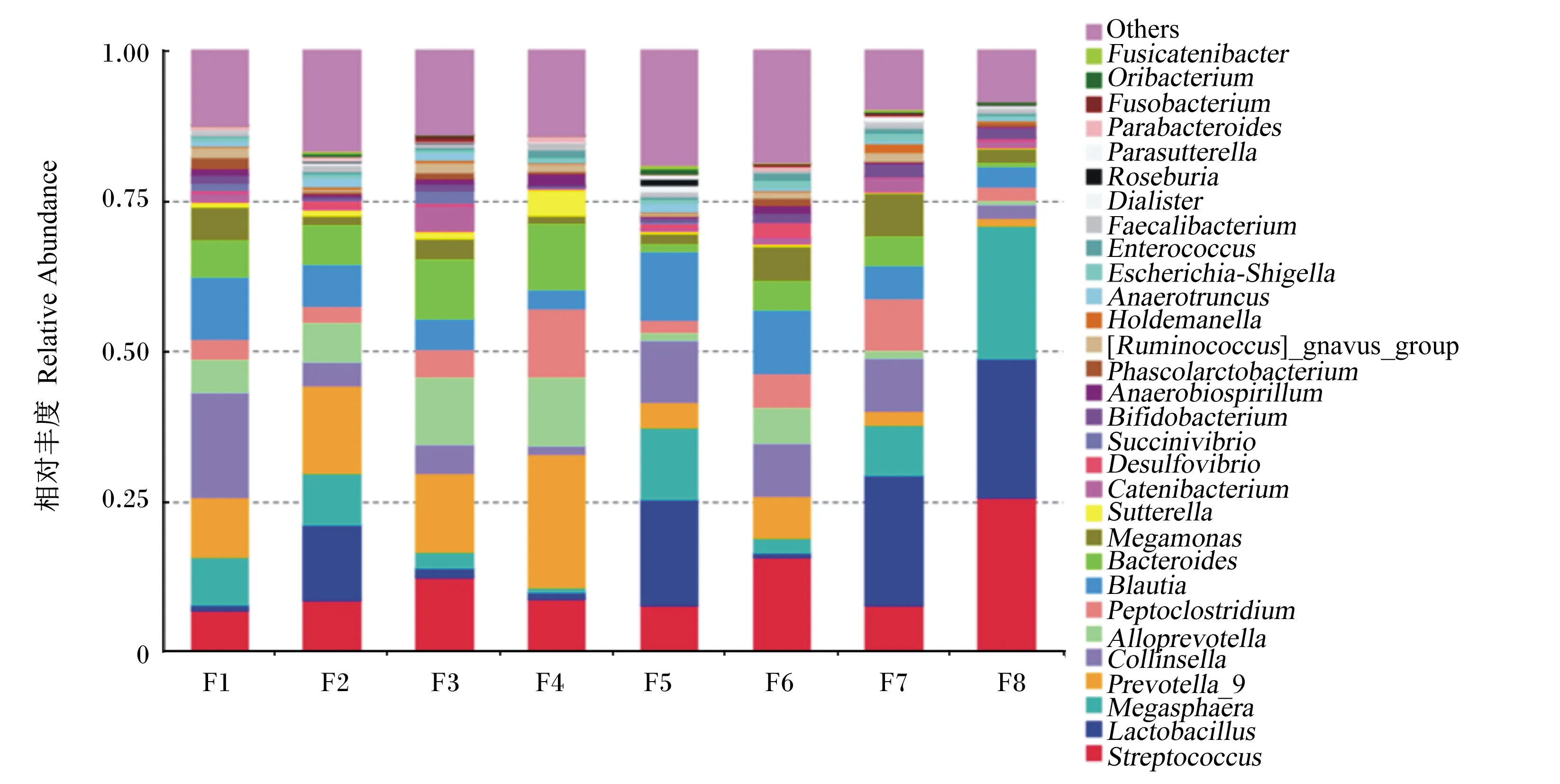
Others:其他;Fusobacterium:梭杆菌属;Roseburia:罗斯氏菌属;Dialister:杆菌属;Enterococcus:肠球菌属;Ruminococcus:瘤胃球菌属;Phascolarctobacterium:考拉杆菌属;Anaerobiospirillum:厌氧螺菌属;Bifidobacterium:双歧杆菌属;Succinivibrio:琥珀酸弧菌属;Desulfovibrio:脱硫弧菌属;Sutterella:萨特氏菌属;Megamonas:巨单胞菌属;Bacteroides:拟杆菌属;Alloprevotella:拟普雷沃菌属;Collinsella:柯林斯菌属;Prevotella:普雷沃菌属;Megasphaera:巨型球菌属;Lactobacillus:乳杆菌属;Streptococcus:链球菌属。
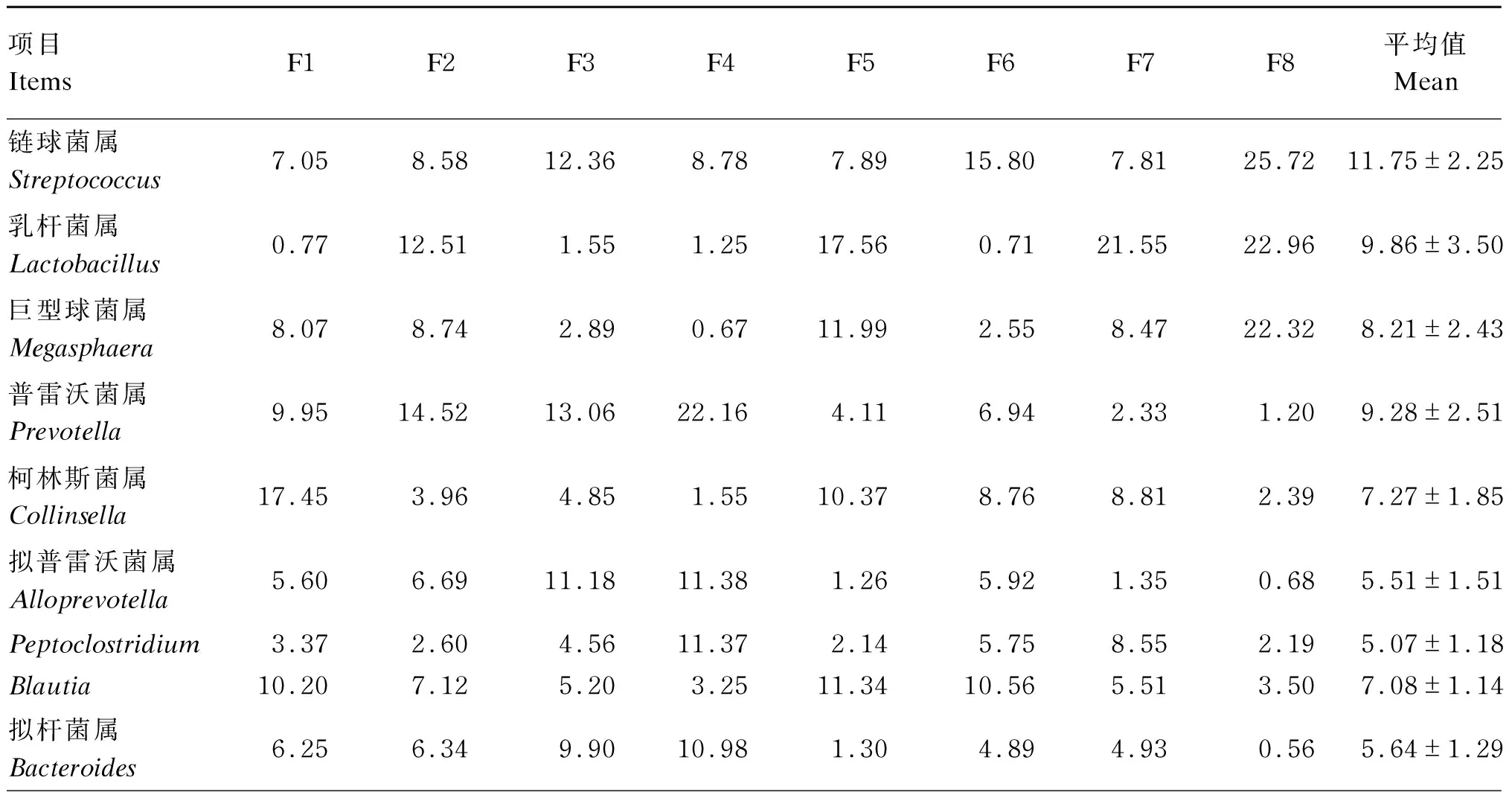
图3 蓝狐肠道菌群属分类的相对丰度
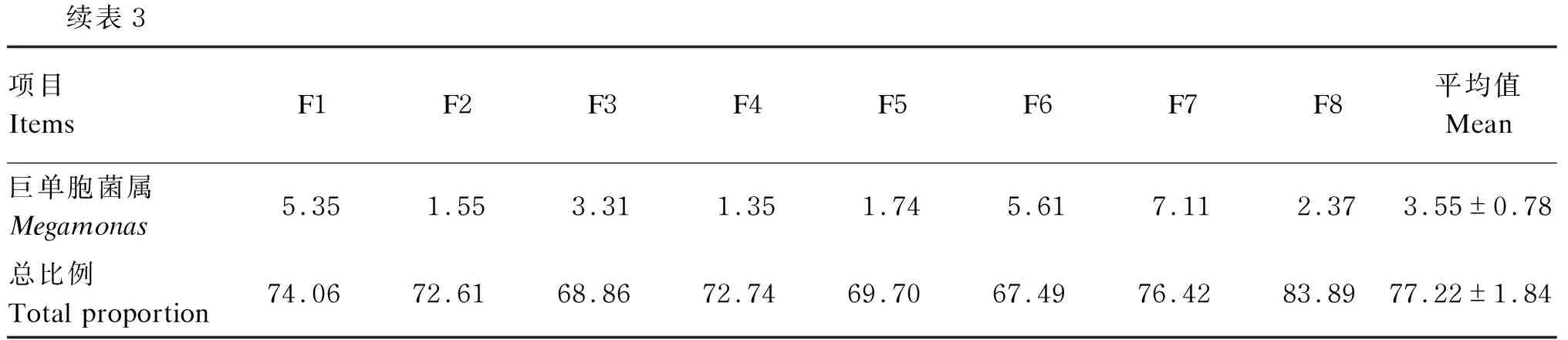
续表3项目 ItemsF1F2F3F4F5F6F7F8平均值Mean巨单胞菌属Megamonas5.351.553.311.351.745.617.112.373.55±0.78总比例Total proportion74.0672.6168.8672.7469.7067.4976.4283.8977.22±1.84
3.2 门分类水平下菌群结构分析
从门分类水平上看,蓝狐肠道菌群中主要优势菌门为Firmicutes和Bacteroidetes。8个样本中F4肠道中Bacteroidetes所占比例最高,而其他蓝狐肠道中Firmicutes为最优势菌门。研究表明,肠道中的Firmicutes主要是对碳水化合物及蛋白质起水解作用,Bacteroidetes则是对类固醇、胆汁酸及多糖起代谢作用,从而促进多糖的吸收以及蛋白质的合成[14-15]。肠道内Firmicutes与Bacteroidetes的比例对动物的肥胖程度有影响。Turnbaugh等[16]发现肥胖小鼠的肠道微生物中Firmicutes细菌的丰富度增加,Bacteroidetes细菌的丰富度降低,并发现饮食过程中对能量摄入量增多。饮食的改变会引起动物肠道菌群的改变,当动物饮食从低脂肪、高纤维素的饮食转变为高脂肪、高糖的饮食时,肠道菌群中Bacteroidetes细菌所占比例显著下降[17],从而导致肥胖增加。因此,F4肠道中菌群可能对高脂、高糖的代谢作用较强,但本试验未对试验动物的体重水平进行观察。除此之外,动物肠道菌群的组成和数量受动物的年龄、性别、生活环境、饲粮组成、生理状态、遗传因素[18-20]等的影响。8只蓝狐在生活环境和饲粮组成相同的情况下,F4和F8个体的肠道菌群组成与其他个体的肠道菌群组成存在差异性,其原因可能与动物个体的生理状态和遗传因素有关系。因此,相同环境下的不同个体间肠道菌群组成也存在一定的差异性。
研究发现,犬科动物肠道菌群在种类及数量方面存在较大差异。生活在野生环境下的健康狼(Canislupus)的粪便中最丰富的菌门是Firmicutes(60.0%),其次是Bacteroidetes(16.9%)、Proteobacteria(9.2%)、Fusobacteria(9.2%)和Actinobacteria(4.6%)[21];豺(Cuonalpinus)的肠道菌群中较丰富的5个菌门依次为Firmicutes(20.97%~44.01%)、Bacteroidetes(21.63%~38.97%)、Proteobacteria(9.33%~17.60%)、Fusobacteria(9.11%~17.90%)和Actinobacteria(1.22%~2.87%)[22];家犬的肠道菌群中最丰富的菌门为Firmicutes(47.7%),其次为Proteobacteria(23.3%)、Fusobacteria(16.6%)和Bacteroidetes(12.4%)[23]。宠物犬的肠道菌群中最丰富的菌门为Firmicutes(64.17%),其次是Bacteroidetes(19.89%)、Fusobacteria(13.58%)、Actinobacteria(1.5%)和Proteobacteria(0.86%)[24]。与其他犬科动物相比,蓝狐肠道菌群中Actinobacteria所占比例较高,该菌门中大部分细菌为红蝽菌科(Coriobacteriaceae)和双歧杆菌科(Bifidobacteriaceae)(共占Actinobacteria的99.99%),而在狼和豺肠道菌群中Bifidobacteriaceae的数量很少[21-22]。蓝狐肠道菌群Bifidobacteriaceae中仅有双歧杆菌(bifidobacteria)。研究发现人类从出生就开始携带双歧杆菌,但随着年龄的增加双歧杆菌的数量逐渐减少,并且发现双歧杆菌的主要产物为乳酸、乙酸等,其可调节肠道pH,抑制有害菌增殖[25];同时,研究发现双歧杆菌在能够维持机体肠道健康和减缓肠道老化方面具有重要作用[26]。本试验中育成期蓝狐年龄(5~6月龄)较小,因此其肠道中Bifidobacteria数量较多。与其他动物相比,蓝狐肠道菌群中Actinobacteria所占比例较高。研究发现,在应激情况下Coriobacteriaceae细菌会明显增加,该科细菌的大量存在易引起动物焦虑、紧张等情绪[27]。研究表明,Coriobacteriaceae还与高胆固醇血症[28]、肥胖、2型糖尿病[29]等密切相关。与狼和蓝狐比较,犬的肠道菌群中Fusobacteria所占比例较高[21-24,30],Bacteroidetes所占比例较低。根据《伯吉氏系统细菌学手册》,可把Bacteroidetes分为4个菌纲:拟杆菌纲(Bacteroidia)、黄杆菌纲(Flavobacteria)、鞘脂杆菌纲(Sphingobacteria)、纤维黏网菌纲(Cytophagia)[31]。蓝狐肠道菌群中Bacteroidia在Bacteroidetes中所占比例为99.77%。家犬肠道菌群中Bacteroidetes比例较低的主要原因可能在于家犬的饮食受到人为干预,饮食以狗粮为主,其饲粮中除蛋白质以外碳水化合物成分增加,与其他犬科动物相比饮食中的脂肪含量下降。将本试验结果与其他犬科动物肠道菌群结构进行比较,发现蓝狐肠道菌群多样性特征与其他犬科动物基本相同,仅在Fusobacteria、Actinobacteria的数量上存在较大差别,但蓝狐肠道菌群差异对宿主的生活习性是否存在影响还需进一步深入研究。
水貂作为我国饲养的主要毛皮动物之一,在国内被大量养殖,研究发现其肠道菌群中较丰富的5个菌门为Firmicutes(60.0%)、Bacteroidetes(16.2%)、Fusobacteria(11.5%)、Actinobacteria(5.9%)和Proteobacteria(5.3%)[13]。与蓝狐肠道菌群相比,除Fusobacteria在水貂肠道菌群中所占比例较高外,其他菌门种类与蓝狐相似。研究发现,饲粮中纤维含量的增加会导致Fusobacteria细菌数量减少[32]。水貂为肉食动物,与蓝狐饲粮相比,水貂饲粮中纤维含量较低可能导致水貂肠道细菌中Fusobacteria数量增加。研究发现,马作为草食动物,其肠道菌群中没有发现Fusobacteria细菌的存在[33]。同时,研究发现人肠道菌群中Fusobacteria所占比例较低,不足1%[34]。因此,Fusobacteria细菌可能受饲粮中植物性饲料组成的影响。
3.3 属分类水平下菌群结构分析
从属分类水平上看,蓝狐肠道菌群中最大的优势菌属为Streptococcus,与舍饲水貂的研究结果一致[13]。Streptococcus在动物肠道中能够发酵简单的糖类、分解蛋白质,其与宿主体内能量代谢紧密相关[35]。Lactobacillus是蓝狐肠道菌群中的第二大菌属。Lactobacillus作为益生菌,近年来受到越来越多的关注。Lactobacillus可与其他益生菌相互作用,治疗肠易激综合症(IBS)等疾病[36],其在动物肠道中能够发酵分解碳水化合物,产生乳酸、丁酸等,使肠道内pH下降,抑制有害菌的生长;Lactobacillus还可以产生过氧化氢,抑制肠道中念珠菌等真菌的毒性和生长[37];同时,Lactobacillus还可以激活免疫细胞,破坏机体肠道中的病原微生物,从而提高机体的免疫力[38]。Streptococcus和Lactobacillus同属于Firmicutes中的乳杆菌目(Lactobacillales),该目在蓝狐肠道菌群中所占比例为22.5%。Prevotella为Bacteroidetes中的拟杆菌目(Bacteroidales),具有促进蛋白质分解的作用,其在瘤胃中还能协同其他微生物分解纤维素,提高纤维素的降解能力[39]。研究发现,非洲布基纳法索(Burkina Faso)儿童肠道中普氏菌属占53%,而同龄的欧洲儿童却很少[40],饮食习惯与肠道菌群的组成密切相关,以蛋白质和动物性脂肪为主要食物的西方人肠道菌群多以Bacteroides为主,而以碳水化合物为主要食物的非洲人,肠道菌群则主要以Prevotella为主[41]。Collinsella属于Actinobacteria中的Coriobacteriales,研究发现该属中的细菌能够发酵碳水化合物产生甲酸、乳酸盐、乙醇等,并与体重、体重指数(BMI)呈负相关[42]。Blautia属于Firmicutes,该菌属能将肠道中的气体转化成乙酸,从而可清除肠道中的气体[10]。Blautia属于毛螺旋菌科(Lachnospiraceae),该菌科在瘤胃动物中主要具有降解半纤维素的能力[43],而这些细菌同样大量存在于蓝狐肠道中,但该类细菌在蓝狐肠道中的作用仍有待进一步研究确定。因此,蓝狐肠道菌群中包括能够促进类固醇、胆汁酸及多糖代谢的Bacteroidetes,能够促进蛋白质分解的Streptococcus,能够发酵分解碳水化合物、抑制有害菌的生长的Lactobacillus和Collinsella,以及能够促进纤维降解的Prevotella和Blautia等,从而组成丰富多样化的肠道菌群。
蓝狐为肉食性动物,但人们为减少蓝狐的养殖成本,在养殖过程中对蓝狐饲粮进行人为干预,使蓝狐饲粮的动物性蛋白质在饲粮中的比例降低,而植物性蛋白质在饲粮中的比例增加。目前并未发现对野生蓝狐和以动物性蛋白质为主的蓝狐肠道菌群的报道,本试验蓝狐饲粮以植物性蛋白质为主,因此其肠道菌群不能代表以肉食(野生蓝狐或者以动物性蛋白质为主的蓝狐)为主的蓝狐的肠道菌群,以植物性蛋白质为主的蓝狐肠道菌群和以肉食为主的蓝狐肠道菌群差异性无从得知。但在野生犬科动物(狼、沙狐、赤狐、乌苏里貉、豺)肠道菌群中并未发现纤维素降解菌Prevotella的存在[8],而在本试验饲粮条件下蓝狐肠道菌群中Prevotella为优势菌属,蓝狐肠道菌群中Prevotella增加的原因可能是其饲粮组成的改变导致其肠道菌群结构的改变。因此,后续试验需对野生蓝狐和以动物性蛋白质为主的蓝狐的肠道菌群组成进行研究,并对以植物性蛋白质为主和以肉食为主的蓝狐肠道菌群组成的差异性进行研究。
属水平上个体间差异性分析显示,F8肠道菌群中Streptococcus、Lactobacillus、Megasphaera所占比例较高,其他菌属所占比例较低,这种现象可能是样本的测序取样深度不够所致。除此之外,动物肠道菌群组成和多样性还受到动物的遗传因素的影响[20],因此,相同环境下的不同个体间肠道菌群组成和多样性也存在一定的差异性。这些优势菌属与营养物质代谢存在密切的联系,在动物肠道中主要起到分解蛋白质以及提高纤维素的降解能力的作用,但对于这种联系的机理仍需继续开展大量的研究。
4 结 论
本试验饲粮条件下的8只蓝狐肠道菌群分布于16个菌门,主要为Firmicutes(62.97%)、Bacteroidetes(22.05%)、Actinobacteria(8.89%)、Proteobacteria(5.15%)和Fusobacteria(0.88%),占菌门总量的99.94%;所有菌门分布于209个菌属,组成丰富多样化的肠道菌群,在属的分类水平上Streptococcus所占比例最高,为11.75%,其次为Lactobacillus,占9.86%。
